猕猴桃适宜采摘期确定及其贮藏性能
张 承,王秋萍,冉 飞,陈 鹏,吴小毛,龙友华,唐靖文,黄亚欣
猕猴桃适宜采摘期确定及其贮藏性能
张 承1,2,王秋萍3,冉 飞1,陈 鹏1,吴小毛1,龙友华1※,唐靖文4,黄亚欣4
(1. 贵州大学农学院,贵阳 550025;2. 江苏大学农业装备工程学院,镇江 212013;3. 贵州农业职业学院,清镇 551400;4. 修文县猕猴桃产业发展局,修文 550200)
为研究猕猴桃果实生长发育及其适宜采收期。以贵长猕猴桃为试材,采用未浸果和浸果(氯吡脲10 mg/L)处理,监测了谢花后9~128 d果实生长发育规律与6个不同采收期下贮藏期果实品质及贮藏性的变化。结果表明,‘贵长’猕猴桃果实生长可分为3个时期:快速生长期(谢花后9~23 d)、缓慢生长期(谢花后23~100 d)和平缓生长期(谢花后100~128 d)。‘贵长’猕猴桃果实在生长期内,硬度变化呈先升高后降低,干物质和可滴定酸含量变化呈先快速增加后缓慢增加,可溶性固形物、可溶性总糖、叶绿素和可溶性蛋白含量变化呈逐渐增加,总酚和黄酮含量变化呈波动增加。10 mg/L氯吡脲浸果明显提高了‘贵长’猕猴桃果实的生长速率和生长量,降低了生长期果实的硬度;且能增加生长期和贮藏期果实干物质和可溶性蛋白含量、减少可滴定酸、总酚和黄酮含量,提高谢花后58~128 d和贮藏期果实可溶性固形物、可溶性总糖和叶绿素含量;但加速贮藏期糖高峰出现和可滴定酸损失,降低了贮藏性能。早采或晚采以及10 mg/L氯吡脲浸果均可加速‘贵长’猕猴桃果实的软化、硬度降低、质量和营养物质的损失,极显著地(<0.01)增加果实腐烂率。‘贵长’猕猴桃较适宜的采收期为谢花后125~132 d,即干物质达16.5%~17.5%、可溶性固形物达6.5%~7.5%间采收。该研究可为猕猴桃优质生产及适宜采收期提供理论支撑。
猕猴桃;氯吡脲;生长;发育;贮藏性能;采收期
0 引 言
‘贵长’猕猴桃(cv. Guichang)系猕猴桃中的优良绿肉品种,果形品质好、酸甜适中、耐贮藏、丰产性能高[1]。现已发展成贵州省特色精品水果之一和当地的支柱产业,全省现有种植面积近2万hm2[2-3]。修文县是‘贵长’猕猴桃的主产区,于1989年开始种植,现有面积近1.33万hm2,规划于十三五期末建成2万hm2。“修文猕猴桃”先后获“国家地理标志性保护产品”、“贵州省名牌产品”等多个称号,深受消费者青睐而享誉国内外。近年来,随着‘贵长’猕猴桃在省内外栽培面积逐年扩张,果实品质参差不齐、栽培管理措施多样、采收期差异化、高品质或同质化难实现等问题突出呈现。而掌握‘贵长’猕猴桃果实生长发育规律及贮藏性能,对制定‘贵长’猕猴桃适宜的栽培管理技术和采收期以及产业的持续健康发展具有重要的现实意义。
当前,研究者们对猕猴桃属其它品种果实生长规律已有较多报道[4-8],研究多集中在对果实生长规律的监测。对‘贵长’猕猴桃果实生长发育及贮藏性研究方面,金方伦等[9]仅报道了其在黔北地区果实生长的规律,而对其生长期内果实营养品质变化,不同采收期的贮藏性能以及生长调节剂(氯吡脲)的使用与否对果实生长发育及贮藏性差异和其在贵州主产区果实生长规律未曾报道。氯吡脲(Forchlorfenuron),可促进细胞分裂、分化和扩大,广泛应用于猕猴桃、葡萄和番茄等多种作物以提高产量[10-11]。其在提高猕猴桃果实产量的同时,如何保持果实风味和营养品质及其安全性受到消费者和研究者们广泛关注[12-16]。如朱杰丽等[15]研究表明,氯吡脲5~10 mg/L处理能改善‘徐香’果实生长及营养品质,高浓度氯吡脲虽增加果重,但风味与营养品质均下降。基于此,本研究探讨了未浸果和浸果处理(氯吡脲10 mg/L)对‘贵长’猕猴桃果实生长发育以及不同采收期果实贮藏性能的影响,以期为‘贵长’猕猴桃优质丰产栽培技术及其适宜采收期的确定提供技术依据。
1 材料与方法
1.1 试验地概况
试验于2017年在贵州修文县龙场镇干坝村长兴种植农民专业合作社(26°79′80.0″N,106°56′58.2″E)猕猴桃园进行,平均海拔1 267m,亚热带季风性湿润气候,年平均气温16.7 ℃,年降雨量达1 293 mm,雨热同期。主栽品种为‘贵长’猕猴桃,“T”型架栽培,树龄4 a,株行距3 m×3 m,每667 m2种植74株,其中雌株67株,田间管理按绿色食品管理标准进行。供试果园土壤类型为黄壤,试验前在果园内随机、多点混合采集深0~60 cm的土样作为土壤背景值,其有机质含量2.59%,全氮含量0.138%,全磷含量0.165%,全钾含量3.44%,速效氮含量0.096%,速效磷含量0.042%,速效钾含量0.316%,有效锌含量0.002%,有效铁含量0.050%,有效锰含量0.020%,pH值5.60。
1.2 试验设计
试验设未浸果和浸果2个处理,浸果采用氯吡脲10 mg/L处理(四川国光农化股份有限公司,农业农村部农药检定所规定氯吡脲在猕猴桃生产中的推荐用量为5~20 mg/L)。每个处理设4次重复,每个重复2棵树,授粉时间为2017年5月11日-13日,浸果时间为5月24日(谢花时间),共8个小区,各小区及其周围设保护行。
1.3 试验方法
1.3.1 ‘贵长’猕猴桃果实生长发育规律调查方法
于浸果后9 d(6月2日)开始至采果期每周监测果实纵径、横径、侧径、单果体积、单果重及硬度,浸果后30 d(6月30日)开始至采果期每周监测果实干物质、可溶性固形物、可溶性总糖、可滴定酸、可溶性蛋白、叶绿素、总酚和黄酮等品质参数。每个时期采集每个重复2棵果树的东、南、西、北、中部位的2个果实,每小区20个果带回实验室测定外观和内在品质。果实单果质量采用分析天平测定;纵径、横径、侧径、单果体积测定:游标卡尺测定每个重复20个果后取平均值,并利用旋转椭球体积公式计算猕猴桃近似体积;硬度采用GY-4数显式果实硬度计测定。果品品质测定方法[17]:干物质含量采用烘干法测定,可溶性固形物含量用PAL-1型折光仪测定,可溶性总糖含量用硫酸蒽酮比色法测定,可滴定酸含量用酸碱滴定法测定,叶绿素含量用紫外分光光度计测定。可溶性蛋白测定参照曹健康[18]法测定,总酚含量测定参照吴峰华等[19]法测定,黄酮含量测定参照李琨等[20]法测定。
1.3.2 ‘贵长’猕猴桃果实贮藏性能调查方法
试验调查2017年9月5日、9月12日、9月19日、9月26日、10月3日、10月10日等6个不同采收期‘贵长’猕猴桃果实的贮藏性能,每个采收期采集每个处理8棵果树的东、南、西、北、中部位的3个果实混合,每小区120个果带回实验室随机分成2组,每组60个,置于室温((25±1) ℃)条件下贮藏;一组用于监测果实软化率(如式(1))、失重率(如式(2))和累计腐烂率(如式(3))变化,另一组用于监测果实品质和抗病物质变化。监测时间为采收后每周测定调查,连续调查5周,品质和抗病物质指标测定参照1.3.1。



1.4 数据分析
试验数据(均为4次重复)利用Excel 2003和 DPS v7.05 统计软件进行统计分析,对只有2个处理数据的差异显著性分析采用检验。
2 结果与分析
2.1 ‘贵长’猕猴桃果实生长发育规律
2.1.1 果实纵横侧径、体积变化规律
图1为‘贵长’猕猴桃果实纵径、横径、侧径和单果体积变化。由图1可知,‘贵长’猕猴桃果实纵横侧径和单果体积的生长变化大致可分为个时期:1)快速生长期(谢花后9~23 d,持续时长14 d),纵横侧径和单果体积快速增长,未浸果和浸果处理果实纵横侧径和单果体积生长量分别占总生长量的72.34%和73.62%、68.73%和68.92%、68.86%和68.08%、34.24%和34.54%。2)缓慢生长期(谢花后23~100 d,持续时长77 d),期间未浸果和浸果处理果实纵横侧径和单果体积生长量分别占总生长量的22.65%和24.20%、28.42%和29.36%、26.00%和30.96%、53.30%和60.67%。3)平缓生长期(谢花后100~128 d,持续时长28 d),此期果实略有生长,但生长量占总生长量份额很小。未浸果和浸果处理相比,浸果处理果实纵横侧径和单果体积在整个生长期均大于未浸果处理,且生长速率也较快;果实到成熟时,浸果处理果实纵横侧径和单果体积分别较未浸果处理提高了4.64%、7.76%、7.26%和18.43%。
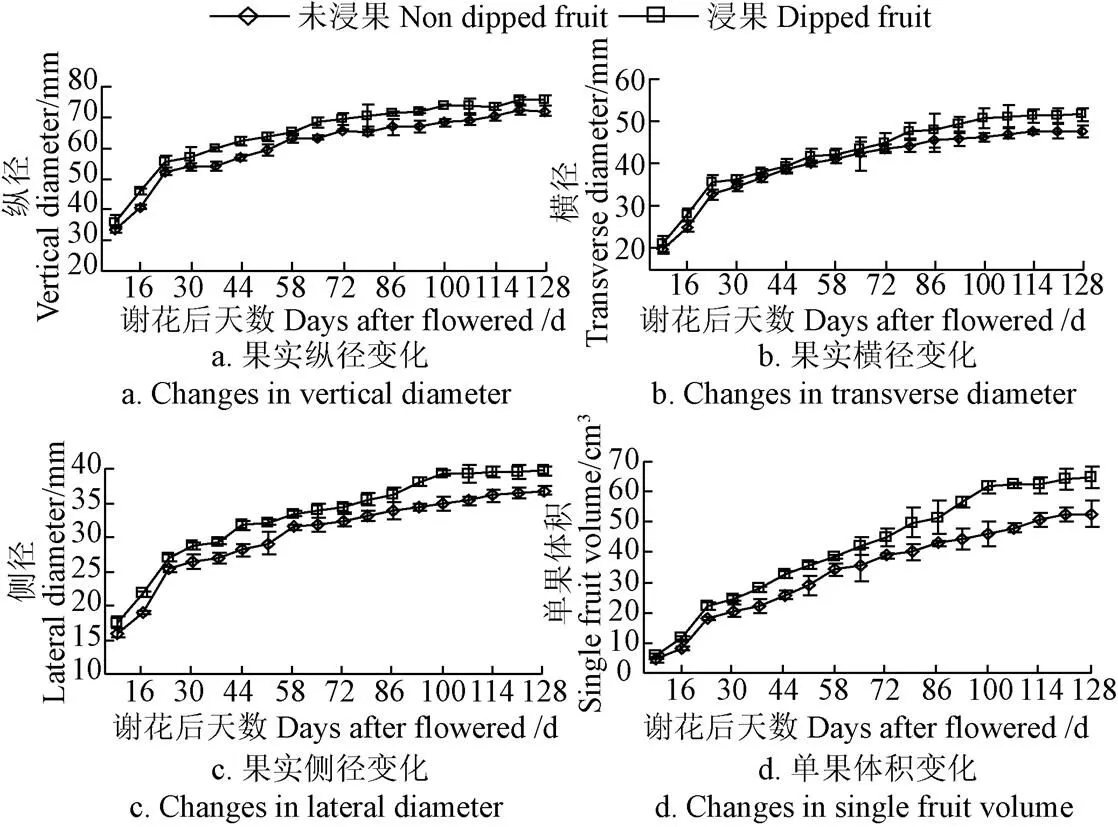
图1 ‘贵长’猕猴桃果实纵径、横径、侧径和单果体积在谢花后9~128 d的变化
2.1.2 果实单果质量和硬度变化规律
图2为‘贵长’猕猴桃果实单果质量和硬度变化。图2显示,‘贵长’猕猴桃果实单果质量变化趋势与果实纵横侧径和单果体积变化趋势一致,也经历了快速生长、缓慢生长和平缓生长3个时期,未浸果和浸果处理生长量分别为32.14%和33.73%、62.70%和60.12%、5.16%和6.15%;果实到成熟时,浸果果实单果质量较未浸果果实提高了17.91%。果实硬度变化呈先增加后降低的趋势,谢花后72 d硬度达到最大值,未浸果和浸果分别为71.06和68.90 kg/cm;谢花72 d(8月上中旬)后硬度下降,可能是从这时期起果实淀粉含量逐渐下降、营养物质快速积累、果汁增多而引起的。且整个生长期未浸果果实硬度均大于浸果果实,到果实采收时浸果果实硬度比未浸果降低了2.73 kg/cm。
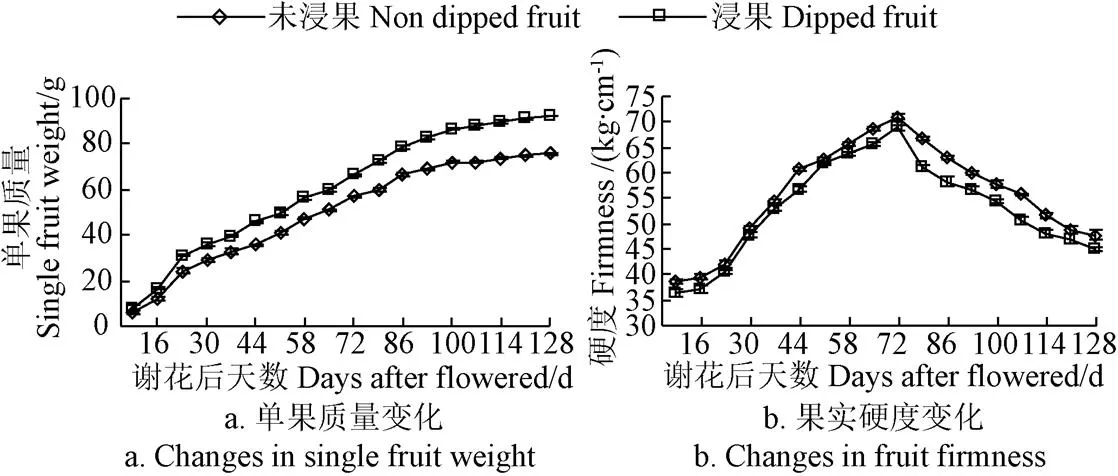
图2 ‘贵长’猕猴桃果实单果质量和硬度在谢花后9~128 d的变化
2.1.3 果实干物质、可溶性固形物、可溶性总糖和可滴定酸变化规律
图3为‘贵长’猕猴桃果实干物质、可溶性固形物、可溶性总糖和可滴定酸含量变化。
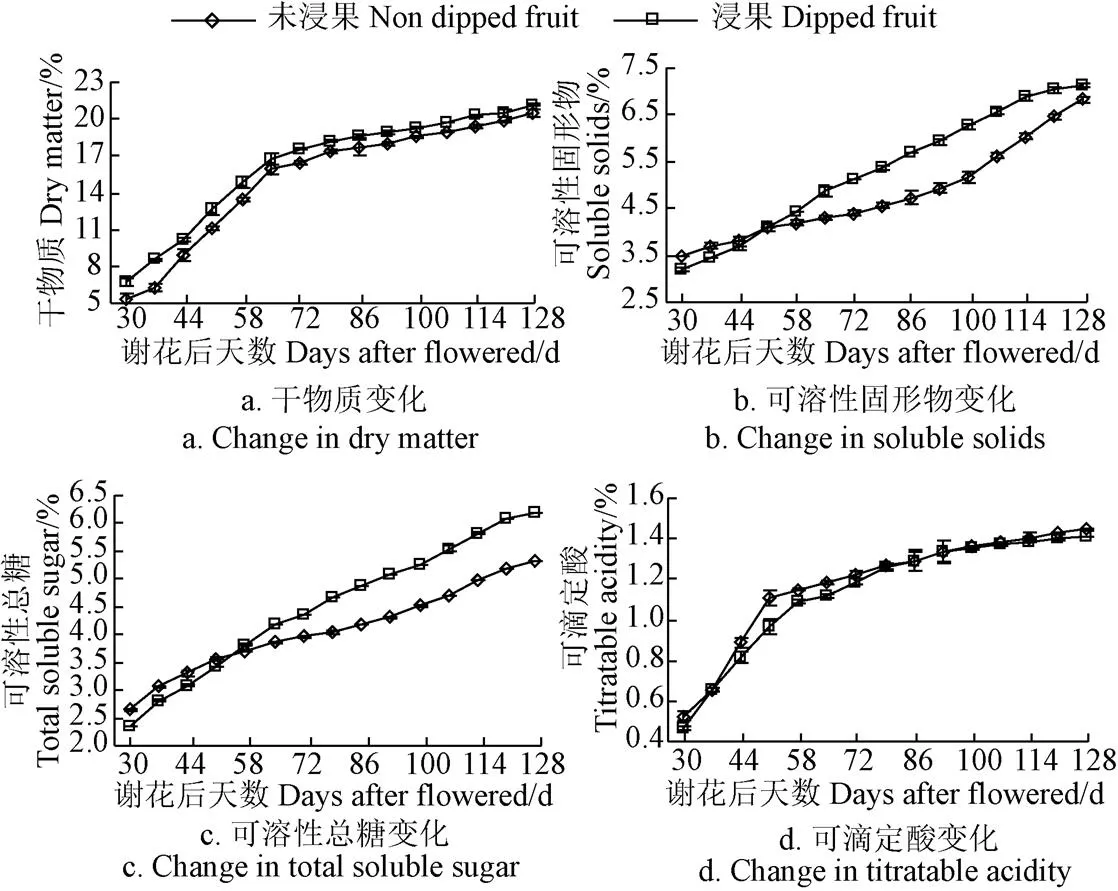
图3 ‘贵长’猕猴桃果实干物质、可溶性固形物、可溶性总糖和可滴定酸含量在谢花后30~128 d的变化
由图3可知,‘贵长’猕猴桃果实在生长期内干物质和可滴定酸变化呈先快速增加后缓慢增加的趋势,可溶性固形物和可溶性总糖呈逐渐增加的趋势,浸果处理可提高成熟时果实干物质、可溶性固形物和可溶性总糖含量,降低可滴定酸含量。干物质在谢花后30~65 d内快速增加,未浸果和浸果果实干物质生长积累量分别占成熟时总量的77.46%和78.94%,谢花后65~128 d内呈缓慢增长,且整个生长期内浸果果实干物质含量均高于未浸果果实。可滴定酸在谢花后30~51 d内快速增加,未浸果和浸果果实可滴定酸积累量分别占成熟时总量的76.61%和68.72%,谢花后51~128 d内呈缓慢增长,且整个生长期内浸果果实可滴定酸含量均低于未浸果果实。未浸果果实可溶性固形物和可溶性总糖含量在谢花后30~51 d内均高于浸果果实,而在谢花后58~128 d内却均低于浸果果实,这可能与浸果果实生长初期果实快速膨大增长,细胞分裂占优势相关。
2.1.4 果实叶绿素、可溶性蛋白、总酚和黄酮变化规律
图4‘贵长’猕猴桃果实叶绿素、蛋白质、总酚和类黄酮含量变化。为图4表明,‘贵长’猕猴桃果实叶绿素和可溶性蛋白含量变化呈逐渐升高的趋势、总酚和黄酮含量变化呈波动升高的趋势;浸果处理可增加果实叶绿素和可溶性蛋白含量,降低总酚和黄酮含量。未浸果果实叶绿素含量在谢花后30~51 d内均高于浸果果实,而在谢花后58~128 d内低于浸果果实。可溶性蛋白含量在谢花后30~93 d内缓慢升高,在谢花后93~128 d内呈快速升高,且整个生长期内浸果果实可溶性蛋白含量均高于未浸果果实。总酚和黄酮含量是果实抗病的重要物质,在整个生长期内果实总酚含量未浸果果实均高于浸果果实,而黄酮含量时而高时而低于浸果果实,但整体趋势为浸果处理降低了果实总酚和黄酮含量。

图4 ‘贵长’猕猴桃果实叶绿素、蛋白质、总酚和类黄酮含量在谢花后30~128 d的变化
2.2 ‘贵长’猕猴桃果实贮藏性能
2.2.1 贮藏期果实软化率变化规律
图5为不同采收期对‘贵长’猕猴桃果实软化率变化的影响。由图5可得,随着贮藏时间的延长,‘贵长’猕猴桃果实软化率逐渐升高。浸果处理加快了果实的软化进程,不同采收期浸果果实在贮藏29 d软化率达100%,未浸果果实软化率均未达100%。未浸果处理果实贮藏36 d时,9月26日和10月3日采样果实软化率仍未全部软化,其余4个采样时期的果实全部软化。同一采收期内,浸果处理的软化进程也较未浸果的快;不同采收期内,早采和晚采均可加速果实的软化,较为适宜的采收期为9月26日-10月3日,即‘贵长’猕猴桃果实干物质约为16.5%~17.5%、可溶性固形物约为6.5%~7.5%采收较佳。
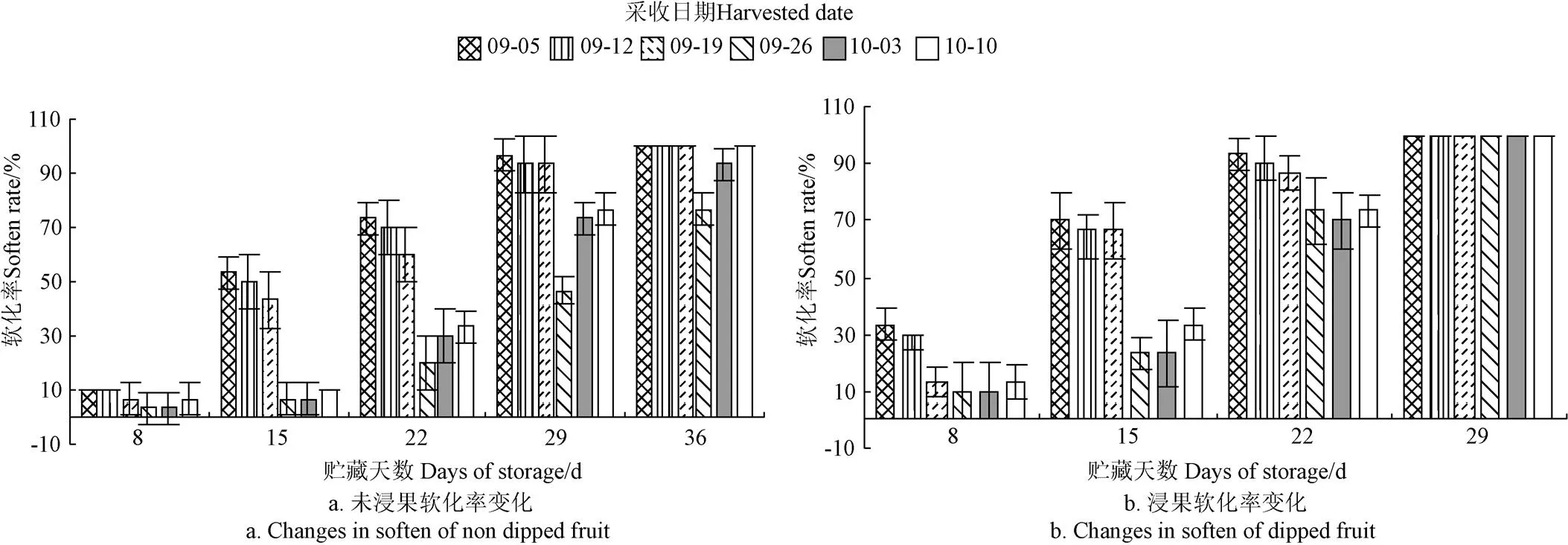
图5 不同采收期对‘贵长’猕猴桃在贮藏期8~36 d内果实软化率变化的影响
2.2.2 贮藏期果实失重率变化规律
图6为不同采收期对‘贵长’猕猴桃果实失重率变化的影响。图6表明,随着贮藏时间的延长,‘贵长’猕猴桃果实失重率逐渐增加。早采或晚采加速了果实质量的损失,如9月5日和9月12日采收果实失重速率明显高于其它采样时期,而该2个采收时期未浸果处理的失重速率较浸果处理快,这可能是该时期未浸果果实未完全成熟、干物质和营养物质含量少引起的。9月19日-10月10日采收,浸果处理的失重速率比未浸果的快,加速了果实质量损失;较为适宜的采收期为9月26日-10月3日,此时期果实失重速率较慢,有利于‘贵长’猕猴桃果实的贮藏。

图6 不同采收期对‘贵长’猕猴桃在贮藏期8~36 d内果实失重率变化的影响
2.2.3 贮藏期果实腐烂率
图7为不同采收期对猕猴桃果实腐烂率变化的影响。由图7可知,浸果处理显著增加了‘贵长’猕猴桃果实的腐烂率,不同采收期间浸果处理果实软化率均极显著地(<0.01)高于未浸果处理。未浸果处理条件下,早采或晚采均可增加果实腐烂率,腐烂率较低的采收期是9月26日和10月3日,其腐烂率控制在10%以内。浸果处理下,腐烂率较低的采收期是10月3日,其腐烂率为33.33%。

注:不同小写字母表示同一时期未浸果和浸果间差异显著(P<0.05),大写字母表示差异极显著(P<0.01),2个测定结果的差异显著性测定采用T检验;柱上括号内小写字母表示同一处理不同采收时期间差异显著(P<0.05),大写字母表示差异极显著(P<0.01)。
2.2.4 贮藏期果实硬度及干物质含量变化规律
图8为不同采收期对‘贵长’猕猴桃果实硬度和干物质含量变化的影响。图8显示,随着贮藏时间的延长,‘贵长’猕猴桃果实硬度逐渐降低。与果实软化率相一致,浸果处理加快了果实的软化进程,进而加速了果实硬度的损失。同一采收期内,未浸果果实硬度在整个贮藏期内均比浸果处理高。不同采收期间,早采或晚采均加速了果实硬度的降低;较为适宜的采收期为9月26日-10月3日,较其它采收期其更有利于维持果实的硬度,延长了果实的贮藏时间,增强了贮藏性。随着贮藏时间的延长,‘贵长’猕猴桃果实干物质变化呈先升高后降低再升高的趋势,浸果处理可提高果实干物质含量。早采或晚采果实干物质含量均较低,且随贮藏时间的延长干物质提高量较低;由图8亦可知,适宜的采收期为9月26日-10月3日。
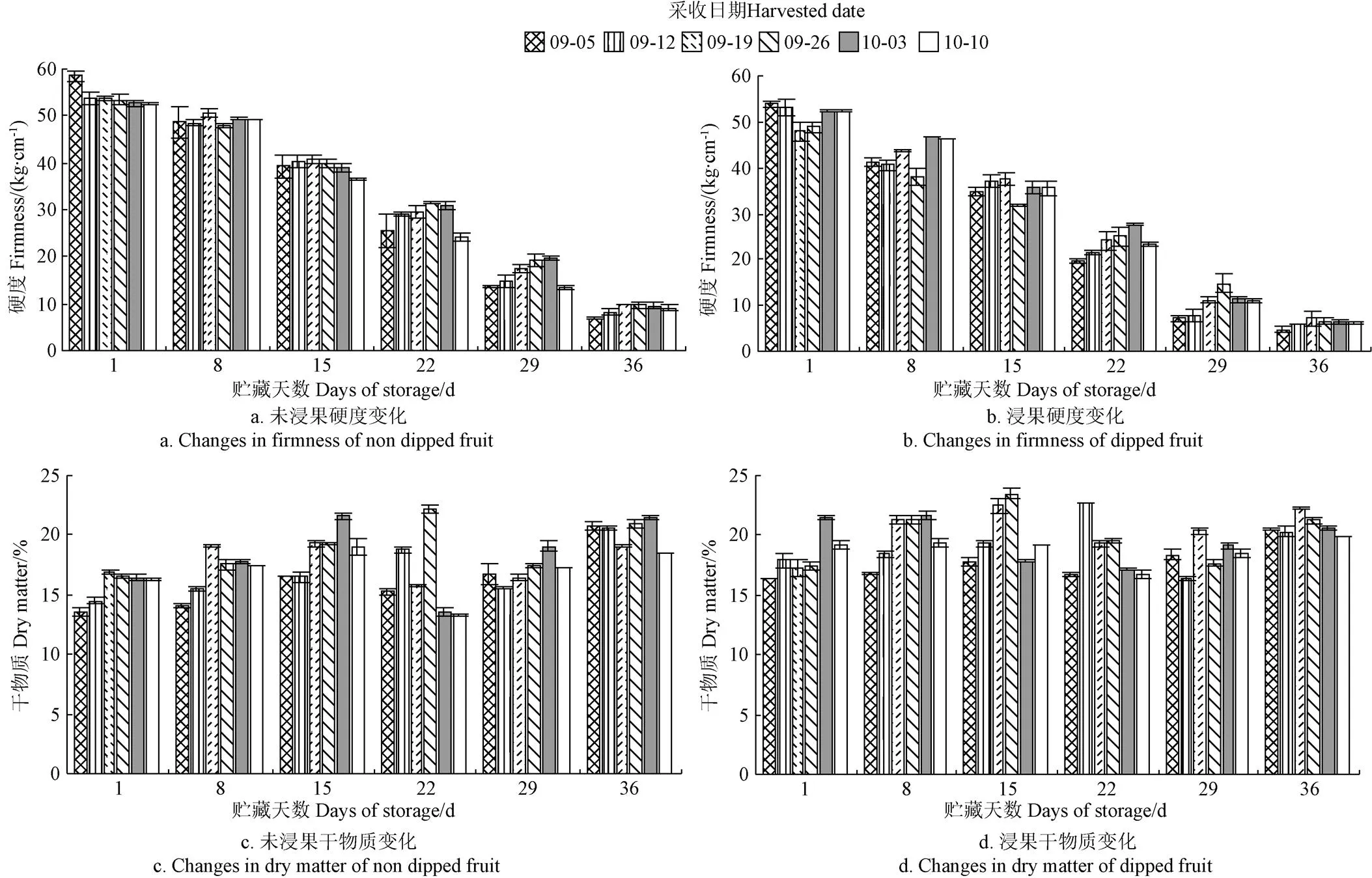
图8 不同采收期对‘贵长’猕猴桃在贮藏期1~36 d内果实硬度和干物质含量变化的影响
2.2.5 贮藏期果实可溶性固形物和可溶性总糖含量变化规律
图9为不同采收期对‘贵长’猕猴桃果实可溶性固形物和可溶性总糖含量变化的影响。由图9可得,随着贮藏时间的延长,未浸果果实可溶性固形物和可溶性总糖含量均呈逐渐升高的趋势,浸果果实可溶性固形物和可溶性总糖含量均呈先升高后降低的趋势。浸果处理在贮藏29 d时达到了糖高峰,之后开始下降,其加速了糖分的损失和果实的软化,降低了果实的贮藏性。早采果实可溶性固形物和可溶性总糖含量较低且软化后期增加量也降低,适宜的采收期维持并延缓了果实可溶性固形物和可溶性总糖含量及损失,较佳的为9月26日-10月3日。
2.2.6 贮藏期果实可滴定酸和叶绿素含量变化规律
图10为不同采收期对‘贵长’猕猴桃果实可滴定酸和叶绿素含量变化的影响。
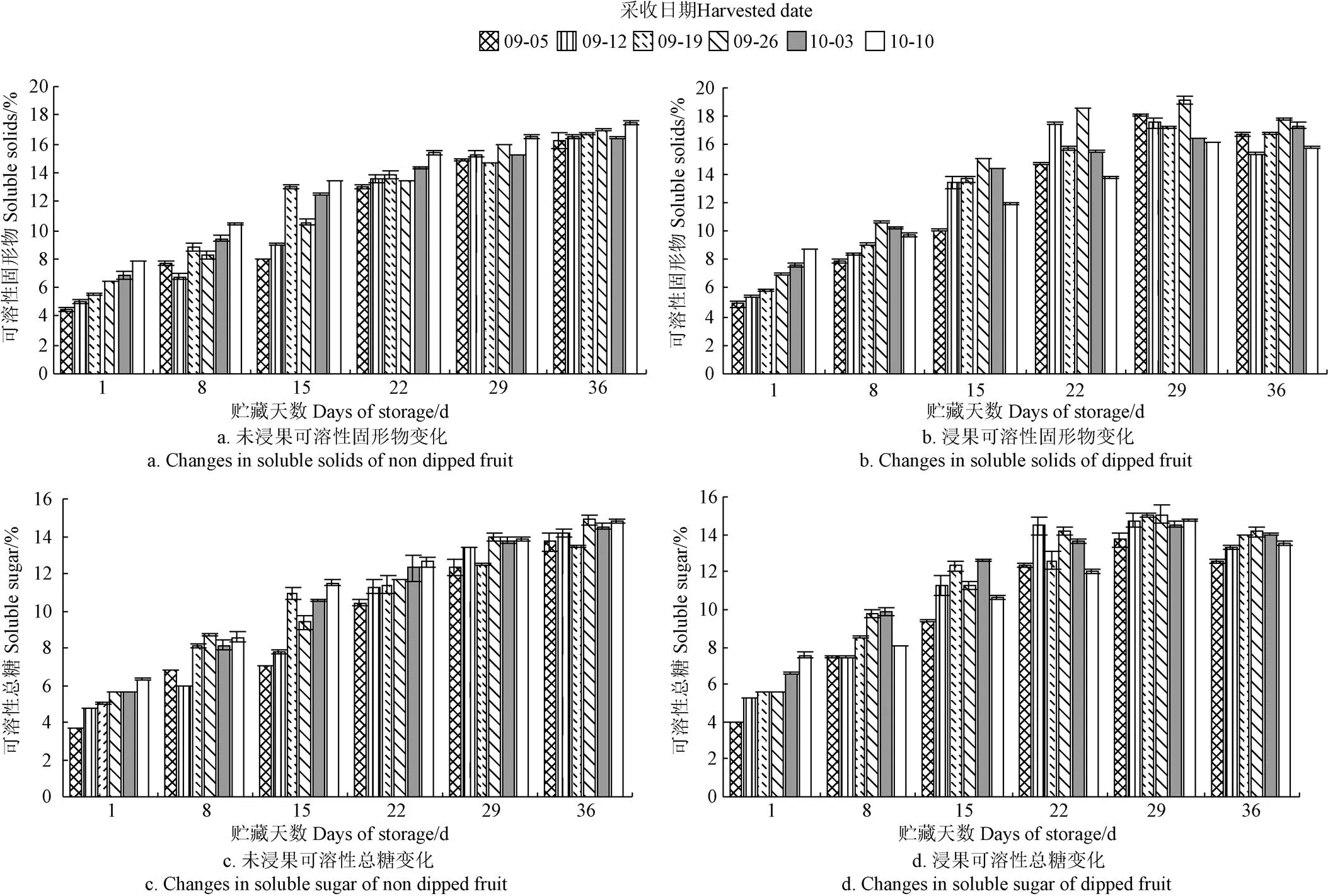
图9 不同采收期对‘贵长’猕猴桃在贮藏期1~36 d内果实可溶性固形物和可溶性总糖含量变化的影响

图10 不同采收期对‘贵长’猕猴桃在贮藏期1~36 d内果实可滴定酸和叶绿素含量变化的影响
图10表明,浸果处理可降低‘贵长’猕猴桃果实可滴定酸含量且加速了可滴定酸的损失速率,在贮藏29 d时到达最低,之后开始升高;这与浸果处理果实在贮藏29 d时到达糖高峰后开始下降相协调一致,且和果实在贮藏后期开始腐烂酸败密切相关,也间接解释了浸果处理降低了果实贮藏性的结果。早采或晚采果实可滴定酸含量降低速率较快,而采收期9月26日-10月3日在延缓可滴定酸含量降低中效果较其它时期好。由图10也可知,随着贮藏时间的延长,‘贵长’猕猴桃果实叶绿素含量逐渐降低;其中,浸果处理降低速率较未浸果快,其加快了果实的软化成熟,降低了果实的贮藏性。不同采收期对延缓果实叶绿素含量损失的差异不明显。
2.2.7 贮藏期果实总酚和黄酮含量变化规律
图11不同采收期对‘贵长’猕猴桃果实总酚和类黄酮含量变化的影响。类黄酮是植物重要的次生代谢产物,它们既能作为病原物的拮抗剂且本身具有抗病性,又能作为木质素合成的前体使宿主细胞木质化产生抗病作用。图11可得,浸果处理降低了果实总酚和黄酮含量,且加速了果实总酚和黄酮的损失速率,降低了果实的抗病性,间接解释了浸果处理果实腐烂率极显著地高于未浸果果实的现象。不同采收期间,早采果实总酚和黄酮含量较低;适宜的采收期为9月26日-10月3日,其果实总酚和黄酮含量处于较高水平,提高了果实抗病性,进而降低了果实的腐烂率。

图11 不同采收期对‘贵长’猕猴桃在贮藏期1~36 d内果实总酚和黄酮含量变化的影响
3 讨 论
通过对‘贵长’猕猴桃果实生长监测,可把其生长分为3个时期:快速生长期(谢花后9~23 d,谢花至6月16日)、缓慢生长期(谢花后23~100 d,6月16日-9月1日)、平缓生长期(谢花后100~128 d,9月1日-9月29日),这与金方伦等[9]报道相一致。而与‘红阳’[4,8]、‘秦美’[5]、‘金艳’[6,21]和软枣[7]等呈现的快速生长期、缓慢生长期和停滞生长期3个时期存在差异,‘贵长’猕猴桃在生长后期均有一定量的生长,这可能与品种和地域差异密切相关。氯吡脲浸果明显提高了‘贵长’猕猴桃果实的生长速率和生长量,这与朱杰丽等[15]报道的氯吡脲处理增加果实纵横径和单果质量相符,也董金磊等[16]报道的适宜浓度氯吡脲浸果可促使猕猴桃的纵横径在生长初期迅速增大和后期缓慢增大结论相一致。
氯吡脲浸果降低了生长期‘贵长’猕猴桃硬度,直接影响了果实的货架期和贮藏性能,这可能源于浸果处理加速了细胞分裂致使果实组织疏松导致,研究与董金磊等[16]报道相一致。且对‘贵长’猕猴桃果实发育监测表明,在生长期内果实干物质和可滴定酸含量变化呈先快速增加后缓慢增加,可溶性固形物、可溶性总糖、叶绿素和可溶性蛋白呈逐渐增加,总酚和黄酮呈波动增加,这与王琪凯等[6]报道的‘金艳’猕猴桃在生长期内果实可溶性固形物总体呈上升趋势和干物质呈快速-缓慢升高趋势相符。氯吡脲浸果可增加生长期和采收时果实干物质、可溶性固形物、可溶性总糖、叶绿素和可溶性蛋白含量,降低可滴定酸、总酚和黄酮含量,与前人研究报道[15-16,22-24]的适宜浓度氯吡脲处理可改善猕猴桃果实内在品质相符。
适宜采收期是保证猕猴桃果实良好的风味品质和贮藏性能的前提,采收过早果实无法表现固有品质且不耐贮,采收过晚成熟度高耐贮性差[25-28]。本试验结果表明,早采或晚采均加速‘贵长’猕猴桃果实的软化、质量损失和硬度降低,增加果实腐烂率,这与上述报道相符;且氯吡脲浸果同样加快了果实的软化速率、失重速率和硬度损失,极显著地提高了果实的腐烂率,这可能与氯吡脲浸果降低了果实抗性物质含量有关。猕猴桃成熟时较难从大小、形状和色泽等外观状态进行判断,前人采用了可溶性固形物和干物质含量作为采收监测指标。如吴彬彬等[25]认为‘金艳’猕猴桃在可溶性固形物含量达6.5%以上适宜采收,姚春潮等[27]认为‘徐香’猕猴桃在可溶性固形物含量达6.67%~8.00%、干物质20.00%以上适宜采收,汤佳乐等[28]指出‘徐香’猕猴桃的适宜采收指标为可溶性固形物含量达6.6%以上、干物质19%以上。本研究表明,‘贵长’猕猴桃较适宜的采收期为谢花后125~132 d,即干物质达16.5%~17.5%、可溶性固形物达6.5%~7.5%间采收。
本研究亦发现,适宜的采收期分别降低和提高了‘贵长’猕猴桃贮藏期内果实营养物质、抗病物质的损失速率和含量,提高果实抗病性,进而降低了腐烂率,增加了果实贮藏性。研究结果发现,氯吡脲浸果可提高‘贵长’猕猴桃果实干物质、可溶性固形物和可溶性总糖含量,降低可滴定酸、总酚和黄酮含量,且加速了糖高峰出现和可滴定酸的损失,降低了‘贵长’猕猴桃的贮藏性能,与朱杰丽等[15]和董金磊等[16]报道的适宜浓度氯吡脲处理可改善猕猴桃果实品质相符。而对于氯吡脲的安全性,柴振林等[13]指出氯吡脲在猕猴桃果实中降解快,平均半衰期为4.5 d,用药66 d后5~100 mg/L各浓度样品均未检出,得出成熟采摘时氯吡脲残留量远低于国家标准规定限量(0.05 mg/L)[29],一般不会产生质量安全风险的结论;本团队吴小毛等[30]研究了氯吡脲在‘贵长’猕猴桃中的残留,发现5~20 mg/L氯吡脲处理果实成熟采摘时均未检出,证明了10 mg/L氯吡脲浸果安全性较好,这为氯吡脲在‘贵长’猕猴桃在生产中使用提供了可行性。
4 结 论
本文通过对‘贵长’猕猴桃果实生长发育规律及贮藏性能的研究,得到了以下结论:
1)‘贵长’猕猴桃果实生长具有3个时期:快速生长期(谢花后9~23 d)、缓慢生长期(谢花后23~100 d)、平缓生长期(谢花后100~128 d)。10 mg/L氯吡脲浸果明显提高了‘贵长’猕猴桃果实的生长速率和生长量,对促进果实产量的形成具有良好作用,但降低了生长期果实的硬度。
2)‘贵长’猕猴桃果实在生长期内,干物质和可滴定酸含量变化呈先快速增加后缓慢增加,可溶性固形物、可溶性总糖、叶绿素和可溶性蛋白含量变化呈逐渐增加,总酚和黄酮含量变化呈波动增加。
3)10 mg/L氯吡脲浸果可提高‘贵长’猕猴桃果实干物质、可溶性固形物、可溶性总糖、叶绿素和可溶性蛋白含量,降低可滴定酸、总酚和黄酮含量,但加速贮藏期糖高峰出现和可滴定酸损失,降低了‘贵长’猕猴桃的贮藏性能。
4)早采或晚采以及10 mg/L氯吡脲浸果均可加速‘贵长’猕猴桃果实的软化、硬度降低、质量和营养物质的损失,增加果实腐烂率。‘贵长’猕猴桃较适宜的采收期为谢花后125~132 d,即干物质达16.5%~17.5%、可溶性固形物达6.5%~7.5%间采收。
[1] 龙友华,张承,吴小毛,等. 10个猕猴桃品种在贵州主产区的引种表现[J]. 贵州农业科学,2015,43(7):5-8.
Long Youhua, Zhang Cheng, Wu Xiaomao, et al. Introduction performance of ten kiwifruit varieties in the major production area of Guizhou [J]. Guizhou Agricultural Sciences, 2015, 43(7): 5-8. (in Chinese with English abstract)
[2] 龙友华,张承,龚芬,等. 叶面施硒对猕猴桃含硒量、镉铅积累及品质的影响[J]. 食品科学,2016,37(11):74-78.
Long Youhua, Zhang Cheng, Gong Fen, et al. Effects of foliar application of selenium fertilizer on selenium content, accumulation of cadmium and lead, and fruit quality of kiwifruit[J]. Food Science, 2016, 37(11): 74-78. (in Chinese with English abstract)
[3] 张承,李明,龙友华,等. 采前喷施壳聚糖复合膜对猕猴桃软腐病的防控及其保鲜作用[J]. 食品科学,2016,37(22):274-281.
Zhang Cheng, Li Ming, Long Youhua, et al. Control of soft rot in kiwifruit by pre-harvest application of chitosan composite coating and its effect on preserving and improving kiwifruit quality[J]. Food Science, 2016, 37(22): 274-281. (in Chinese with English abstract)
[4] 丁捷,刘书香,宋会会,等. 红阳猕猴桃果实生长发育规律[J]. 食品科学,2010,31(10):473-476.
Ding Jie, Liu Shuxiang, Song Huihui, et al. Growth and development patterns of hongyang Kiwi fruits[J]. Food Science, 2010, 31(10): 473-476. (in Chinese with English abstract)
[5] 杨朋燕,姚春潮,李小莹,等. “徐香”猕猴桃果实生长发育规律的研究[J]. 北方园艺,2014(18):47-50.
Yang Pengyan, Yao Chunchao, Li Xiaoyin, et al. Study on growth and development regularity of ‘Xu xing’ kiwi fruits[J]. Northern Horticulture, 2014 (18): 47-50. (in Chinese with English abstract)
[6] 王琪凯,杨丹,张晓琴,等. ‘金艳’猕猴桃果实生长动态规律和贮藏性能[J]. 食品科学,2016,37(9):129-133. Wang Qikai, Yang Dan, Zhang Xiaoqin, et al. Growth pattern and storage performance of ‘Jinyan’ kiwi fruits [J]. Food Science, 2016, 37(9): 129-133. (in Chinese with English abstract)
[7] 王博,朴一龙,王琳,等. 野生软枣猕猴桃果实生长发育过程中生理生化变化[J]. 延边大学农学学报,2011,33(1):6-9.
Wang Bo, Piao Yilong, Wang Lin, et al. Changes of physio-biochemistry during the growth and development in undomesticatedfruits[J]. Journal of Agricultural Science Yanbian University, 2011, 33(1): 6-9. (in Chinese with English abstract)
[8] 叶发荣,李秀亚,肖钧,等. 水城红阳猕猴桃果实生长发育规律[J]. 贵州农业科学,2017,45(11):89-92.
Ye Farong, Li Xiuya, Xiao Jun, et al. Growth and development regularity of Hong yang Kiwifruit in Shuicheng[J]. Guizhou Agricultural Sciences, 2017, 45(11): 89-92. (in Chinese with English abstract)
[9] 金方伦,韩成敏,黎明. 贵长猕猴桃果实生长发育规律研究[J]. 贵州农业科学,2010,38(5):180-183.
Jin Fanglun, Han Chenming, Li Ming. Fruit growth and development regulation of Guichang gooseberry[J]. Guizhou Agricultural Sciences, 2010, 38(5): 180-183. (in Chinese with English abstract)
[10] 张静,任俊鹏,杨庆文,等. CPPU 对夏黑葡萄果实生长的影响[J].中国南方果树,2013,42(2):22-25.
Zhang Jing, Ren Junpeng, Yang Qingwen, et al. Effect of CPPU on summer black grape fruit growth [J]. Fruit Trees in Southern China, 2013, 42(2): 22-25. (in Chinese with English abstract)
[11] Matsuo S, Kikuchi K, Fukuda M, et al. Roles and regulation of cytokine in tomato fruit development[J]. Experimental Botany, 2013, 63(15): 5569-5579.
[12] 张志恒,汤涛,徐浩,等. 果蔬中氯吡脲残留的膳食摄入风险评估[J]. 中国农业科学,2012,45(10):1982-1991.
Zhang Zhiheng, Tang Tao, Xu Hao, et al. Dietary intake risk assessment of forchlorfenuron residue in fruits and vegetables[J]. Scientia Agricultura Sinica, 2012, 45(10): 1982-1991. (in Chinese with English abstract)
[13] 柴振林,杨柳,朱杰丽,等. 氯吡脲在猕猴桃中的残留动态研究[J]. 果树学报,2013,30(6):1011-1015.
Chai Zhenlin, Yang Liu, Zhu Jieli, et al. Study on residue dynamics of forchlorfenuron in kiwifruit[J]. Journal of Fruit Science, 2013, 30(6): 1011-1015. (in Chinese with English abstract)
[14] 庞荣,任亚梅,袁春龙,等. 膨大剂处理对六种猕猴桃采收和软熟时品质的影响[J]. 现代食品科技,2017,33(8):235-241.
Pang Rong, Ren Yamei, Yuan Chunlong, et al. Effects of forchlorfenuron treatment on the quality of six varieties of kiwifruit during harvest and ripening periods[J]. Modern Food Science and Technology, 2017, 33(8): 235-241. (in Chinese with English abstract)
[15] 朱杰丽,杨柳,柴振林,等. 氯吡脲对“徐香”猕猴桃果实品质的影响[J]. 福建林业科技,2014,41(1):113-115,165.
Zhu Jieli, Yang Liu, Chai Zhenlin, et al. Effect of forchlorfenuron on xuxiangfruit quality[J]. Journal of Fujian Forestry Science and Technology, 2014, 41(1): 113-115, 165. (in Chinese with English abstract)
[16] 董金磊,郭文川. 不同质量浓度氯吡脲对猕猴桃果实理化参数的影响[J]. 西北农林科技大学学报:自然科学版,2015,43(10):145-151.
Dong Jinlei, Guo Wenchuan. Effects of forchlorfenuron concentration on physical and chemical properties of kiwifruits[J]. Journal of northwest A&F University: Natural Science Edition, 2015, 43(10): 145-151. (in Chinese with English abstract)
[17] 聂继云. 果品质量安全分析技术[M]. 北京:化学工业出版社,2009.
[18] 曹建康. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[19] 吴峰华,刘相真,杨虎清,等. 覆盆子醇提物及其不同极性部位抗氧化活性研究[J]. 中国食品学报,2012,12(2):24-29.
Wu Fenghua, Liu Xiangzhen, Yang Huqing, et al. Study on antioxidant activity of ethanol extract and Its different polarity fractions fromHu[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(2): 24-29. (in Chinese with English abstract)
[20] 李琨,张学杰,张德纯,等. 不同芹菜品种叶与叶柄黄酮含量及其与抗氧化能力的关系[J]. 园艺学报,2011,38(1):69-76.
Li Kun, Liu Xiangzhen, Zhang Dechun, et al. The quantitation of flavonoids in leaf and stalk of different celery cultivars and the correlation with antioxidation activity[J]. Acta Horticulturae Sinica, 2011, 38(1): 69-76. (in Chinese with English abstract)
[21] 钟彩虹,张鹏,韩飞,等. 猕猴桃种间杂交新品种‘金艳’的果实发育特征[J]. 果树学报,2015,32(6):1152-1160.
Zhong Caihong, Zhang Peng, Han Fei, et al. Studies on characterization of fruit development of interspecific hybrid cultivar —‘Jinyan’[J]. Journal of Fruit Science, 2015, 32(6): 1152-1160. (in Chinese with English abstract)
[22] 费学谦,方学智,丁明,等. 不同浓度CPPU处理对中华猕猴桃生长与营养品质的影响[J]. 农业环境科学学报,2005,24(增刊):30-33.
Fei Xueqian, Fang Xuezhi, Ding Ming, et al. Effect of different concentrations of CPPU on growth and nutritional quality of actinidia chiensis planch[J]. Journal of Agro-Environment Science, 2005, 24(Supp.): 30-33. (in Chinese with English abstract)
[23] Kim J G, Takami Y, Mizugami T, et al. CPPU application on size and quality of hardy kiwifruit[J]. Scientia Horticulturae, 2006, 110(2): 219-222.
[24] 张承,龙友华,吴小毛,等. 植物生长调节剂对猕猴桃产量及品质的影响[J]. 北方园艺,2014(21):31-34.
Zhang cheng, Long Youhua, Wu Xiaomao, et al. Effects of plant growth regulators on yield and quality of kiwifruit[J]. Northern Horticulture, 2014(21): 31-34. (in Chinese with English abstract)
[25] 吴彬彬,饶景萍,李百云,等. 采收期对猕猴桃果实品质及其耐贮性的影响[J]. 西北植物学报,2008,28(4):788-792.
Wu Binbin, Rao Jingping, Li Baiyun, et al. Effect of harvest date on fruit quality and storage duration of kiwifruit [J]. Acta Bot. Boreal.-Occident. Sin, 2008, 28(4): 788-792. (in Chinese with English abstract)
[26] 钱政江,刘亭,王慧,等. 采收期和贮藏温度对金艳猕猴桃品质的影响[J]. 热带亚热带植物学报,2011,19(2):127-134.
Qian Zhengjiang, Liu Ting, Wang Hui, et al. Effects of harvest stage and storage temperature on quality of ‘JinYan’ Kiwifruit (Actinidiachinensis×A.eriantha)[J]. Journal of Tropical and Subtropical Botany, 2011, 19(2): 127-134. (in Chinese with English abstract)
[27] 姚春潮,刘占德,龙周侠. 采收期对“徐香”猕猴桃果实品质的影响[J]. 北方园艺,2013(8):36-38.
Yao Chunchao, Liu Zhande, Long Zhouxia. Effect of harvest time on fruit quality of ‘Xuxiang’ kiwifruit[J]. Northern Horticulture, 2013(8): 36-38. (in Chinese with English abstract)
[28] 汤佳乐,黄春辉,冷建华,等. 不同采收期对金魁猕猴桃果实品质的影响[J]. 中国南方果树,2012,41(3):110-113.
[29] GB 2763-2012 食品安全国家标准食品中农药最大残留限量[S]. 北京:中国标准出版社, 2013.
[30] 吴小毛,王英,胡学昆,等. 猕猴桃中吡效隆和高效氯氟氰菊酯残留的高效液相色谱分析[J]. 贵州农业科学,2012,40(12):123-125.
Wu Xiaomao, Wang Ying, Hu Xuekun, et al. HPLC analysis of forchlorfenuron and lambda-cyhalothrin residue in Chinese gooseberry[J]. Guizhou Agricultural Sciences, 2012, 40(12): 123-125. (in Chinese with English abstract)
Determination of suitable harvest period of kiwifruit and its storage performance
Zhang Cheng1,2, Wang Qiuping3, Ran Fei1, Chen Peng1, Wu Xiaomao1, Long Youhua1※, Tang Jingwen4, Huang Yaxin4
(1.550025; 2.,212013,; 3.,551400,; 4.550200,)
This study aimed to investigate the growth and development pattern of ‘Guichang’ kiwi fruit and its suitable harvest period, the growth parameters (longitudinal diameter, transverse diameter, lateral diameter, single fruit volume and single fruit weight) and development parameters (firmness, dry matter, soluble solid, soluble total sugar, titratable acid, chlorophyll, soluble protein, total phenol and total flavonoids ) of ‘Guichang’ kiwi fruit from 9 - 128 d after the flower-fading, as well as the changes of fruit quality ( dry matter, soluble solid, soluble total sugar, titratable acid, chlorophyll, soluble protein, total phenol and total flavonoids ) and storage performance (firmness, soften rate, weight loss, decay rate ) during postharvest storage were surveyed by the treatment of non dipped and 10 mg/L forchlorfenuron dipped fruit. The results indicated that the fruit growth (longitudinal diameter, transverse diameter, lateral diameter, single fruit volume and single fruit weight) of ‘Guichang’ kiwifruit could be divided into three periods. Firstly, the faster increasing period that it was from 9 - 23 d after the flower-fading, and the duration period was 14 d. Secondly, the slow increasing period that it was from 23 - 100 d after the flower-fading, and the duration period was 77 d. Thirdly, the mild increasing period that it was from 100 - 128 d after the flower-fading, and the duration period was 28 d. During the growth period, the fruit firmness of ‘Guichang’ kiwi fruit increased at first and then slowly decreased, the content of dry matter and titratable acid of ‘Guichang’ kiwi fruit increased fast at first and then slowly increased, the content of soluble solid, soluble total sugar, chlorophyll and soluble protein of ‘Guichang’ kiwi fruit faster increased gradually, and the content of total phenol and total flavonoids of ‘Guichang’ kiwi fruit showed a fluctuating increase. The dipped fruit by 10 mg/L forchlorfenuron could effectively increase the growth rate and growth amount of ‘Guichang’ kiwifruit, and reduce the firmness of ‘Guichang’ kiwi fruit during the growth period. Moreover, 10 mg/L forchlorfenuron could increase the contents of dry matter and soluble protein of ‘Guichang’ kiwi fruit in the growth and storage period, and reduce the content of titratable acid, total phenols and flavonoids of ‘Guichang’ kiwi fruit, also increase the contents of soluble solids, soluble total sugar and chlorophyll of ‘Guichang’ kiwi fruit from 58 - 128 d after the flower-fading and storage period. However, 10 mg/L forchlorfenuron could accelerate the occurrence of the sugar peak and titratable acid loss, and reduce storage the performance. In addition, the fruit softening, firmness reducing, quality and nutrient substance loss of ‘Guichang’ kiwifruit could be accelerated at the early harvest, late harvest or dipped fruit of 10 mg/L forchlorfenuron, and significantly (<0.01) increased the fruit decay rate of ‘Guichang’ kiwifruit. The suitable harvest period for ‘Guichang’ kiwifruit was from 125-132 d after the flower-fading, when the dry matter and soluble solids content of ‘Guichang’ kiwifruit were 16.5%-17.5% and 6.5%-7.5%, respectively. Collectively, the results from this study provide a scientific basis for the high-quality cultivation, determination of the suitable harvest period of ‘Guichang’ kiwifruit.
kiwifruit; forchlorfenuron; growth; development; storage performance; harvest period
2018-05-14
2018-08-05
国家自然科学基金项目(21267007),贵州省科技厅农业攻关项目[黔科合NY字(2009)3022],贵州省科技支撑计划项目[黔科合支撑(2018)2358,(2017)2592,(2017)2571,(2017)2568],贵州省优秀青年科技人才基金[黔科合平台人才(2017)5616],贵阳市科技计划项目[筑科合同(2017)26-1],修文县猕猴桃产业发展项目[修猕合同(2017)01号,(2017)02号,(2017)03号]资助。
张 承, 博士生, 从事农产品质量安全及农业工程研究。Email:chengz76@aliyun.com;
龙友华,教授,博士,主要从事猕猴桃栽培育种、植物保护及农产品质量安全研究。Email:gzlyh126@126.com
10.11975/j.issn.1002-6819.2018.17.035
S663.4
A
1002-6819(2018)-17-0266-10
张 承,王秋萍,冉 飞,陈 鹏,吴小毛,龙友华,唐靖文,黄亚欣. 猕猴桃适宜采摘期确定及其贮藏性能[J]. 农业工程学报,2018,34(17):266-275. doi:10.11975/j.issn.1002-6819.2018.17.035 http://www.tcsae.org
Zhang Cheng, Wang Qiuping, Ran Fei, Chen Peng, Wu Xiaomao, Long Youhua, Tang Jingwen, Huang Yaxin. Determination of suitable harvest period of kiwifruit and its storage performance[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(17): 266-275. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.17.035 http://www.tcsae.org

