马铃薯脱毒种薯植物工厂繁育的营养液类型与浓度优化调控
徐志刚,王笑笑,陈 松,甘立军
马铃薯脱毒种薯植物工厂繁育的营养液类型与浓度优化调控
徐志刚1,王笑笑1,陈 松1,甘立军2
(1. 南京农业大学农学院,南京 210095; 2. 南京农业大学生命科学学院,南京 210095)
针对基于植物工厂繁育脱毒马铃薯原原种中营养液分段组合管理缺乏合理指导的问题,该文以马铃薯脱毒组培植株为试验材料,在LED植物工厂中,分别针对苗期、块茎形成与膨大期及成熟期设置了营养液不同类型和浓度组合管理的3个全生育期栽培试验,探究营养液分段组合管理对植株生长和结薯的影响。结果表明,霍格兰(H)营养液处理的苗期叶面积显著高于MX营养液(MX)和日本园试(J)营养液处理,H营养液对马铃薯脱毒植株的苗期生长更具优势;MX处理的单株薯数、单株有效薯数及结薯数大于3粒的植株比率分别为3.2粒、2.8粒和83.33%,均高于J和H营养液处理。在块茎形成与膨大期,0.8倍浓度的MX营养液(0.8MX)引起植株纤细徒长,1.2MX抑制株高伸长,1.0MX对植株形态发育有利。在成熟期,0.8MX+MX+0.6MX(B)组合处理的单株薯数、单株有效薯数、单株薯质量、单株有效薯质量及结薯数大于3粒的植株比率分别为4.0粒、3.5粒、23.66 g、23.18 g和100%,显著高于0.8MX+0.8MX+0.8MX (A)和0.8MX+1.2MX+0.6MX(C)组合。0.6MX处理马铃薯植株的株高、地上部干样质量、叶面积、种薯质量均高于0.7MX处理,表明成熟期0.6MX处理对种薯产量形成有利;H+MX+0.6MX(D)组合处理的单株薯质量和单株有效薯质量均为29.78 g,显著高于0.8MX+MX+0.6MX(E)和0.8MX+MX+0.7MX(F)组合。综合考虑植物工厂对营养液管理调控的便捷性、操作管理的可靠性和系统运行的稳定性要求,H+MX+0.6MX的营养液分段组合管理对LED植物工厂中脱毒马铃薯种薯的生产更具优势。
农作物;温室;叶绿素;马铃薯脱毒植株;植物工厂;营养液管理;生长;结薯
0 引 言
马铃薯(L.)单产水平是谷类作物的2~4倍,水分利用效率比谷类作物高7倍(http://cipotato.org/potato/facts)。中国小麦、玉米主产区正遭受水资源短缺困境,马铃薯作为主粮可持续增产的战略性作物,已被列为中国第四大主粮作物。传统留种方式致病毒在种薯中世代积累和传递,种性退化,减产达20%~50%[1]。脱毒种薯是确保马铃薯高产稳产和优质高效的基础。但当前脱毒种薯繁育制种生产的低能和低效,严重阻碍了中国马铃薯产业的发展[2]。繁种产能低导致供需缺口大,年需求量达14~18亿粒[3],供应能力不足6亿粒[3];而繁种低效则进一步推高成本和价格,已经成为抑制脱毒种薯使用率和推广率提升的重要原因[4]。
脱毒原原种是指用马铃薯脱毒组培苗在洁净或受控环境中栽培收获的小薯,是脱毒种薯繁育制种产业体系的关键。生理特性决定了脱毒种薯的繁育需要良好隔离环境[5],传统方法是利用高海拔冷凉地区或环境优良的自然封闭区域获得隔离环境,但该方法正面临如下刚性制约:首先,符合标准的繁种基地日益稀缺[6-7],严重制约马铃薯种业的发展[8];其次,连作障碍致种田报废,无法持续利用[9];第三,周年繁种受自然气候制约,产能低;第四,即使采用温网室做隔离栽培,仍不能有效规避虫媒、风媒等传播病虫害,种薯感染率高、量产风险大[10]。
基于营养液管理的植物工厂能有效避免连作障碍和土传病害,实现可持续的周年生产,具有封闭性与隔离性高、可控性与稳产性好、产能与产效高以及生产的周年性与计划性强等特点,匹配于马铃薯脱毒原原种繁育的需求特性。以植物工厂的营养液管理为核心,构建脱毒种薯工厂化生产的现代制种工业体系,是提升种薯产能和产效、降低成本、实现周年稳定的规模产出和增强供应能力的有效途径。营养液作用于植株根系养分环境,影响到植株的生长发育,是植物工厂中脱毒原原种生产的关键核心之一,而匹配于栽培方式的营养液配方和浓度运筹则是营养液管理的重点内容[11]。有研究试图通过改变成熟营养液配方中的氮、钾浓度以建立马铃薯无土栽培专用营养液配方[12],但由于改变成熟配方中的元素浓度会打破各元素之间既有的协调与和谐,对实际生产会有潜在风险[13],未见实际量产中获成功应用的报道。霍格兰(Hoagland Nutrition,H)、日本园试(Japanese Garden Test Nutrition,J)和MX(Mixed Nutrition,MX)营养液是成熟并广获应用的类型。H营养液有利于番茄幼苗的培育[14],1/4浓度的H营养液对甘薯苗顶端茎段的生根培养有利[15];J营养液能显著提高生菜的根系活力[16];H和J营养液均能增强芍药的长势[17],表明不同类型的成熟营养液对不同植株具有一定的普适性。但是H和J营养液是否对马铃薯脱毒植株生长和结薯产生差异性影响,尚未见比较研究。王季春等[18]采用MX营养液研究不同浓度管理对脱毒马铃薯植株雾培的影响,发现0.8MX最有利于生长和产量形成,并指出营养液管理不能仅关注氮磷钾配比的调节,还应考虑浓度调节。尹作全等[19]认为应针对马铃薯不同生育期(生根、营养生长和结薯)实施营养液优化管理,但未明确给出不同生育期的营养液类型组合和浓度组合参数。
对于植物工厂中的马铃薯脱毒植株栽培,营养液管理的重点是不同生育期的适宜营养液类型与浓度的分段组合管理,但相关试验还未见系统研究报道,无法为繁种生产提供有效指导。本研究基于H、J和MX这3种成熟的营养液类型,在植物工厂中开展不同配方类型的对比试验、各生育期不同浓度匹配的分段管理试验以及配方类型与浓度组合分段管理的试验,通过数据分析,探讨基于不同生育期需求的营养液分段管理对植物工厂中脱毒马铃薯原原种生长发育的影响,初步构建适宜于植物工厂脱毒马铃薯原原种培育的营养液管理方法,为生产应用和后续研究提供借鉴和参考。
1 材料与方法
1.1 供试材料与栽培管理
供试马铃薯品种为“转心乌”脱毒组培苗,由南京农业大学植物光生物学实验室的组培室培育供苗。脱毒组培苗经3 d开瓶适应后从组培瓶中取出、假植于蛭石中,经7 d驯化后,选取6~8 cm高的植株移栽至不同处理组,株间距10 cm,行间距12 cm,以蛭石为栽培基质,营养液定期浇灌。栽培环境温度设定为白天(22±1)℃,夜晚(16±1)℃;马铃薯专用LED植物灯提供光照,光密度可调并设定为300mol/(m2·s-1)、光照时间设定为11 h/d(08:30开灯,19:30关灯)。所有营养液的pH值均调制在5.5~6.5。植株管理:匍匐茎形成初期下移4~5节,后期及时摘除下部枯黄老叶,避免病菌的传播及病害的发生。
1.2 试验设计与方法
预试验于2016年4月—2016年9月在本实验室的LED植物工厂内实施,用于为主试验的营养液管理参数设置提供支持。试验采用营养液无土栽培,所有试验均安排在同一LED植物工厂内。主试验于2016年10月—2017年12月实施,主试验包括如下3个试验:
试验一:不同类型营养液管理的栽培试验(2016年10月—2017年2月)。采用霍格兰(H)、MX(M)和日本园试(J)营养液类型设置3组试验处理,每组3个重复,分析研究3种不同营养液类型对脱毒马铃薯植株生长和结薯的影响,为后续阶段试验的营养液管理参数设置提供支持。这3种营养液的主要元素浓度如表1所示。在整个生育期,均采用1.0倍的标准浓度浇灌。
试验二:基于不同生育期的营养液不同浓度组合管理栽培试验(2017年3月—2017年7月)。基于试验1的结果分析,选取适宜于结薯指标的营养液类型,分别针对苗期、块茎形成与膨大期、成熟期,设置3种浓度组合处理,实施3组试验处理,处理组代号分别设为A、B和C,每组3个重复,研究分析不同营养液浓度组合管理对马铃薯植株不同生育期生长和结薯的影响,为后续试验阶段的营养液管理参数设置提供支持。
试验三:基于不同生育期的营养液类型和浓度组合管理栽培试验(2017年8月—2017年12月)。基于试验1和试验2的结果分析,选取适宜于结薯和各生育期生长指标的营养液类型和浓度,分别针对3个生育期,实施3组试验处理,处理组代号分别设为D、 E和 F,每组3个重复,研究分析不同营养液类型与浓度组合管理对马铃薯植株不同生育期生长和结薯的影响。
1.3 测定项目及方法
1.3.1 植株生长势
试验一在定植后的第30、60和90 d分别进行采样,试验二在定植后的第45、60和90 d(由于前30 d 3个处理施用浓度相同,第30 d以后改变浓度处理,故取样改为45 d),试验三在定植30、60和90 d分别进行采样(上午10:00左右),分别测量其株高、茎粗、叶片数、叶面积、植株干样质量。
1.3.2 叶绿素含量
采用乙醇-丙酮混合提取法,将丙酮和无水乙醇以1:1的比例混合制成浸提液。称取剪碎叶片(倒4叶)0.1 g左右,放入试管中加入提取液并定容到10 mL,加塞置于暗处,于室温下进行浸提。待材料完全变白,利用分光光度计测定663、645及470 nm的吸光度。通过公式计算叶绿素的含量[20]。
1.3.3 产量统计
采收成熟的马铃薯种薯后,将马铃薯块茎按质量进行分级统计,记录各处理下结薯数及产量。采用SPSS软件做统计分析。
2 结果与分析
2.1 不同类型营养液管理对植株生长及结薯的影响
由表2可知,在单株薯质量及有效薯质量指标上,H处理显著高于M处理及J处理;在单株薯数和有效薯数指标上,H处理与J处理间无显著差异,均显著低于M处理。按有效结薯数对马铃薯植株做分级统计发现,结薯大于等于3粒的植株比例,M处理高达83.33%,远高于H处理的33.33%和J处理的16.67%。

表2 不同类型营养液对马铃薯脱毒种薯产量的影响Table 2 Effects of different nutrition formulas on yields of virus-free tuber
注:同列数据后不同小写字母表示差异显著(<0.05);质量≥1.5 g的原原种薯为有效薯,下同。
Note: Different small letters in the same column mean significant difference (<0.05); The tuber which mass is equal or great than 1.5 g is the effective tuber, same as below.
表2显示M处理能够收获数量多且个体均匀一致的种薯,H处理能够收获大薯、但数量较少且个体差异大,J处理的种薯收获量均低于M处理及H处理。以上分析表明,MX营养液更有利于提高脱毒马铃薯植株的结薯数量和个体质量均匀度水平。
较高的叶面积、叶绿素含量和株高有利于植株获得更多光能资源和更高光合速率。由表3可知,第60 d的株高、叶绿素总量和叶面积指标,M处理和H处理间无显著差异,均显著高于J处理,这表明对于处于块茎形成和膨大旺盛生育期的植株,MX和霍格兰营养液更有利于其光合生长和物质积累,为根部块茎的发育膨大提供了充裕的物质基础。对于整个生育期的地上部干样质量,3种营养液处理间无显著差异。在收获的第90 d,3种营养液处理间的株高和叶面积均无显著差异,但M处理的茎粗显著高于H处理及J处理。上述指标数据随生育进程的变化揭示出MX和霍格兰营养液有利于促进处于成熟期的植株将更多的光合产物转运到块茎中。叶片等地上部器官(“源”)中的物质需要经由茎(“流”)向根部的块茎(“库”),M处理的茎粗显著大于H处理和J处理,确保了“流”的顺畅高效,促使地上部物质更多地向块茎中转运,这正是MX营养液处理的种薯产量和均匀度高于霍格兰和日本园试营养液的重要原因,也是MX和霍格兰营养液处理的叶面积和株高在第60 d时显著高于日本园试营养液处理、而在第90 d时与日本园试营养液处理无显著差异的原因。H处理的第30 d叶面积显著高于M处理,表明在移栽后的0~30 d内,霍格兰营养液对马铃薯脱毒组培植株的早期生长较有优势;后期的生长指标表明霍格兰及日本园试营养液对种薯发育膨大和产量形成不具优势。
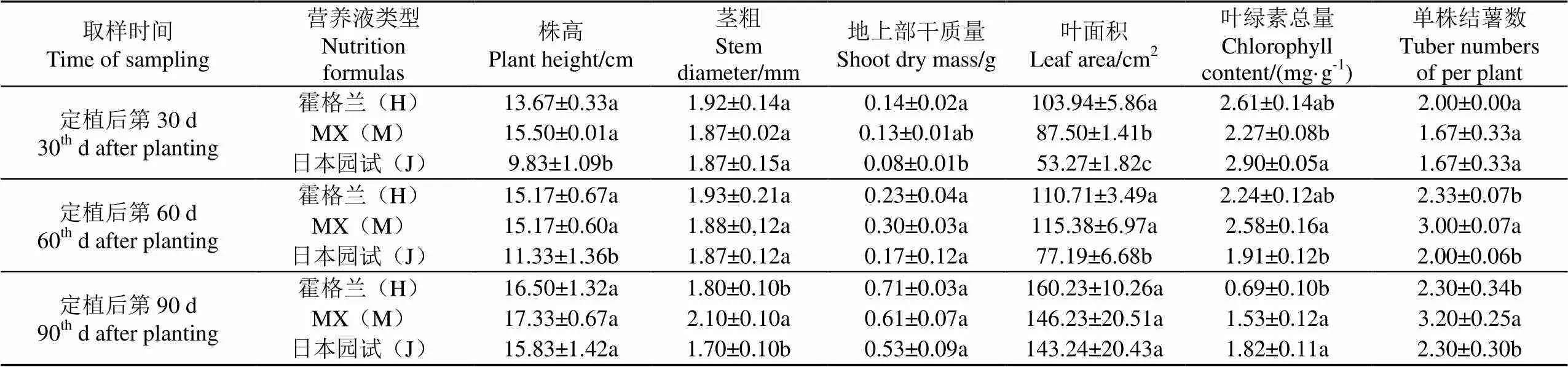
表3 不同类型营养液对马铃薯生长发育的影响
2.2 营养液不同浓度组合管理对植株生长及结薯的影响
按有效结薯数对马铃薯植株做分级统计发现,在平均单株薯数、有效薯数及平均单株薯质量、有效薯质量指标和结薯大于等于3粒的植株比例,B处理高于A、C处理(表4)。以上分析表明,B处理的浓度组合更有利于提高有效种薯的收获数量和质量。
从第30~60 d,采用不同浓度的MX营养液管理。在第45 d时(处理后的第15 d),不同浓度组合处理的指标效应未有差异显现(表5)。在第60 d时,A处理的株高显著高于B、C处理,C处理的茎粗显著高于A、B处理,但地上部干样质量、叶面积、叶绿素总量等指标均无显著差异,这表明在块茎形成和膨大的旺盛生育期内,低浓度(0.8MX)营养液不能满足植株生育对营养的需求,引起植株纤细徒长(表5),导致种薯的数量与质量最低(表4);但高浓度(1.2MX)营养液抑制了株高伸长(表5),这可能是高浓度对植株根系造成了胁迫,导致种薯的数量与质量降低;B处理(1.0MX)是适宜的浓度,植株形态发育适中,有利于种薯的数量与质量的形成(表4)。从第60~90 d,采用2种浓度的MX营养液浇灌,结果显示在第90 d时,0.6MX浓度处理的茎粗、地上部干样质量和叶面积显著高于0.8MX浓度处理(表5),种薯产量显著高于0.8MX浓度处理(表4),表明在成熟期采用0.6MX的浓度是适宜的。
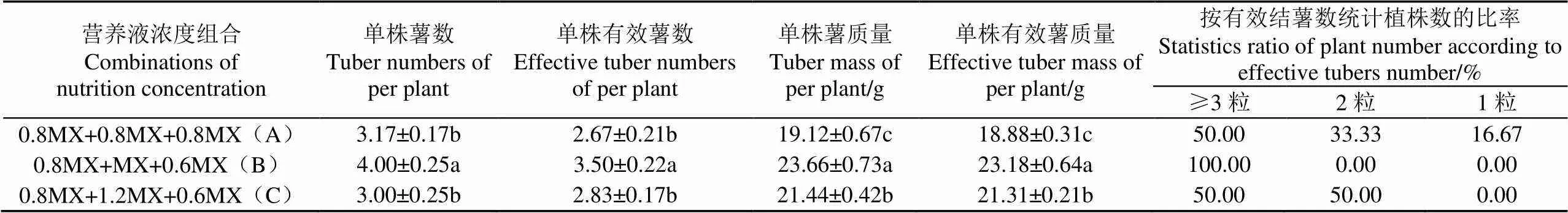
表4 营养液不同浓度组合对马铃薯脱毒种薯产量的影响
表5 营养液不同浓度组合对马铃薯生长发育的影响
Table 5 Effects of different combinations of nutrition concentration on potato growth and development
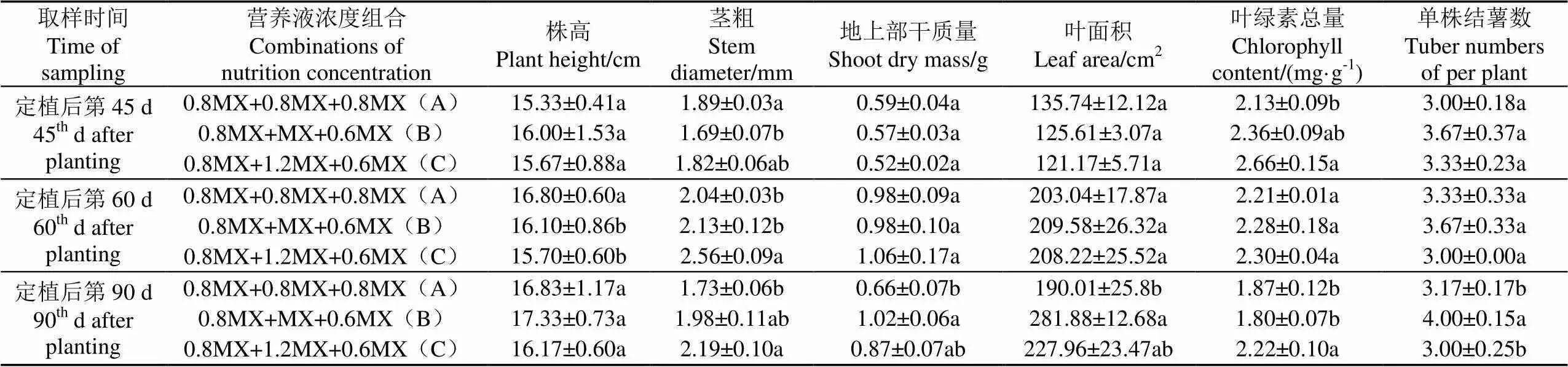
表5 营养液不同浓度组合对马铃薯生长发育的影响
取样时间Time of sampling营养液浓度组合Combinations ofnutrition concentration株高Plant height/cm茎粗Stem diameter/mm地上部干质量Shoot dry mass/g叶面积Leaf area/cm2叶绿素总量Chlorophyll content/(mg·g-1)单株结薯数Tuber numbersof per plant 定植后第45 d45th d after planting0.8MX+0.8MX+0.8MX(A)15.33±0.41a1.89±0.03a0.59±0.04a135.74±12.12a2.13±0.09b3.00±0.18a 0.8MX+MX+0.6MX(B)16.00±1.53a1.69±0.07b0.57±0.03a125.61 ±3.07a2.36±0.09ab3.67±0.37a 0.8MX+1.2MX+0.6MX(C)15.67±0.88a1.82±0.06ab0.52±0.02a121.17±5.71a2.66±0.15a3.33±0.23a 定植后第60 d60th d after planting0.8MX+0.8MX+0.8MX(A)16.80±0.60a2.04±0.03b0.98±0.09a203.04±17.87a2.21±0.01a3.33±0.33a 0.8MX+MX+0.6MX(B)16.10±0.86b2.13±0.12b0.98±0.10a209.58±26.32a2.28±0.18a3.67±0.33a 0.8MX+1.2MX+0.6MX(C)15.70± 0.60b2.56±0.09a1.06±0.17a208.22±25.52a2.30±0.04a3.00±0 .00a 定植后第90 d90th d after planting0.8MX+0.8MX+0.8MX(A)16.83± 1.17a1.73±0.06b0.66±0.07b190.01±25.8b1.87±0.12b3.17±0.17b 0.8MX+MX+0.6MX(B)17.33± 0.73a1.98±0.11ab1.02±0.06a281.88±12.68a1.80±0.07b4.00±0.15a 0.8MX+1.2MX+0.6MX(C)16.17± 0.60a2.19±0.10a0.87±0.07ab227.96±23.47ab2.22±0.10a3.00±0.25b
2.3 营养液不同类型和浓度组合管理对植株生长及结薯的影响
在平均单株薯质量、有效薯质量指标上,D处理显著高于E、F处理,在其余指标上,3个处理间均无显著差异(表6);在种薯数量相同的情况下,D处理能够收获大薯。
在0~60 d,E、F处理组的营养液浓度管理相同,但从第60~90 d,低浓度(0.6MX)处理的地上部干样质量显著高于较高浓度(0.7MX)处理,且单株薯质量、有效薯质量以及其他指标无显著差异(表6、表7)。表明在成熟期采用0.6MX更有利于植株总生物量的积累,进一步验证了试验二的结果。
在移栽后的0~30 d,D处理的株高、叶面积显著高于E、F处理(表7),表明霍格兰营养液有利于马铃薯脱毒组培植株的早期生长,这进一步验证了试验一的结果。从第60~90 d,D处理与E处理的营养液浓度相同,但D处理的第60 d 地上部干样质量显著高于E、F处理,第90 d的地上部干样质量、叶面积和株高(表7)显著大于E、F处理,这表明在块茎形成与膨大期和成熟期,即使更换了营养液类型和浓度,前期霍格兰营养液处理所建立的植株优势,对中、后期的生长发育产生了持续的有利效应,导致收获更高的种薯质量。
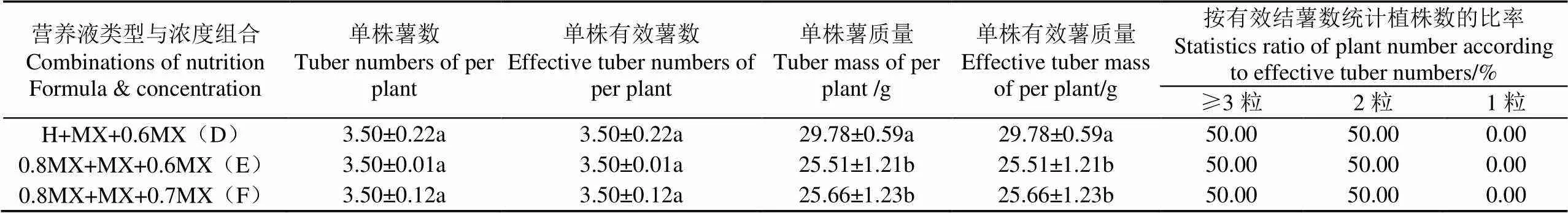
表6 营养液不同类型和浓度组合对马铃薯脱毒种薯产量的影响
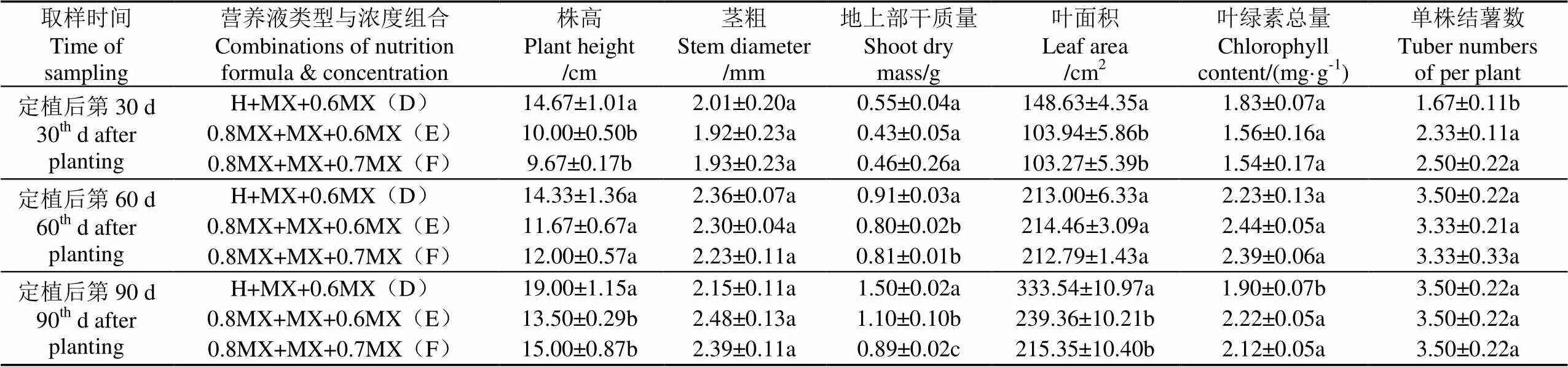
表7 营养液不同类型和浓度组合对马铃薯生长发育的影响
3 讨 论
马铃薯植株对氮素供应的反应取决于生长阶段,其生长前期对氮素需求较低[21]。研究表明,高水平氮素趋向于延长生长期,并通过减少同化物分配来延迟块茎形成[22-23]和块茎生长[21],低浓度氮素能促进块茎早熟和前期植株的生长,本研究结果与之一致。霍格兰营养液(H)的氮素含量(210.3 mg/L)低于MX营养液(280.2 mg/L)、0.8MX营养液(224.2 mg/L)和日本园试通用(J)营养液(243.9 mg/L),在0~30 d的苗期,霍格兰营养液处理的叶面积(表3、表7)和株高(表7)显著高于MX营养液处理。Park等[24]认为叶绿体参与钙的吸收,钙对提高叶绿体的活性具有重要的作用。辛建华[25]发现较高钙水平处理有利于维持马铃薯叶片较高的叶绿素含量,从而对维持叶片较高的光合速率有益。本研究也有相同结果,霍格兰营养液的Ca2+浓度(160.2 mg/L)高于MX营养液(111.9 mg/L)和0.8MX营养液(89.52 mg/L)。表明低氮及高钙含量的营养液有利于马铃薯脱毒组培植株的苗期生长,为后期生长发育及大薯形成提供了物质基础。王季春等[18]发现0.8MX营养液最有利于植株的生长发育和产量的形成,株高显著高于MX处理,有利于前期的营养生长,株高增长较快。结合前人研究成果,认为在0~30 d的苗期选择0.8MX营养液或霍格兰营养液管理方案均可,但霍格兰营养液更具优势。
有研究表明较高磷含量能提高植株叶片的叶绿素含量和同化物积累[26],较高钾含量能增加产量[27]。钾可以促进马铃薯的营养生长,提高生物产量,从而提高经济产量[28-30]。Cao等[31]研究表明NO3--N和NH4+-N混合使用,所导致的产量比单独使用任何一种形态氮的产量都高。Mitsuru等[32]研究结果表明N03-可以刺激马铃薯匍匐茎分枝,促进主茎生长,NH4+可以促进块茎膨大。本研究结果进一步验证了上述结论,MX营养液的磷、钾含量和NH4NO3含量高于霍格兰营养液和日本园试通用营养液,更有利于马铃薯植株的光合生长、物质积累、块茎发育和最终产量的形成(表2、表3)。本研究发现,在块茎形成和膨大的旺盛生育期内(30~60 d),低浓度(0.8MX)营养液不能满足植株生育对营养的需求,引起植株纤细徒长(表5),导致种薯的数量与质量最低(表4);但高浓度(1.2MX)营养液抑制了株高伸长(表5),可能是高浓度对植株根系造成了渗透胁迫和离子毒性,导致种薯的数量与质量较低(表4)。Sawas等[13]的研究发现,营养液中的大量营养物质会导致渗透胁迫和离子毒性,过高的离子浓度不利于块茎形成,产生很多无效匍匐茎;过低离子浓度处理养分亏缺,匍匐茎和块茎数量少,块茎膨大缓慢,影响微型薯产量[33]。过高的氮水平促进植物内源GA合成,使ABA/GA比值降低,促进匍匐茎大量发生,不利于块茎的形成[34],打破马铃薯“库”和“源”的平衡,引起枝叶的繁茂生长,而作为“库”的块茎分配获得的同化物少,因而延缓块茎的形成和膨大[35]。综合已有知识和本研究结果,我们认为在块茎形成和膨大期,采用标准浓度(1.0倍)的MX营养液是适宜的管理方案,利于植株正常的形态发育和种薯的数量与质量的形成。
“返幼性”导致移栽后的组培苗长势及种薯数量和质量弱于实生苗,采用温网室隔离栽培的实际生产,其单株有效种薯的平均产量大致在2粒/株左右。在LED植物工厂中,MX营养液处理的单株种薯收获量大于3粒/株、有效种薯收获量平均达2.8粒/株,高于温网室中的平均产量水平,并显著高于霍格兰及日本园试营养液处理(表2)。我们的研究结果表明,在成熟期的60~90 d内,采用MX营养液提高了植株茎粗(表3)和种薯产量(表2),这可能是由于MX营养液中较高的磷和钾含量促进了茎的增大和“流”的顺畅,同时较高的NH4NO3含量,促进了块茎的形成[31],进而共同作用于种薯的发育膨大,形成最高的种薯产量。个别处理出现后期茎粗低于前期茎粗的现象(表3、表5、表7),这是由于后期植株逐渐成熟萎蔫导致的。本研究发现,在成熟期施用0.6MX低浓度营养液并没有抑制植株生长(表5、表7),也没有降低种薯产量(表6),采用0.7MX和0.8MX营养液并没有收获比0.6MX营养液更高的种薯产量(表4、表6),这可能由于成熟期的植株处于生物量从“源”到“库”的转移过程期,对外界营养液浓度的需求降低。Gregory Cal认为,对于无土栽培的马铃薯,在结薯期减少营养元素,特别是氮素供应,可加快光合同化物向块茎转移,并提高氮利用率[36]。
较大的叶面积更利于光合产物的合成、较高的地上部干样质量为物质的转运提供了充足的“源”,0.8MX + MX + 0.6MX和H +MX +0.6MX这两种营养液管理策略,从生育进程的生长指标和产量指标上均印证了这一原理。这可以从2个方面解释:首先,叶面积大表明叶片光合能力(“源”)强,从而提升对植株自身和块茎(“库”)发育的物质供给能力,即“源”足则“库”强;其次,地上部干样质量和块茎质量(“库”)会反作用于植株叶片的光合能力(“源”),大“库”容会对“源”产生强势拉力,促进“源”、“流”和“库”器官的发育,提增“源”和“流”的能力,从而增强马铃薯的结薯能力[37],所以适宜的营养液管理策略有利于协调优化马铃薯植株“源-流-库”关系,从而形成较高的种薯产量。
4 结 论
本文以马铃薯脱毒组培植株为试验材料,在LED植物工厂中,分别针对苗期、块茎形成与膨大期及成熟期设置了营养液不同类型和浓度组合管理的3个全生育期栽培试验,来探究营养液分段组合管理对植株生长和结薯的影响。试验一为:全生育期内,霍格兰(H)、MX(M)和日本园试(J)3种不同营养液类型对脱毒马铃薯植株生长和结薯的影响;试验二基于试验一的最佳营养液类型,设置了不同生育期的营养液不同浓度组合管理栽培试验,3种浓度组合处理分别为0.8MX+0.8MX+0.8MX(A)、0.8MX+MX+0.6MX(B)、0.8MX+1.2MX+0.6MX(C);试验三基于试验一和试验二进一步设置不同生育期的营养液类型和浓度组合管理栽培试验,3组试验处理分别为H+MX+0.6MX(D)、0.8MX+MX+0.6MX(E)、0.8MX+MX+0.7MX(F);并得到如下结论:
1)H营养液更有利于苗期(0~30 d)马铃薯脱毒组培植株生长,所建立的植株优势对中、后期的生长发育能够产生持续的有利效应,收获更高的种薯质量。MX处理的单株薯数、单株有效薯数及结薯数大于3粒的植株比率分别为3.2粒、2.8粒和83.33%,均高于J和H营养液处理;
2)1.0倍浓度的MX营养液是适宜的浓度,植株形态发育适中,有利于块茎形成和膨大期(30~60 d)种薯的数量与质量的形成。在成熟期(60~90 d)采用0.6倍浓度的MX营养液管理能够收获更高数量和质量的种薯;
3)在苗期采用1.0倍浓度的H营养液、块茎膨大与成熟期采用1.0倍浓度的MX营养液、成熟期采用0.6倍浓度的MX营养液,即采用营养液D管理,能够收获最高数量、质量和均匀度的种薯。采用营养液E管理,能够收获相同数量的有效种薯。综合考虑植物工厂对营养液管理调控的便捷性、操作管理的可靠性和系统运行的稳定性要求,营养液D管理策略对LED植物工厂中脱毒马铃薯种薯的生产更具优势。
[1] 王肖云. 马铃薯组织培养及试管薯诱导体系优化[D]. 重庆:重庆大学,2008.
Wang Xiaoyun. The Optimization of Tissue Culture and Microtuber Induction of Potato[D]. Chong qing: Chongqing University, 2008. (in Chinese with English abstract)
[2] 闫东升. 马铃薯脱毒种薯行业发展前景分析[D]. 呼和浩特:内蒙古大学,2012
Yan Dongsheng. Prospects Analysis on Potato Virus-free Seed[D]. Hohhot: Mongolian University, 2012. (in Chinese with English abstract)
[3] 魏固宁,任俊林. 腐殖酸尿素在宁夏南部山区马铃薯上的施用效果[J]. 宁夏农林科技,2017,58(1):27-28.
Wei Guning, Ren Junlin. Study on effects of humic acid-urea on potatoes in mountainous area of southern Ningxia[J]. Ningxia Agriculture and Forestry Science and Technology, 2017, 58(1): 27-28. (in Chinese with English abstract)
[4] 史可显,刘治华,顾生芳. 靖远县脱毒马铃薯种薯扩繁与推广工作存在的问题及建议[J]. 甘肃农业,2014,22(1):20-24.
Shi Kexian, Liu Zhihua, Gu Shengfang. Problems and suggestions on the expansion and popularization of virus- free potato seed in Jing Yuan County[J]. Gansu Agriculture, 2014, 22(1): 20-24. (in Chinese with English abstract)
[5] 冯浪,李恩宏,施文娟. 贵州马铃薯脱毒种薯质量管理现状、存在的问题及对策初探[J]. 耕作与栽培,2015(增刊1):49-51.
Feng Lang, Li Enhong, Shi Wenjuan. The Preliminary discussion of present situation, existing problems and countermeasures of virus-free potato quality management in Guizhou[J]. Tillage and Cultivation, 2015(Supp.1): 49-51. (in Chinese with English abstract)
[6] 李文刚. 中国马铃薯脱毒种薯繁育及其产业化发展的问题与对策研究[A]. 中国马铃薯学术研讨文集,1996.
Li Wengang. Study on the problems and countermeasures of potato detoxification seed potato breeding and its industrialization in China[A]. Chinese Potato Symposium. 1996. (in Chinese with English abstract)
[7] 张舒婷. 内蒙古武川县马铃薯产业发展现状及对策[D]. 呼和浩特:内蒙古大学,2016.
Zhang Shuting. Present Situation Countermeasures of Inner Mongolian Wu Chuan County Potato Industry Development[D]. Hohhot: Mongolian University, 2016. (in Chinese with English abstract)
[8] 刘卫平. 黑龙江省马铃薯脱毒种薯繁育发展现状与对策研究[D]. 北京:中国农业科学院,2013.
Liu Weiping. Study on Development Present Status and Countermeasure of Virus Free Seed Potato in Heilongjiang Province[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in Chinese with English abstract)
[9] 项鹏宇,刘星,苗春乐,等. 鄂尔多斯市蔬菜产业存在问题与发展对策[J]. 北方园艺,2014(13):193-195.
Xiang Pengyu, Liu Xing, Miao Chunle, et al. The status and development countermeasures of the vegetable industry in Ordos city[J]. Northern Horticulture, 2014(13): 193-195. (in Chinese with English abstract)
[10] 颜谦,颜艳,黄萍,等. 贵州马铃薯脱毒种薯繁育中存在的问题及对策[J]. 贵州农业科学,2012,40(12):10-12.
Yan Qian, Yan Yan, Huang Ping, et al. Existing problems and countermeasures of virus-free seed potato propagation in Guizhou[J]. Guizhou Agricultural Sciences, 2012, 40(12): 10-12. (in Chinese with English abstract)
[11] Calori A H, Factor T L, Feltran J C, et.al. Electrical conductivity of the nutrient solution and plant density in aeroponic production of seed potato under tropical conditions (winter/spring)[J]. Journal Citation Reports, 2017, 76(1): 23-32.
[12] 于品华,戴朝曦,曲秀兰. 无土生产马铃薯微型种薯营养液的筛选研究[J]. 甘肃农业大学学报,1994,30(4):356-358.
Yu Pinhua, Dai Chaoxi, Qu Xiulan. A study on the selection of nutrient solution for the production of virus-free potato minitubers in soilless cultivation[J]. Gansu NongYe DaXue Xue Bao, 1994, 30(4): 356-358. (in Chinese with English abstract)
[13] Sawas D, Adamidis K. Automated management of nutrient solutions based on target electrical conductivity, pH, and nutrient concentration ratios[J]. Journal of Plant Nutrition, 1999, 26(2): 1415-1432.
[14] 吕炯璋,桑鹏图,李灵芝,等. 不同营养液配方与浓度对番茄幼苗生长的影响[J]. 山西农业大学学报:自然科学版,2010,30(2):112-116.
Lü Jiongzhang, Sang Pengtu, Li Lingzhi, et.al. Effect of nutrient solution with different formulas and concentrations on the growth of tomato seed-ling[J]. Journal of Shanxi Agricultural University: Nature Science Edition, 2010, 30(2): 112-116. (in Chinese with English abstract)
[15] 李育军,陈新亮,陈景益,等. 甘薯室内培养对低盐浓度的反应初探[J]. 广东农业科学,2011(增刊1):91-93.
Li Yujun, Chen Xinliang, Chen Jingyi, et.al Preliminary study on the response of sweet potato to indoor culture in low salt concentration[J]. Guangdong Agricultural Sciences, 2011(Supp.1): 91-93. (in Chinese with English abstract)
[16] 丁文雅,邬小撑,刘敏娜,等. 不同营养液配方对雾培生菜生物量和营养品质的影响[J]. 浙江大学学报:农业与生命科学版,2012,38(2):175-184.
Ding Wenya, Wu Xiaocheng, Liu Minna, et.al. Effects of different hydroponic nutrient solutions on biomass production and nutritional quality of aeroponically grown lettuce[J]. Journal of Zhejiang University: Agric, & Lifc Sci., 2012, 38(2): 175-184. (in Chinese with English abstract)
[17] 李婷婷. 不同无土栽培营养液对栽培芍药生长发育的影响[A]. 中国园艺学会观赏园艺专业委员会,2009:7.
Li Tingting. Effect of Different in Nuitritonal Soluiton of Soilless Culture on Cultivated Peony[A]. China Horticultural Society Ornamental Horticulture Professional Committee, 2009: 7. (in Chinese with English abstract)
[18] 王季春,唐道彬,吕长文,等. 营养与株型调控对雾培马铃薯的结薯生理影响[J]. 中国生态农业学报,2007,15(3):104-107.
Wang Jichun, Tang Daobin, Lv Changwen, et al. Media formula and plant control effects on aeroponics potato tuberization physiology[J]. Chinese Journal of Eco-Agriculture, 2007, 15(3): 104-107. (in Chinese with English abstract)
[19] 尹作全,沈德茹,于洪涛,等. 马铃薯脱毒小薯无基质喷雾栽培技术研究初报[J]. 马铃薯杂志,1999,13(1):23-24.
Yin Zuoquan, Shen Deru, Yu Hongtao, et al. Preliminary report on cultivation technique of potato virus - free potato without matrix spraying[J]. Potato magazine, 1999, 13(1): 23-24. (in Chinese with English abstract)
[20] 邹琦. 植物生理生化实验指导[M]. 北京:中国农业出版社,1995.
[21] Geary B, Clark J, Hopkins B G, et al. Deficient, adequate and excess nitrogen levels established in hydroponics for biotic and abiotic stress-interaction studies in potato[J]. Journal of Plant Nutrition, 2015, 38(1): 41-50.
[22] Kleinkopf G E, Westermann D T, Dwelle R B. Dry matter production and nitrogen utilization by six potato cultivar[J]. Agronomy Journal, 1981, 73: 799-802.
[23] Roberts S, Weaver W H, Phelps J P. Effect of rate and time of fertilization on nitrogen and yield of Russet Burbank potatoes under center pivot irrigation[J]. American Potato Journal, 1982, 59(2): 77-86.
[24] Park S Nobel, Lester Packer. Energy-dependent ion uptake in spinach chloroplasts[J]. Biochimica Et Biophysica Acta, 1964, 88(2): 453-455.
[25] 辛建华. 钙素对马铃薯生长发育、光合作用及物质代谢影响的研究[D]. 沈阳:沈阳农业大学,2008.
Xin Jianhua. Effect of Calcium on Growth, Development, Photosynthesis, and Material Metabolism of Potato[D]. Shenyang: Shenyang Agricultural University, 2008. (in Chinese with English abstract)
[26] 杨俊兴,张彤,吴冬秀. 磷素营养对植物抗旱性的影响[J]. 广东微量元素科学,2003,10(12):13-19.
Yang Junxing, Zhang Tong, Wu Dongxiu. Study on effect of phosphorus nutrition on drought resistance of plants[J]. Guang Dong Microscale Science, 2003, 10(12): 13-19. (in Chinese with English abstract)
[27] 陈魁卿,程岩,林桂范,等. 氮钾肥对大豆根瘤固氮、营养器官分化和产量效应的研究[J]. 大豆科学,1985,4(2):141-150.
Chen Kuiqing, Cheng Yan, Lin Guifan, et al. The response of nitrogenous and potassium fertilizers on nitrogen fixation of nodules, differentiation of vegetative organs and yield of soybean[J]. Soybean Science, 1985, 4(2): 141-150. (in Chinese with English abstract)
[28] Gopal J L, Miaocha H, Dhaliwal S. Microtuberization of Potato (.) Cultivar Kuroda[J]. Plant Cell Report, 1998, 17: 794-798.
[29] Wheeler R M, Mackowiak C L, Sager J C, et al. Potato growth and yield using nutrient film technique[J]. American Potato Journal, 1990, 67(3): 177-187.
[30] Rolot J L, Seutin H. Soilless production of potato minitubers using a hydroponic technique[R]. Conference on Potato Tissue Culture, 1999, 42(3/4): 457-469.
[31] Cao Weixing, Tibbitts T. Responses of potatoes to solution pH levels with different forms of nitrogen[J]. Journal of Plant Nutrition, 1994, 17(1): 109-126.
[32] Mitsuru Osaki, Jun Shirai , Takuro Shinano, et al. Effects of ammonium and nitrate assimilation on the growth and tuber swelling of potato plants[J]. Soil Science and Plant Nutrition, 1995, 41(4): 709-719.
[33] Ojala J C, Stark J C, Kleinkopf G E. Influence of irrigation and nitrogen management on potato yield and quality[J]. American Potato Journal, 1990, 67(1): 29-43.
[34] Sharma S, Chanemougasoundharam A , Sarkar D, et al. Carboxylic acids affect induction, development and quality of potato (.) micro-tubers grown in vitro from single-node explants[J]. Plant Growth Regulation, 2004, 44: 219-229.
[35] Jackson S D. Multiple signaling pathways control tuber induction in potato[J]. Plant Physiology. 1999, 119(1): 1-8.
[36] Goins G D, Yorio N C, Wheeler R M. Influence of nutrition management on biomass partitioning and nitrogen use efficiency indices in hydroponically grown potato[J]. Journal of the American Society for Horticultural Science, 2004, 129(1): 134-140.
[37] 何庆学. 雾化栽培马铃薯源流库关系及提高其结薯能力的研究[D]. 重庆:西南农业大学,2003.
He Qingxue. Study on the Relationship Between Attenuation of Potato Production and Flowering in Potato by Atomization Cultivation[D]. Chongqing: Southwest Agricultural University, 2003. (in Chinese with English abstract)
Optimal regulation of nutrient solution formula and concentrations for virus-free seed potato breeding in plant factory
Xu Zhigang1, Wang Xiaoxiao1, Chen Song1, Gan Lijun2
(1.210095,; 2.210095,)
Virus-free seed potato is the basis for potato production in field. Nutrient solution cultivation technology for virus-free seed potato can maximize the potential of seed multiplication and avoid bacterial infection. It is now deficient in the systematic research on the management of the nutrient solution for the virus-free potato cultivation in the LED (light emitting diode) plant factory, and the effective guidance for the whole growth duration of potato has not been put forward. This research tried to investigate the influence of nutrient solution management on the whole growth and tuberization of virus-free potato plantlets. The virus-free plantlets were acclimatized for 7 d, and then the plantlets with the height of 6-8 cm were transplanted into vermiculite. The light intensity was set at 300mol/(m2·s-1) and the daytime and night temperature were (22±1) ℃ and (16±1) ℃ respectively. Three different tests were performed, and in the first test 3 different formulas of nutrient solution were set up: Hoagland nutrition solution (H), mixed nutrition solution (MX) and Japanese garden test nutrition solution (J). In the second test, for 3 stages i.e. seedling stage, tuber formation and expansion period and mature stage, different combinations of nutrition solution concentration were set up: 0.8MX+0.8MX+0.8MX (A), 0.8MX+MX+0.6MX (B) and 0.8MX+1.2MX+0.6MX (C). In the third test, different combinations of nutrition formula and concentrationwere set up: H+MX+0.6MX (D), 0.8MX+MX+0.6MX (E) and 0.8MX+MX+0.7MX (F). Different nutrient solutions were watered at seedling stage, tuber formation and swelling stage, and mature stage.The results showed that the leaf area of H treatment were significantly higher than MX treatment at seedling stage, indicating that Hoagland nutrient solution had more advantages on the early growth of potato plants. Tuber number per plant, effective tuber number per plant and the ratio of plants whose effective tuber number was more than 3 treated by MX were 3.2, 2.8 and 83.33%, respectively, which were significantly higher than J and H treatment. At tuber formation and swelling stage, 0.8MX caused the plant to grow thinly and 1.2MX inhibited the plant height elongation, and the 1.0MX treatment was beneficial to plant morphological development. At mature stage, tuber number, effective tuber number, tuber mass, effective tuber mass per plant and the ratio of plants whose effective tuber number was more than 3 under the B treatment were 4.0, 3.5, 23.66 g, 23.18 g and 100% respectively, which were significantly higher than A and C. The plant height, shoot dry mass, leaf area and tuber mass of the 0.6MX treatment were higher than the 0.7MX, indicating that the 0.6MX was conducive to the formation of the yield. Tuber mass, and effective tuber mass per plant under the D treatment were both 29.78 g, which were significantly higher than E and F. Taking into account the convenience of management and control in nutrition solution in the plant factory, the reliability in management and the stability of system, the management of H+MX+0.6MX nutrition solution for the production of virus-free potato tubers has more advantages in LED plant factory.
crops; greenhouse; chlorophyll; potato virus-free plants; plant factory; nutrient solution management; growth; tuberization
2018-02-28
2018-07-30
国家重点研发计划(2017YFB0403903)
徐志刚,教授,博士生导师,主要从事植物工厂系统技术、植物光生物学研究。Email:xuzhigang@njau.edu.cn
10.11975/j.issn.1002-6819.2018.17.026
S311
A
1002-6819(2018)-17-0199-08
徐志刚,王笑笑,陈 松,甘立军. 马铃薯脱毒种薯植物工厂繁育的营养液类型与浓度优化调控[J]. 农业工程学报,2018,34(17):199-206. doi:10.11975/j.issn.1002-6819.2018.17.026 http://www.tcsae.org
Xu Zhigang, Wang Xiaoxiao, Chen Song, Gan Lijun. Optimal regulation of nutrient solution formula and concentrations for virus-free seed potato breeding in plant factory[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(17): 199-206. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.17.026 http://www.tcsae.org

