基于叶片SPAD估算不同水氮处理下温室番茄氮营养指数
石小虎,蔡焕杰
基于叶片SPAD估算不同水氮处理下温室番茄氮营养指数
石小虎1,2,蔡焕杰2※
(1.太原理工大学水利科学与工程学院,太原 030024; 2. 西北农林科技大学中国旱区节水农业研究院,杨凌 712100)
为了探讨临界氮稀释曲线模型在西北地区温室番茄不同水分处理下的适用性以及采用SPAD仪快速准确诊断氮营养状况,该研究以“丽娜”番茄为材料,2013-2015年在陕西省杨凌区温室内进行水分和氮素处理试验,水分处理设置4个水平,分别为全生育期充分灌水处理、仅苗期亏水50%、苗期开花期连续亏水50%和全生育期亏水50%;氮素处理设置3个水平,施氮量分别为0、150和300 kg/hm2,通过2013-2015年试验数据对临界氮浓度稀释曲线模型进行率定和验证,并将该模型参数与番茄全生育期平均日耗水量建立相关关系,提高了临界氮浓度稀释模型在不同水分条件下的适用性。结果表明通过番茄全生育期平均日耗水量和临界氮浓度稀释曲线模型估算得到的临界氮浓度估算值和实际计算值有较好的一致性,其绝对误差为0.13~0.34 g/(100 g),标准误差为0.14~0.39 g/(100 g),决定系数为0.94~0.99,因此采用该方法可以对西北地区温室番茄不同水分处理下临界氮浓度稀释进行准确估算。通过2013-2015年试验数据分析番茄不同叶位叶片SPAD值和氮营养指数(nitrogen nutrition index,NNI)之间相关性,结果表明番茄中位叶片SPAD值与氮营养指数(NNI)有良好的线性相关性(决定系数为0.77~0.98),且该相关系数值与番茄日耗水量呈极显著相关关系,因此通过番茄日耗水量可以估算出NNI与中位叶片SPAD值之间的线性关系,估算出NNI=1时的中位叶片SPAD值,并以此SPAD值进行氮营养诊断。该研究可为西北地区温室番茄实时氮营养诊断和优化氮素管理提供了较好的理论参考。
叶绿素;水分;温室;番茄;水分处理;临界氮浓度;氮营养指数
0 引 言
温室蔬菜栽培在中国西北地区种植规模发展迅速,番茄作为温室蔬菜的主要品种,生育期短,在反季节蔬菜中占有很大比例。传统的肥大水勤仍然是当地主要的水肥管理方式,氮肥过量施用的现象比较普遍,过量施氮不仅能使蔬菜产量降低,还能导致土壤硝态氮积累,引发土壤次生盐渍化[1-2]。临界氮浓度是一定的生长时期内获得最大生物量时的最小氮浓度值[3]。因此明确番茄干物质形成过程中不同生育阶段的临界氮浓度是科学诊断植株氮营养状况,是实现番茄各生育阶段氮肥合理施用的基础。为了准确地计算出作物不同生育期阶段的临界氮浓度,Greenwood等[4]在1990年提出了关于C3、C4作物临界氮浓度与地上部生物量关系的通用模型,后经Lemaire和Gastal等[5]大量试验,修正了其中的参数[6]和参数[7],提出了关于C3、C4作物的新模型,由于模型是基于多个试验平均得到的结果,且供试作物不能代表所有作物。近些年国内外学者对不同作物进行临界氮浓度稀释模型的研究,主要集中在棉花[8]、小麦[9-10]、番茄[11-13]、高粱[14]、玉米[15-16]等作物,研究均表明临界氮浓度稀释曲线模型可较好的描述地上部生物量与氮浓度的关系,但由于试验地、供试作物及试验处理等因素不同,导致了氮浓度稀释模型参数和也有较大的差异,因此需要根据实际情况对模型参数进行校正。根据临界氮浓度稀释曲线,Lemaire[17]等定义了氮素营养指数(nitrogen nutrition index,NNI),即地上部实测氮浓度和临界氮浓度的比值。当NNI=1时,表明作物体内氮素营养合适,NNI>1表明氮营养过剩,NNI<1表明氮营养不足。强生才等[16]研究表明在不同降雨年型下,所构建的夏玉米临界氮稀释曲线模型有所不同,降雨量不同导致了模型参数的不同。杨慧等[12]在不同水分条件下构建了温室盆栽番茄临界氮稀释曲线模型,并表现出不同灌水量处理氮浓度稀释模型参数不同。因此不同水分处理下临界氮稀释曲线模型参数有较大的差别,需要根据实际的种植和处理情况进行氮素营养诊断。
氮素营养指数(NNI)诊断法作为传统氮素诊断技术,这种方法判定准确、可信度高,但是需要的样本量较大、并且需要破坏植物样本,且操作复杂、费时、不能实时实地得出结果,限制了这种方法在实际操作中的推广应用[18],而利用现代仪器氮素诊断技术则可以快速、便捷和非破坏性的进行作物氮素诊断,如图像及计算机视觉诊断、高光谱遥感诊断和SPAD仪诊断等。视觉技术是通过对人的视觉进行计算机计算模拟,通过图片采集工具对作物冠层叶片的图像绿光值来判断植株的氮营养情况[19],但是存在携带不方便,不能进行实时实地的跟踪观察测定等缺陷;高光遥感技术是某一光谱区域对光谱进行详细划分,进一步得到更多波段的光谱信息,与多波段遥感相比,高光谱遥感光谱分辨率较高,Maderia研究表明水稻叶片中的叶绿素含量高低与光谱特征之间两者存在相关性,可以通过光谱检测植株的氮营养状况[20],但该方法存在数据获得需经过反复的转换,影响因素较多,仪器昂贵等缺陷;叶绿素计(SPAD计)是一种便携式光谱仪,具有携带方便、可实时实地进行观察测定等优点,它是以叶绿素对对红光和近红外光的差异吸收,根据透过叶片的透射光特征来表达叶片的叶绿素相对含量,进而可以根据叶片叶绿素含量与叶片氮含量的关系来推算植物的氮营养状况[21],Errecart等[22]也通过建立叶片SPAD值与植株NNI值之间的相关性,利用叶片SPAD值来快速模拟作物NNI值,Yang等[23]比较水稻不同叶位的SPAD值和NNI之间的回归关系,表明该拟合关系在年际间表现稳定,推测利用SPAD值可判断NNI值,用于水稻的氮素营养诊断。本研究为了提高临界氮浓度稀释曲线模型在西北地区温室番茄不同水分处理的适用性以及确定适当叶位叶片SPAD值估算出番茄NNI值进行氮素营养诊断。因此本研究通过2013-2015年2 a不同水分处理处理下3个氮素处理的温室番茄试验,率定和验证了临界氮稀释曲线模型在西北地区温室番茄不同水分状况的适用性,筛选出适宜的测定叶位以及根据叶片SPAD值确定氮营养指数,旨在为不同水分条件下番茄氮素合理利用、氮营养状况的诊断及氮素优化管理提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2013-2015年在陕西省杨凌区温室内进行(34°18′N、108°4′E,海拔521 m)。试验温室为非加热型自然通风温室,主体为钢架结构,用塑料薄膜覆盖,南北走向(长×宽×高,50 m×6.5 m×4.6 m),温室顶部和底部各设 1 m 宽通风口,并配置手动启闭装置,当温室内温度>35 ℃或<10 ℃时,通过开启或关闭通风口来调节温室内温度。温室内部番茄为南北方向种植。该地温室0~60 cm土壤内,黏粒(<2m)为22%,粉粒(2~20m)为56%,砂粒(≥20~2 000m)为22%,有机质质量分数为3.44%,容重为1.41 g/cm3,饱和含水率θ为0.41 cm3/cm3,田间持水量θ为0.34 cm3/cm3,凋萎含水量θ为 0.14 cm3/cm3。
1.2 试验设计
本研究设计2个因素:水分和氮素。4个灌水水平:全生育期充分灌水处理(W1)、仅苗期亏水50%(W2)、苗期开花期连续亏水50%(W3)、全生育期亏水50%(W4);3个施氮水平,分别为无氮(N0:0)、中氮(N150:150 kg/hm2)和高氮(N300:300 kg/hm2),水分和氮素进行完全组合,如表1所示。各试验处理进行3次重复共36个小区,各小区面积为6.5 m×2.4 m=15.6 m2,完全随机布置,小区之间用埋深60 cm的塑料薄膜隔离,试验小区布置如图1所示。
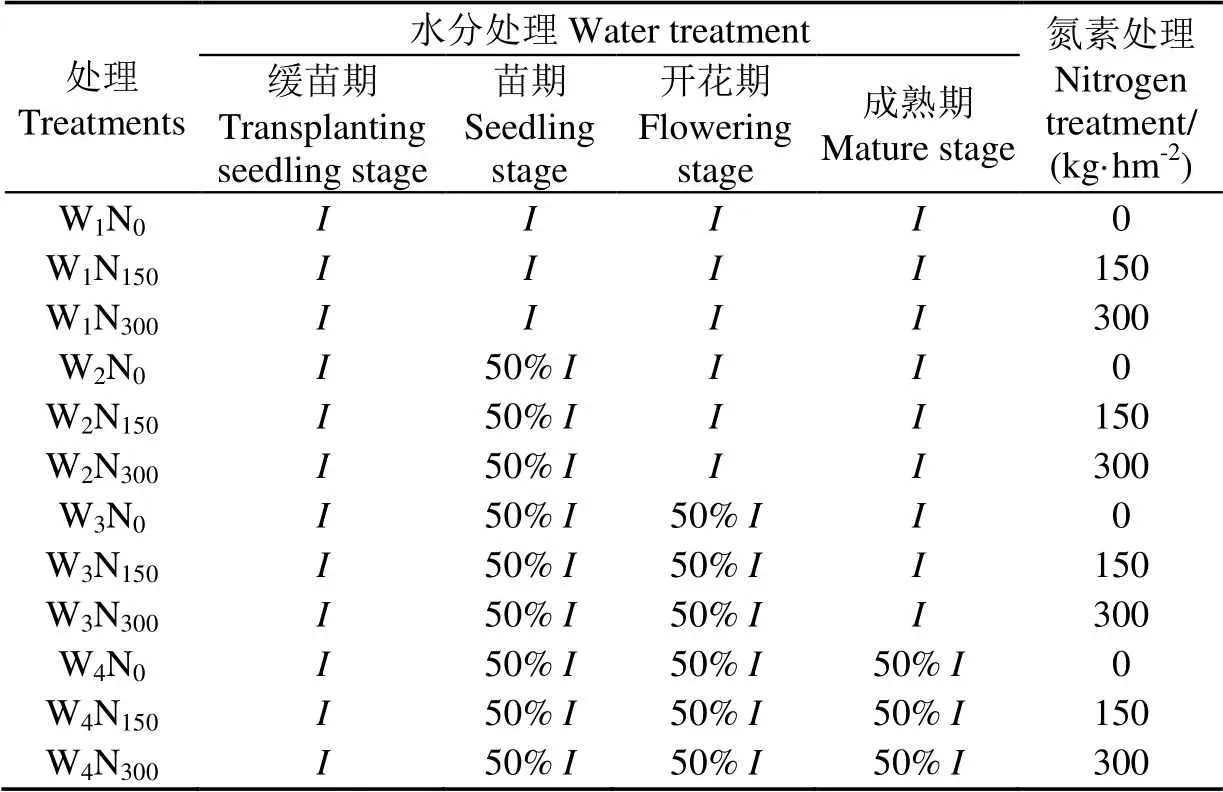
表1 试验设计
注:W1~W4分别为全生育期充分灌水处理、仅苗期亏水50%处理、苗期开花期连续亏水50%处理和全部亏水50%处理;N0、N150和N300为施氮量为0、150和300 kg·hm-2处理;为灌水量,mm。
Note: W1-W4are full irrigation treatment, deficit of 50% only in seedling stage, deficit of 50% both in seedling stage and flowering stage, deficit of 50% in the whole growth stage; N0, N150and N300are no nitrogen application, nitrogen application rate of 150 kg·hm-2and nitrogen application rate of 300 kg·hm-2, respectively;is irrigation amount, mm.
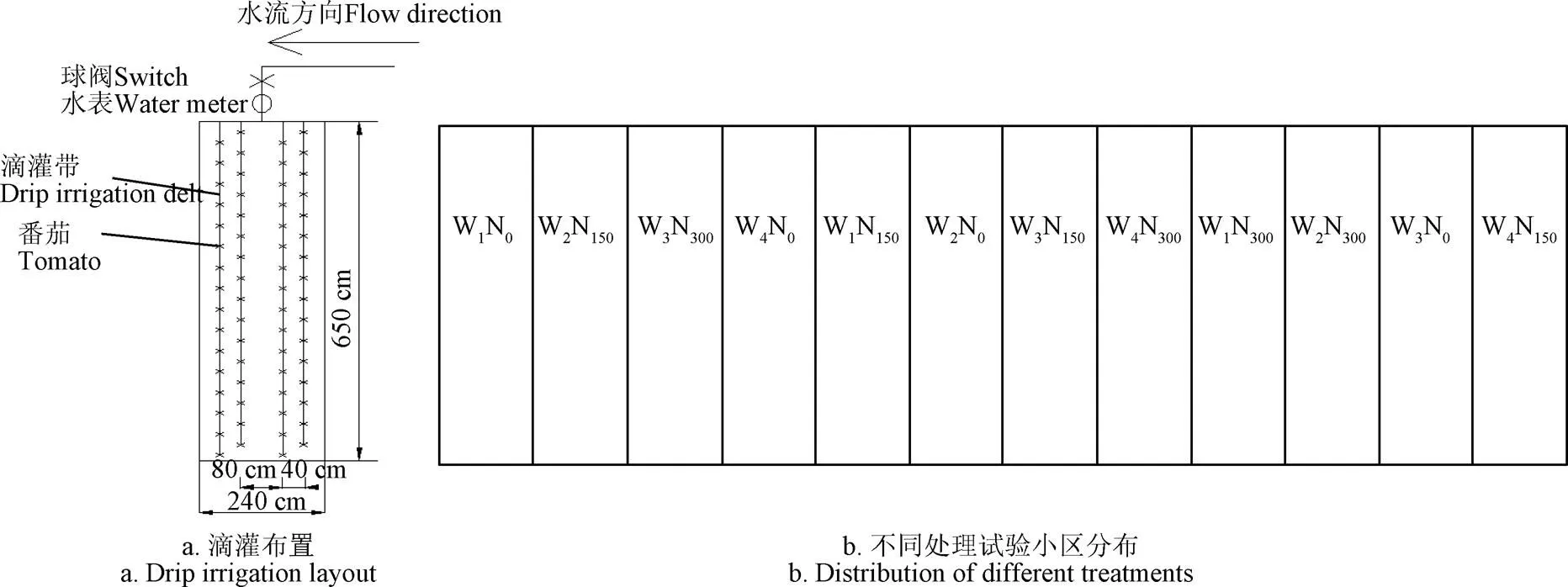
图1 温室番茄试验小区处理布置
本研究采用膜下滴灌灌溉方式,灌水从定植后15d开始,各水分处理灌水周期为7 d左右,设置充分灌溉处理(W1)灌水上限为田间持水率的90%[24]。石小虎[25]研究表明番茄根系在0~60 cm土层内分布,因此本研究设置计划湿润层深度为60 cm。根据王峰等[24]研究,计算出充分灌水处理(W1)各生育期灌水量,其他水分处理仅在灌水量上进行减少,灌水时间和次数均与W1处理相同;根据石小虎[25]研究将高氮水平(N300)定为300 Kg/hm2(以N计),N0和N150处理只在施氮量上进行减少。氮肥选用尿素(含氮质量分数 46%),定植之前基施 40%,剩余60%分别在定植后(days after transferring,DAT)70、90和110 d溶化到水中随滴灌平均施入。
试验用品种为番茄“丽娜”,番茄生育期划分为缓苗期(2013-08-10-08-31、2014-08-15-09-08),苗期(2013-09-01-10-05、2014-09-09-10-12),开花期(2013-10-06-12-05、2014-10-13-12-12)和成熟期(2013-12-06-2014-01-10、2014-12-13-2015-01-21)。种植方式为当地典型的起垄覆膜栽培模式,垄高20 cm、垄宽80 cm,番茄幼苗按单穴单株定植在垄的两侧,其宽行距为80 cm,跨沟窄行距为40 cm,株距为40 cm,种植密度为4.2株/m2。定植前在温室内均匀施入等量的磷肥200 kg/hm2(以P计)和钾肥300 kg/hm2(以K计)。定植时灌定植水20 mm,定植后14 d内不灌水,以利于蹲苗,待番茄幼苗成活后再进行试验处理。定植当天沿温室南北走向铺设宽1.2 m,厚0.005 mm地膜,番茄开花后用细绳将番茄悬吊在温室上方的铁丝上,并每3 d人工授粉1次,同时进行喷药等农作管理。全生育期内,每株番茄留3穗果后摘心,每穗留4~5个番茄。番茄成熟后每2 d进行采摘1次,其他农作管理按当地常规进行。
1.3 观测项目与方法
1)土壤含水率
将Trime系列土壤水分测量仪(IMKO Corp., Germany)埋设在距离植株 20 cm 位置处,分别测定各小区宽行、窄行和株间的土壤含水率,灌水前后各测1次,从表层到 60 cm 深每隔15 cm测量1次,计算时取其平均值。
2)充分灌水处理灌水量
灌水从定植后15 d开始,充分灌水处理灌水上限为田间持水量(FC)的90%,其灌水量(mm)为
=10(0.9FC−i)Z(1)
式中θ为灌水前的土壤含水量,cm3/cm3;Z为计划湿润层深度,cm,本文取60 cm。
3)番茄日耗水量
由于温室内地势平坦,没有地表径流;当地地下水埋设较深,地下水对番茄的补给可以忽略;温室可以阻隔降雨的进入,因此降雨量可以忽略;根据温室内自制的渗透仪可以得到60 cm土层处没有深层渗漏。因此水量平衡公式可简化为
ET=(I+Δ)/(2)
式中ET为天内平均日耗水量,mm/d;I为天内的灌水量,mm;Δ为天内土壤含水量的变化量,mm。
4)番茄地上部生物量
定苗后每隔20 d左右进行破坏性取样,每次均取3株。每次取样称量番茄地上部茎、叶、果鲜质量,在105 ℃下烘15 min杀青,72 ℃下烘至恒质量,计算其生物量。
5)植株各器官含氮量测定
将各处理的干物质分器官粉碎后过筛,用H2SO4-H2O2消煮法和凯氏定氮仪(FOSS 2300 型)测定各器官全氮含量,并计算植株全氮含量。各器官氮累积量(kg/hm2)=器官含氮量(%)×器官生物量(kg/hm2),所有器官氮累积量相加得到地上部植株氮累积量。植株含氮量(%)=植株氮累积量(kg/hm2)/植株生物量(kg/hm2)。
6)叶片SPAD值
各处理取整齐一致的3株植株,分别对不同节位叶片(由下向上依次为5、6、7、8、9、10、11、12节位)SPAD值采用SPAD-502仪测定,将第5、6和7节位所测数据平均后作为下位叶SPAD值,第8、9和10节位所测数据平均后作为中位叶SPAD值,第11和12节位所测数据平均后作为上位叶SPAD值。
1.4 模型描述
1.4.1 临界氮稀释曲线模型
根据 Justes等[26]1994年提出的临界氮浓度的定义及计算方法,综合薛晓萍[27]、梁效贵等[28]、王新等[11]和杨慧等[12]关于棉花、夏玉米和番茄临界氮浓度稀释曲线模型的建模思路。本文临界氮浓度稀释曲线模型的构建方法如下:
1)对比分析不同氮水平下每次取样地上部生物量及相对应的氮浓度值,通过方差分析对作物生长受氮素营养限制与否的氮素水平进行分类;2)对于施氮量不能满足作物生长需求的试验资料,其地上部生物量与氮浓度值间的关系以线性曲线拟合;3)对于作物生长不受氮素影响的施氮水平,其地上部生物量的平均值用以代表生物量的最大值;4)每次取样日的理论临界氮浓度由上述线性曲线与以最大生物量为横坐标的垂线的交点的纵坐标决定。
依据Lemaire和Salette等[29]提出的临界氮浓度与地上部生物量关系的方程式,临界氮浓度稀释曲线模型为:
N=·DW-b(3)
式中N为临界氮浓度值,g/(100 g);参数为作物地上部生物量为103kg/hm2时植株的临界氮浓度;DW为作物地上部生物量的最大值,103kg/hm2;为决定临界氮浓度稀释曲线斜率的统计学参数。
1.4.2 氮营养指数
为了进一步明确作物的氮素营养状况,Lemaire等[29]提出了氮营养指数(nitrogen nutrition index,NNI)的概念,可用式(4)来表示。
NNI=N/N(4)
式中NNI为氮营养指数;N为地上部生物量氮浓度的实测值,g/(100 g)。
1.5 数据分析
采用 Microsoft Excel 2007和DPS软件对试验数据进行整理和分析,使用 Origin Pro 8.5软件作图。为了评价模型的精度,根据文献[30-32]计算模型模拟值和计算值之间的决定系数(2)、绝对误差指标(mean absolute error,MAE)和标准误差(root mean square error,RMSE)。
2 结果与分析
2.1 番茄地上部生物量与氮浓度值分析
不同水分和氮肥处理下番茄地上部生物量和植株氮素含量随定植后天数变化过程如表2所示。由表2可以得知,番茄地上部生物量随时间的推进呈逐渐增大的趋势,而番茄植株氮素含量随时间推进呈逐渐减小的趋势,在番茄拉秧时(DAT=150 d)番茄地上部干物质量达到最大值,为7.38×103~11.12×103kg/hm2,而植株氮素含量达到最小值,为1.43~1.96 g/(100 g)。充分灌水(W1)时,番茄地上部生物量和植株氮素含量均随施氮量的增加呈显著增加的趋势;与充分灌水处理相比,仅苗期亏水(W2)时不会显著影响拉秧时番茄地上部生物量和植株氮素含量,随着亏水天数的增加,番茄地上部生物量和植株氮素含量减少量逐渐增加,全生育期亏水(W4)时,地上部生物量和植株氮素含量减少到最低。表明充分灌水时,增加施氮量有显著的增加地上部干物质和植株氮素含量的效应,而非充分灌水时,施氮量增加到一定量(150 kg/hm2)继续增加施氮量时不会显著增加番茄地上部生物量。
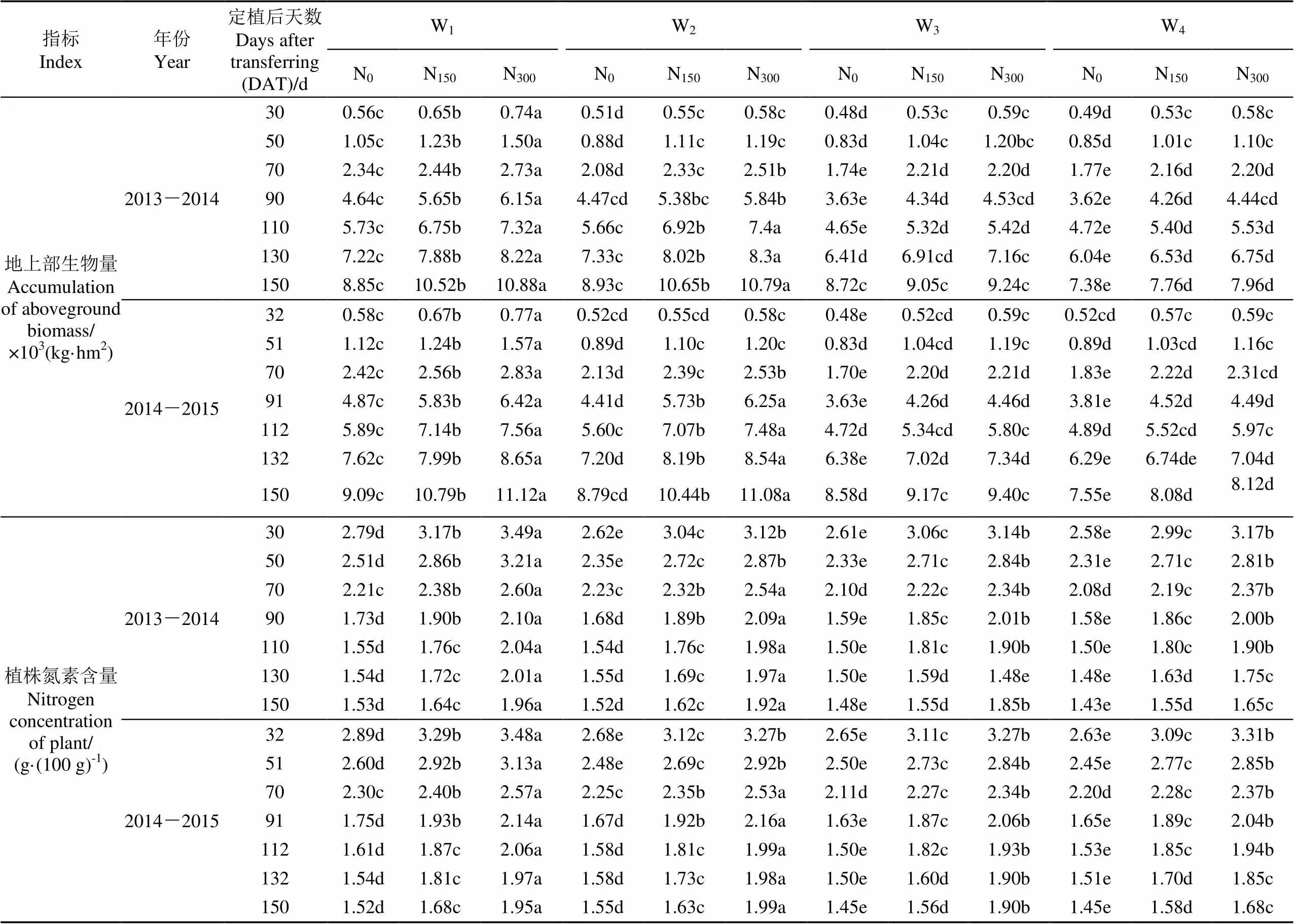
表2 2013-2015年不同水分和氮素处理对番茄地上部生物量的影响
注:W1~W4分别为全生育期充分灌水处理、仅苗期亏水50%处理、苗期开花期连续亏水50%处理和全部亏水50%处理;N0、N150和N300为施氮量为0、150和300 kg·hm-2处理;表中数据为各重复平均值,同一行数据具有相同字母的表示与同一年处理间没有达到显著性检验(<0.05),下同。
Note: W1-W4are full irrigation treatment, deficit of 50% only in seedling stage, deficit of 50% both in seedling stage and flowering stage, deficit of 50% in the whole growth stage; N0, N150and N300are no nitrogen application, nitrogen application rate of 150 kg·hm-2and nitrogen application rate of 300 kg·hm-2, respectively; Data of the table represent average value and those with the same letters are not significantly different (<0.05), same as below.
2.2 临界氮浓度稀释模型构建及验证
由于2013-2014年试验中在定植30 d时的各处理地上部生物量均小于1×103kg /hm2,生物量较小,粉碎后的样品无法测定氮含量,故舍去此数据。利用Justes等[26]所描述的方法,分别将2013-2014年不同灌水条件下不同氮肥处理番茄地上部生物量和对应的氮浓度进行计算,得到各取样日的临界氮浓度。根据地上部生物量及对应的临界氮浓度,建立番茄临界氮稀释曲线,如图2a所示。由图2a可以看出不同水分处理临界氮稀释曲线的决定系数(2)为别为0.92~0.98,其拟合度均达到极显著水平(<0.01),表明该模型在不同水分处理下均可以较好的反映番茄临界氮浓度和地上部生物量之间的关系。
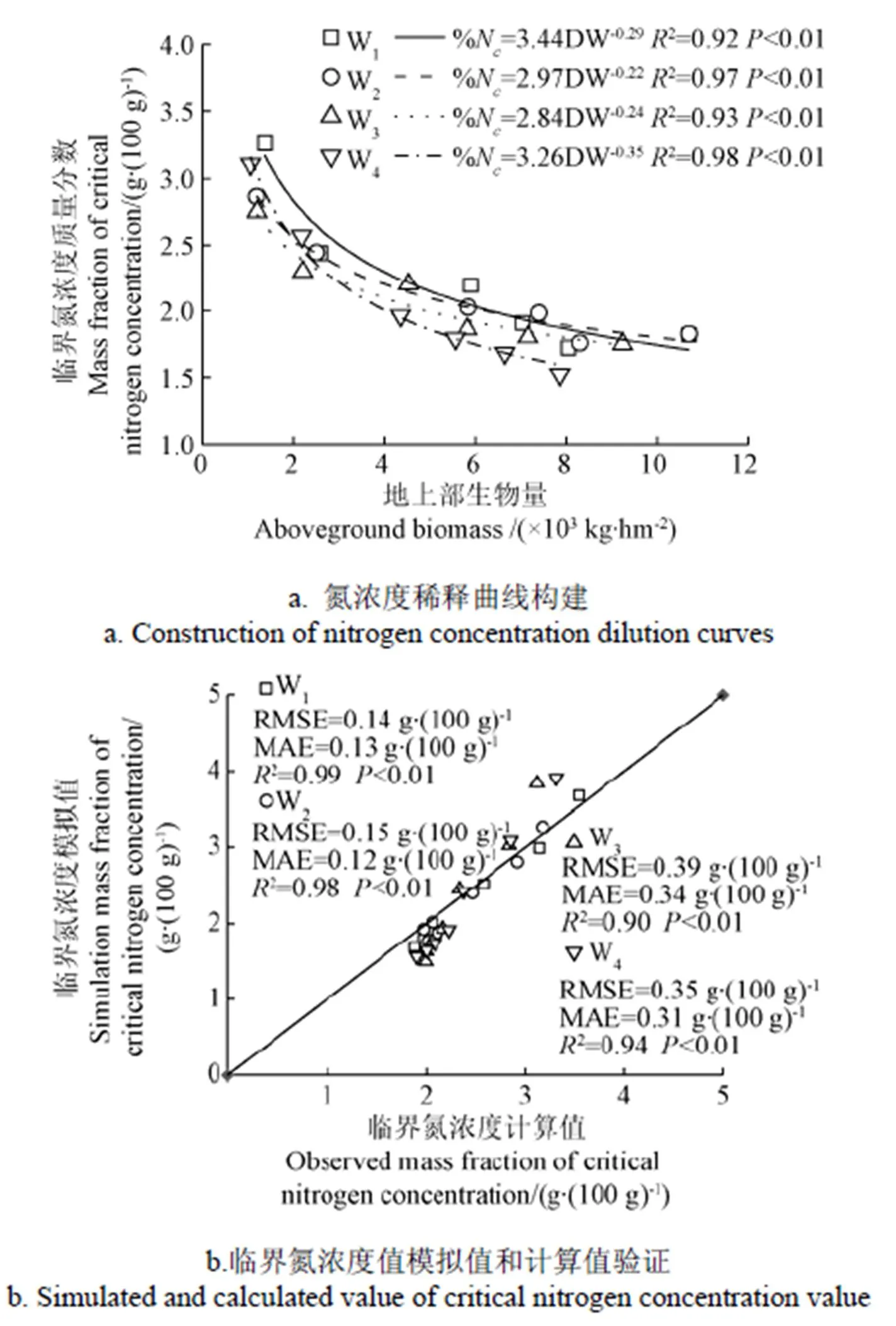
图2 不同水分处理下番茄氮浓度稀释曲线构建和验证
不同水分处理时临界氮稀释曲线参数、均不同,因此采用2013-2014年不同水分处理番茄全生育期平均日耗水量与对应处理临界氮稀释曲线参数、进行拟合,得到临界氮稀释曲线系数、与番茄全生育期平均日耗水量的相关关系,如图3所示,番茄全生育期平均日耗水量如表3所示。
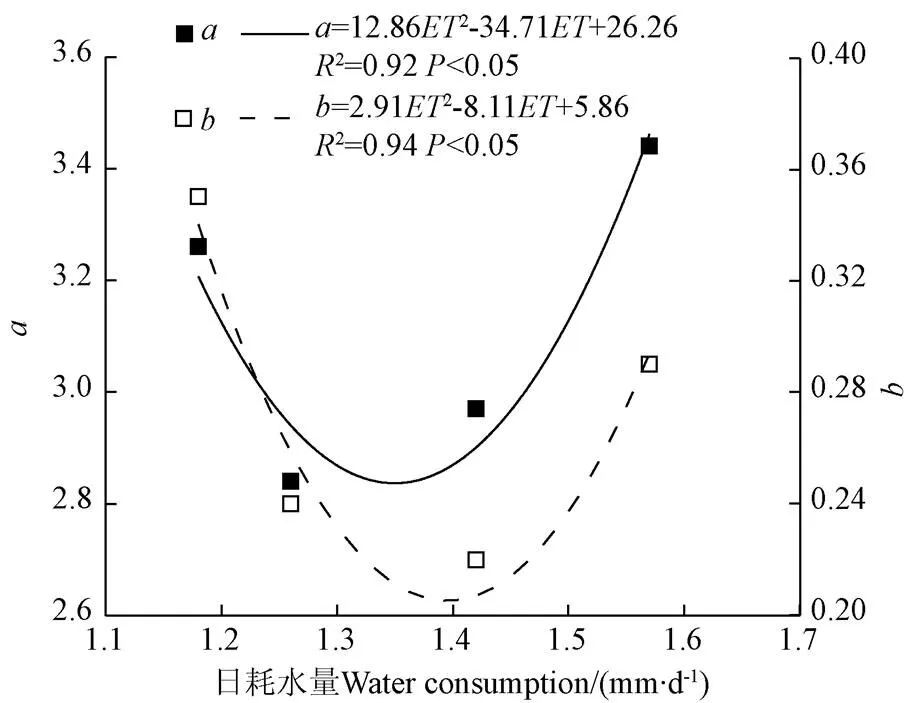
注:a和b为不同水分处理经验系数;ET为不同水分处理番茄全生育期日耗水量。
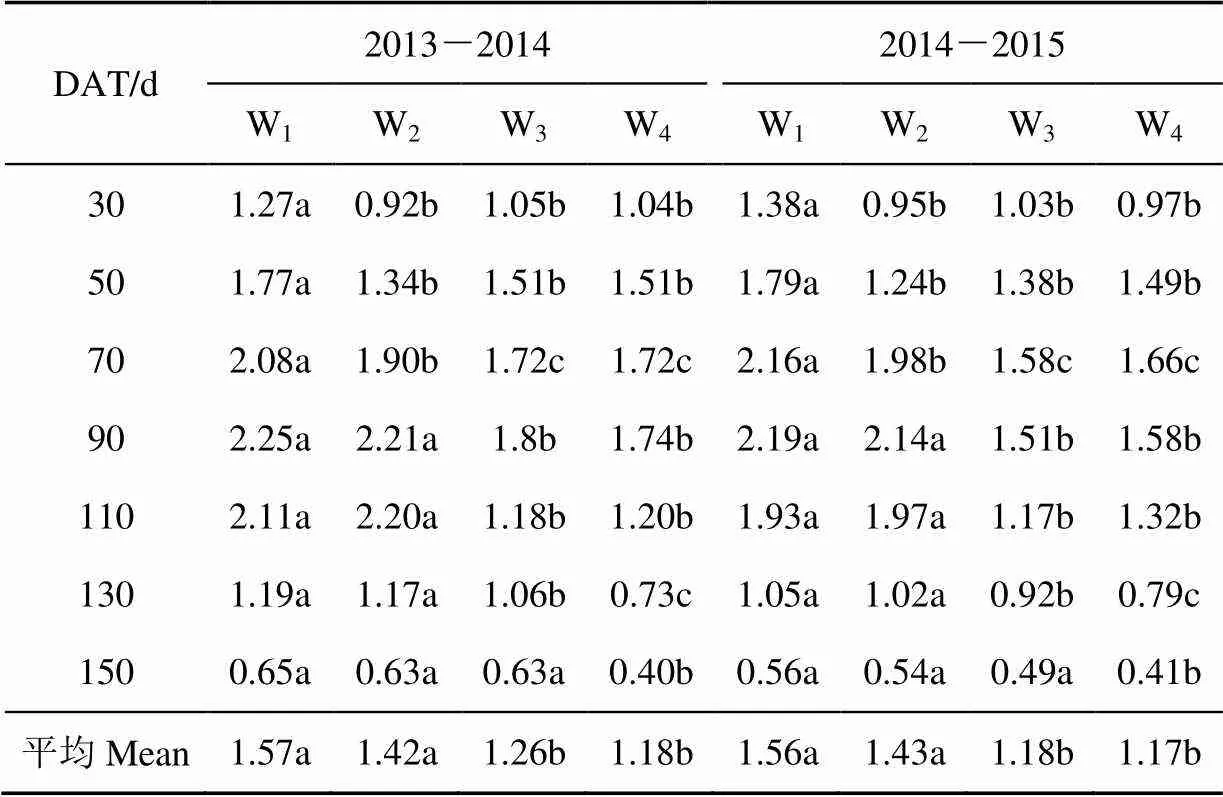
表3 2013-2015年不同水氮处理番茄耗水量
运用2014-2015年试验数据对拟合得到临界氮浓度稀释曲线和图3中的经验公式的可行性进行验证,其步骤为:通过2014-2015年不同水分处理下番茄全生育期平均日耗水量、全生育期地上部生物量、式(3)和图3中的经验公式拟合得到的临界氮浓度稀释计算临界氮含量模拟值,将临界氮浓度模拟值与计算值进行比较,结果如图2b所示。由图2b可以看出通过番茄生育期平均日耗水量、全生育期地上部生物量、式(3)和图3中的经验公式模拟得到的临界氮浓度与计算值之间有较好的一致性,其MAE为0.13~0.34 g/(100 g),RMSE为0.14~0.39 g/(100 g),2为0.94~0.99,因此可以运用不同灌水处理氮浓度稀释曲线和番茄全生育期平均日耗水量模拟番茄临界氮浓度,提高了氮浓度稀释曲线模型在温室番茄的适用性。
2.3 不同水分处理下番茄氮素营养指数变化分析
氮素营养指数(NNI)作为实际植株含氮量与临界含氮量的比值,可以直观的反映作物体内氮素的营养状况,当NNI=1,氮素营养状况最为适宜;当NNI>1,表现为氮素营养过剩;当NNI<1,表现为氮素营养亏缺。图4为根据公式(4)计算所得的不同水分和氮素处理下番茄氮营养指数(NNI)的动态变化。由图4可以看出不同灌水量时,NNI随施氮量的增加而增加,其值范围为0.66~1.19。定植后70 d后番茄开始开花,此时营养生长和生殖生长旺盛,植株对氮素的需求量较大,不同处理NNI的差距增大,此时开始追施氮肥来满足植株氮素的需求,充分灌水处理(W1)和仅苗期亏水(W2)时,N0和N150处理全生育期NNI始终小于1,不能满足植株对氮素的需求,N300处理NNI在1附近波动,因此充分灌水和仅苗期亏水适宜的施氮量为N300;苗期开花期连续亏水(W3)和全生育期亏水(W4)时,N0处理全生育期NNI均小于1,随着追施氮素的增加,N150和N300在定植90 d后NNI均大于1,且N150处理的NNI较为接近1,表明苗期开花期连续亏水和全生育期亏水处理时,N0和N300处理因为氮素不足或者氮素太多会抑制植株的生长,最适宜的施氮量为N150。
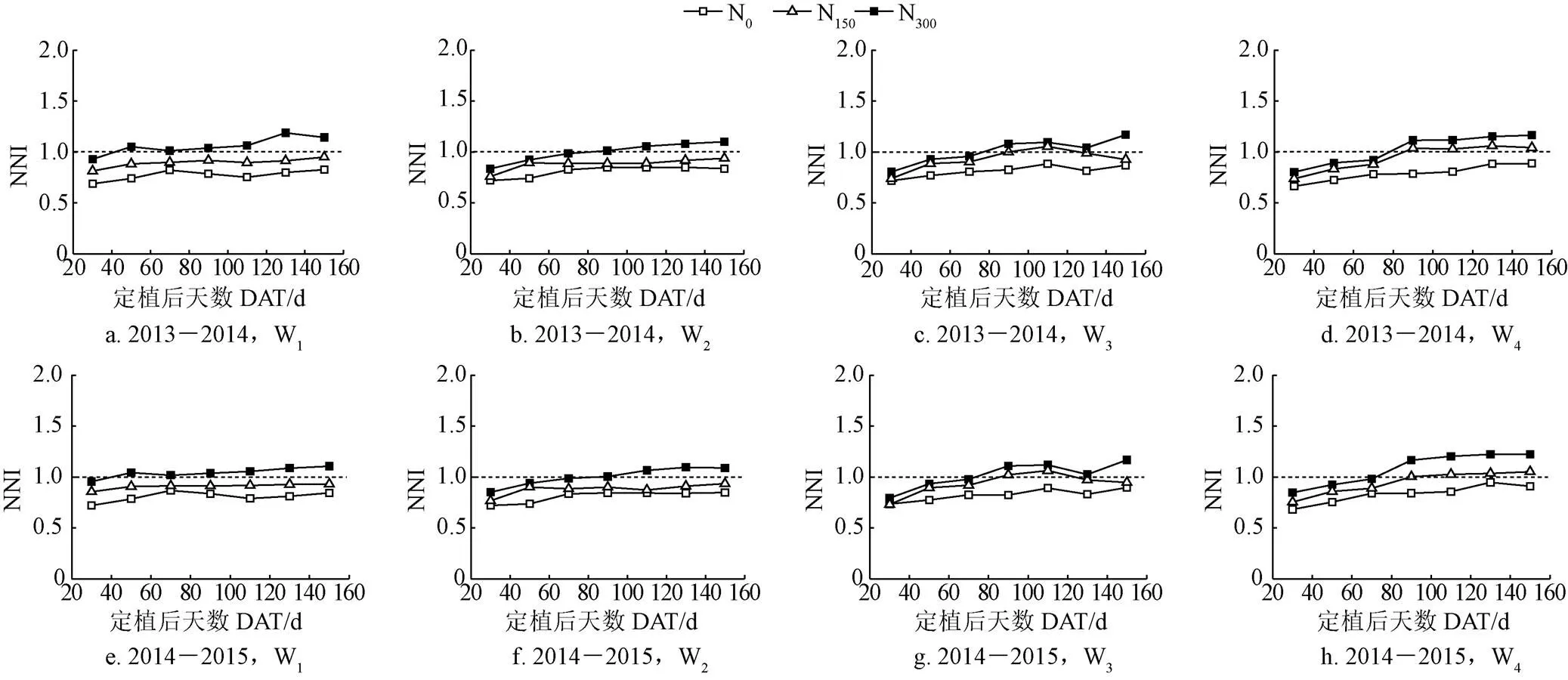
图4 2013-2015年不同水氮处理番茄氮素营养指标(NNI)动态变化
2.4 不同水氮处理番茄叶片SPAD值动态变化
不同水氮处理下番茄不同叶位SPAD值随定植后天数变化如表4所示。由表4可以得知,番茄不同叶位SPAD均值随定植天数表现出先增加后减小的变化趋势,在DAT=110 d时各处理不同叶位SPAD值均达到最大值,分别为42.8~70.3,随后番茄叶片开始老化,不同叶位SPAD值开始下降。
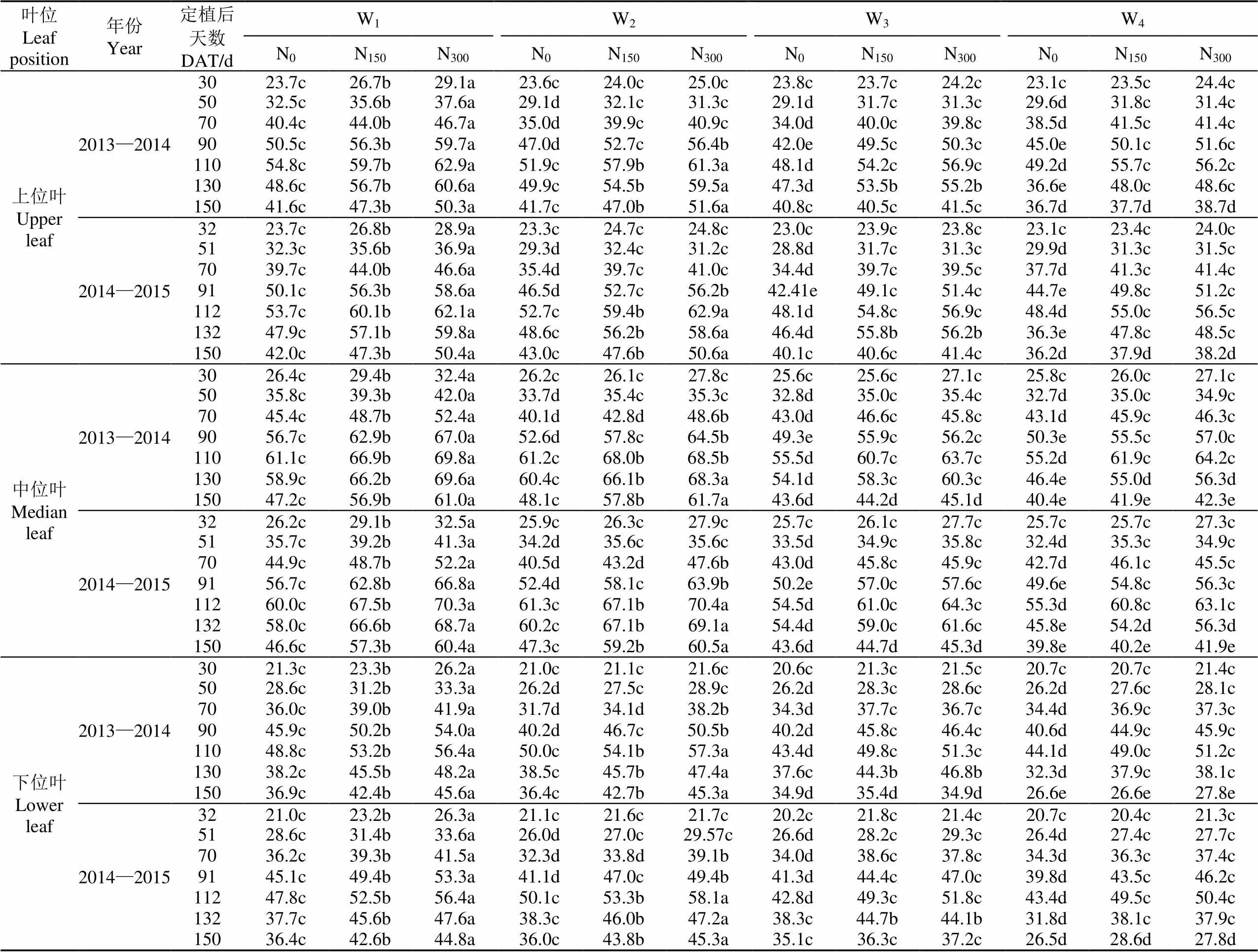
表4 2013-2015年不同水氮处理番茄不同叶位SPAD值
充分灌水(W1)时,番茄不同叶位叶SPAD值变化范围为21.0~70.3,番茄不同叶位SPAD值随施氮量的增加呈显著增加的趋势;苗期亏水(W2)、苗期开花期亏水(W3)和全生育期亏水(W4)时,亏水时间内番茄不同叶位SPAD值随施氮量的增加呈显著增加的趋势,且N150和N300处理之间不同叶位SPAD值无显著性差异;与充分灌水处理相比,仅苗期亏水(W2)时不会显著影响复水后番茄不同叶位SPAD值,随着亏水天数的增加,苗期开花期连续亏水成熟期复水后(W3)不同叶位SPAD值仍显著低于充分灌水处理(W1);全生育期亏水(W4)时,不同生育期叶片不同叶位SPAD值均显著低于充分灌水处理。表明充分灌水时,增加施氮量有显著的增加不同叶位SPAD值的效应,而非充分灌水时,施氮量增加到一定量(150 kg/hm2)继续增加施氮时不会显著增加番茄不同叶位SPAD值。施氮量相同时,充分灌水处理番茄不同叶位SPAD值显著高于非充分灌水处理番茄不同叶位SPAD值,表明增加灌水量可以增加番茄SPAD值,且各处理中位叶SPAD值高于上位叶和下位叶SPAD值。
2.5 不同叶位SPAD和氮营养指数(NNI)之间的关系
图5为2013-2015年不同水氮处理不同叶位(上、中、下叶位)SPAD值与对应处理的NNI之间的相关关系。由图5可以看出,不同水氮处理上位叶和下位叶SPAD值和NNI之间决定系数(2)为0.05~0.93,上位叶和下位叶SPAD值和NNI之间的回归关系受不同处理影响较大,除W3处理DAT=90d外,SPAD值与之间无显著线性关系;而中位叶SPAD值和NNI之间有良好的相关性,决定系数(2)为0.77~0.98,除W3和W4处理DAT=30 d外,其他均达到显著水平以上,表明番茄中位叶SPAD值和NNI之间呈显著正相关关系,NNI随着SPAD的增加而增加,且拟合关系表现比较稳定、密切,因此在不同水分处理时可以利用中位叶SPAD值对NNI进行估算,这样结合SPAD值监测方便、快捷和NNI预测精度高的优点可以对番茄植株氮含量进行更加快捷精准的估算。
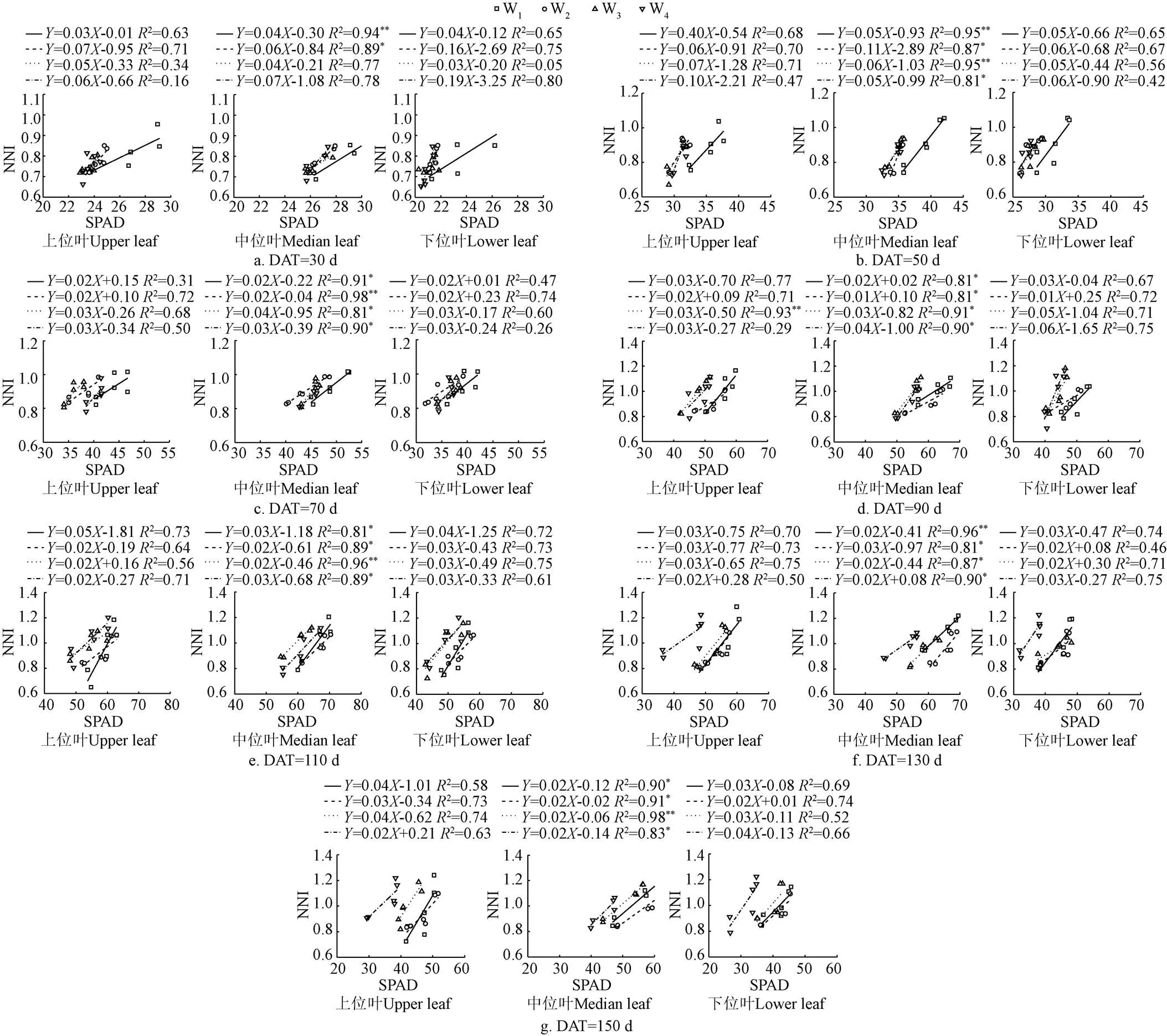
图5 2013-2015年番茄不同叶位SPAD值与NNI之间的关系
将2013-2015年不同水分处理不同定植后天数番茄NNI和中位叶SPAD值进行拟合(图5),由图5可以看出不同水分处理番茄NNI和中位叶SPAD值的相关关系不同,其拟合的形式为
NNI=·SPAD+(5)
式中NNI为不同处理氮素营养指数;SPAD为不同处理中位叶SPAD值;、为拟合公式参数,不同水分处理拟合得到的参数、如图5所示。
不同水分处理番茄中位叶SPAD与NNI之间的关系不同,因此采用2013-2015年试验数据对不同水分处理不同定植后天数番茄平均日耗水量与参数、进行拟合,得到参数、与番茄日耗水量(表3)的拟合关系,如图6所示。由图6可以看出番茄中位叶SPAD与NNI之间拟合关系参数、与对应番茄日耗水量有显著的关系,因此可以采用不同处理日耗水量得到参数、,进而得到番茄中位叶SPAD与NNI的线性关系,进而根据番茄中位叶SPAD值估算得到番茄NNI进行氮营养诊断。将NNI=1作为适宜施氮量的标准,NNI>1或NNI<1,表明氮素施加过量或不足营养,因此运用该方法模拟得到不同水分处理的NNI,进一步为氮营养诊断提供指导。
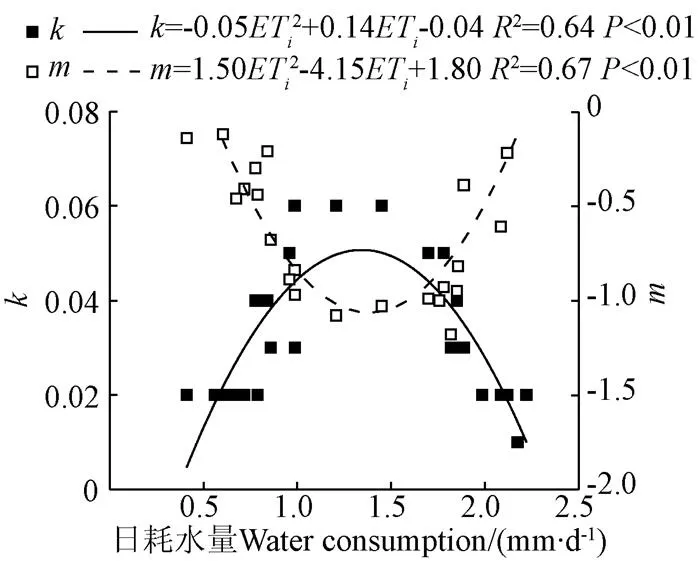
注:m和k为不同水分处理经验系数;ETi为不同水分处理番茄i天内平均日耗水量。
3 讨 论
3.1 临界氮浓度稀释曲线模型在西北地区温室番茄的适用性
水分和氮素作为影响植株生长的重要因素,不同水分和氮素处理影响作物发育和干物质累计[27],进而影响植株对氮素的吸收[28]。杨慧等[12]在研究盆栽番茄表明不同水分处理下临界施氮量有所不同,高水处理下植株的临界氮浓度较大,灌水可以促进植株对氮素的吸收。本研究也表明增加灌水量和施氮量可以增加番茄植株的临界氮浓度,通过拟合临界氮稀释曲线得到不同水分处理番茄临界氮稀释曲线参数和参数。不同因素对临界氮稀释曲线参数和参数的影响有所不同,赵犇等[33]研究表明由于品种不同植株吸收和同化氮的能力不同,参数与品种蛋白质含量呈正相关关系;向友珍等[34]研究氮浓度稀释模型在温室辣椒的适用性,得到临界氮稀释曲线参数与灌水量呈先增加后降低的趋势,参数不随灌水量的变化而显著变化;强生才等[16]在研究大田作物时表明,参数具有较好的稳定性,不会随降雨年型的改变而改变,且降水量较多时可以增加植株对土壤氮素的利用,从而减缓了植株氮含量的稀释过程,最终导致参数明显偏小。不同作物品种对水分和氮素的敏感性不同,温室番茄和辣椒对水分和氮素的敏感性远远高于大田玉米,水分和氮素影响着植株对氮素的吸收和植株地上部的生长,进而影响植株氮素的吸收和稀释。本研究表明临界氮稀释曲线参数和参数均随番茄全生育期平均日耗水量增加呈现出先降低后增加,番茄全生育期耗水量较低时植株吸收氮素的速率高于植株生长的速率,减缓了植株氮含量的稀释速率,降低了植株临界氮浓度值;当耗水量高于某一值时,继续增加耗水量时,植株吸收氮素的速率低于植株生长的速率,加快了植株氮含量的稀释速率,增大植株临界氮浓度值,提高番茄植株对氮素营养的容纳能力,促进植株生长。本文建立的基于全生育期平均日耗水量的不同水分处理临界氮稀释模型可以较为有效的估算出不同水分处理下植株临界氮浓度,与计算值相比,其绝对误差(MAE)为0.13~0.34 g/(100 g),标准误差(RMSE)为0.14~0.39 g/(100 g),绝对系数(2)为0.94~0.99,因此可以通过该方法准确估算不同水分处理的植株临界氮浓度,提高了临界氮稀释曲线在温室番茄不同水分处理的适用性。
3.2 基于不同叶位SPAD值的氮营养指数估算方法
SPAD仪具有携带方便、可实时实地进行测定等优点,被普遍用于监测棉花[35]、小麦[36]和玉米[37]等多种作物的施氮水平。叶片SPAD值与NNI之间的相关关系在玉米[38]和小麦[39]等植物上被证实,且Ziadi等[38]和 Prost and Jeuffroy[39]研究表明玉米和小麦叶片相对SPAD值与NNI之间的非线性关系,Debaeke等[36]研究表明小麦叶片相对SPAD值与NNI之间的非线性关系受年份、品种和生育时期影响不显著。Yang 等[23]研究表明作物不同叶位SPAD值和NNI表现出不同的线性关系,且不同叶位的稳定性不同,其中某一叶位叶片SPAD值和NNI拟合度较高,稳定性较好,可以作为诊断氮素的理想叶位。本研究也表明番茄不同水分处理不同叶位叶片SPAD和NNI之间呈线性相关关系,其中上位叶片和下位叶片SPAD值与NNI之间拟合度较差,拟合度受年份和处理的影响较大,稳定性较差,而中位叶片SPAD值和NNI之间呈显著线性正相关关系,稳定性较好,因此可以将番茄中位叶片作为适宜的诊断叶片进行氮素诊断。且番茄中位叶片SPAD值和NNI之间拟合参数与番茄平均耗水量呈显著非线性相关关系,因此通过不同水分处理日耗水量得到番茄中位叶片SPAD值与NNI之间的线性关系,并以NNI=1作为理想施氮营养状态指标,根据番茄不同耗水量得到NNI=1时的SPAD值,并以此SPAD值作为适宜值进行氮素营养诊断。当试验处理中位叶片SPAD值大于适宜SPAD值时,表明该处理氮素施加过量应该适当减少,当试验处理中位叶片SPAD值小于适宜SPAD值时,表明该处理氮素施加较少应该适当增加施氮量。因此可以通过比较不同处理SPAD值与适宜SPAD值来准确判断氮营养状况,来及时调整施氮量。
4 结 论
本研究依据2 a温室番茄不同水分处理下3个氮素水平的试验数据,率定和验证临界氮浓度稀释曲线模型在西北地区温室番茄不同水分处理下的适用性,并利用不同叶位叶片SPAD值对温室番茄氮营养指数进行估算,并进一步进行氮营养诊断,结果表明:
1)番茄临界氮浓度与采样日地上部最大生物量之间符合幂指数关系(N=DW-b),其中参数为2.84~3.44,参数为0.22~0.35,参数、与番茄全生育期平均日耗水量之间存在显著的非线性相关关系,因此可以通过不同水分处理全生育期平均日耗水量估算参数和参数,进而准确估算不同水分处理的植株临界氮浓度,提高了临界氮稀释曲线在西北地区温室番茄不同水分处理的适用性。
2)利用不同叶片SPAD值进行番茄氮营养诊断表明,氮营养诊断理想叶位是中位叶片。番茄中位叶片SPAD值与氮素营养指数NNI有良好的线性关系(NNI=·SPAD+),且参数、与番茄日耗水量有显著的非线性相关关系,因此可以通过不同水分处理日耗水量估算出参数、,进而模拟出不同定植后天数NNI=1时的SPAD值,并以此SPAD值作为判断氮素营养状况的标准来及时精准诊断植株氮营养状态。
[1] 高兵,任涛,李俊良,等. 灌溉策略及氮肥施用对设施番茄产量及氮素利用的影响[J]. 植物营养与肥料学报,2008,14(6):1104-1109.
Gao Bing, Ren Tao, Li Junliang, et al. Effects of irrigation strategies and N sidedressing on the yield and N utilization of greenhouse tomato[J]. Plant Nutrition and Fertilizer Science, 2008, 14(6): 1104-1109. (in Chinese with English abstract)
[2] 郭文忠,刘声峰,李丁仁,等. 设施蔬菜土壤次生盐渍化发生机理的研究现状与展望[J]. 土壤,2004,36(1):25-29.
Guo Wenzhong, Liu Shengfeng, Li Dingren, et al. Mechanism of soil salinization in protected cultivation[J]. Soil, 2004, 36(1): 25-29. (in Chinese with English abstract)
[3] Ziadi N, Brassard M, Bélanger G, et al. Critical nitrogen curve and nitrogen nutrition index for corn in eastern canada[J]. Agron J, 2008, 100(2): 271-276.
[4] Greenwood D J, Lemaire G. Decline in percentage N of C3and C4crops with increasing plant mass[J]. Annals of Botany, 1990, 66(4): 425-436.
[5] Lemaire G, Gastal F. Relationships between plant-N, plant mass and relative growth rate for C3and C4crops[C]// Proceedings first ESA Congress, Paris, 1990, 1.
[6] Lemaire G, van Oosterom E, Sheehy J, et al. Is crop N demand more closely related to dry matter accumulation or leaf area expansion during vegetative growth[J]. Field Crops Research, 2007, 100(1): 91-106.
[7] Gastal F, Lemaire G. N uptake and distribution in crops: An agronomical and ecophysiological perspective[J]. Journal of Experimental Botany, 2002, 53(370): 789-799.
[8] 王子胜,金路路,赵文青,等. 东北特早熟棉区不同群体棉花氮临界浓度稀释模型的建立初探[J]. 棉花学报,2012,24(5):427-434.
Wang Zisheng, Jin Lulu, Zhao Wenqing, et al. Preliminary development and application of a critical nitrogen concentration dilution model for cotton grown in northeast China[J]. Cotton Science, 2012, 24(5): 427-434. (in Chinese with English abstract)
[9] Jørgen E. Olesen, Jørgen Berntsen. Crop nitrogen demand and canopy area expansion in winter wheat during vegetative growth[J]. European Journal of Agronomy, 2002, 16(4): 279-294.
[10] 强生才,张富仓,田建柯,等. 基于叶片干物质的冬小麦临界氮稀释曲线模拟研究[J]. 农业机械学报,2015,46(11):121-128.
Qiang Shengcai, Zhang Fucang, Tian Jianke, et al. development of critical nitrogen dilution curve in winter wheat based on leaf dry matter[J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(11): 121-128. (in Chinese with English abstract).
[11] 王新,马富裕,刁明,等. 滴灌番茄临界氮浓度、氮素吸收和氮营养指数模拟[J]. 农业工程学报,2013,29(18):99-108.
Wang Xin, Ma Fuyu, Diao Ming, et al. Simulation of critical nitrogen concentration, nitrogen uptake and nitrogen nutrition index of processing tomato with drip irrigation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(18):99-108. (in Chinese with English abstract).
[12] 杨慧,曹红霞,柳美玉,等. 水氮耦合条件下番茄临界氮浓度模型的建立及氮素营养诊断[J]. 植物营养与肥料学报,2015,21(5):1234-1242.
Yang Hui, Cao Hongxia, Liu Meiyu, et al. Simulation of critical nitrogen concentration and nutrition index of tomato under different water and nitrogen conditions[J]. Journal of Plant Nutrition and Fertilizer. 2015, 21(5): 1234-1242. (in Chinese with English abstract).
[13] Tei F, Benincasa P, Guiducci M. Critical nitrogen concentration in processing tomato[J]. European Journal of Agronomy, 2002, 18(1): 45-55.
[14] an Oosterom E J, Carberry P S. Critical and minimum N contents for development and growth of grain sorghum [J]. Field Crops Research, 2001, 70(1): 55-73.
[15] 李正鹏,宋明丹,冯浩. 关中地区玉米临界氮浓度稀释曲线的建立和验证[J]. 农业工程学报,2015,31(13):135-141.
Li Zhengpeng, Song Mingdan, Feng Hao. Development and validation of critical nitrogen content curve for maize in Guanzhong area[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015. 31(13): 135-141. (in Chinese with English abstract).
[16] 强生才,张富仓,向友珍,等. 关中平原不同降雨年型夏玉米临界氮稀释曲线模拟及验证[J]. 农业工程学报,2015,31(17):168-175.
Qiang Shengcai,Zhang Fucang,Xiang Youzhen,et al. Simulation and validation of critical nitrogen dilution curve for summer maize in Guanzhong Plain during different rainfall years[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(17): 168-175. (in Chinese with English abstract).
[17] Lemaire G, Jeuffroy M H, Gastal F. Diagnosis tool for plant and crop N status in vegetative stage: Theory and practices for crop N management[J]. European Journal of Agronomy, 2008, 28(4): 614-624.
[18] Lemaire G, Gastal F, Salette J. N uptake and distributionin plant canopies: Diagnosis of the nitrogen status in crops[J]. Berlin: Spriger. 1997.
[19] 贾良良,范明生,张福锁,等. 应用数码相机进行水稻氮营养诊断[J]. 光谱学与光谱分析,2009,29(8):2176-2179.
Jia Liangliang, Fan Mingsheng, Zhang Fusuo, et al. Nitrogen status diagnosis of rice by using a digital camera[J]. Spectroscopy and Spectral Analysis, 2009, 29(8): 2176-2179. (in Chinese with English abstract).
[20] Madeire A C, Mendonca A, Ferreire M E, et al. Relationship between spectroradiometric and chlorophyll measurements in green beans[J]. Communications in Soil Science & Plant Analysis, 2000, 7(2/3): 695-704.
[21] 张金恒,王柯,王人潮. 叶绿素计SPAD-502在水稻氮素营养诊断中的应用[J]. 西北农林科技大学学报:自然科学版,2003,31(2):177-180.
Zhang Jinheng, Wang Ke,Wang Renchao. Application o f chlorophyll meter SPAD-502 in diagnosis of nitrogen status and nitrogenous fertilizer in rice[J]. Jour. of Northwest Sci-Tech Univ. of Agri. and For.: Nat. Sci. Ed. 2003, 31(2): 177-180. (in Chinese with English abstract).
[22] Errecart P M, Agnusdei M G, Lattanzi F A, et al. Leaf nitrogen concentration and chlorophyll meter readings as predictors of tall fescue nitrogen nutrition status[J]. Field Crops Research, 2012,129(1): 46-58.
[23] Yang H, Yang J, Lv Y, et al. SPAD values and nitrogen nutrition index for the evaluation of rice nitrogen status[J]. Plant Production Science, 2014, 17(1): 81-92.
[24] 王峰,杜太生,邱让建,等. 亏缺灌溉对温室番茄产量与水分利用效率的影响[J]. 农业工程学报,2010,26(9):46-52.
Wang Feng, Du Taisheng, Qiu Rangjian, et al. Effects of deficit irrigation on yield and water use efficiency of tomato in solar greenhouse[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(9): 46-52. (in Chinese with English abstract)
[25] 石小虎. 温室膜下滴灌番茄对水氮耦合的响应研究[D]. 杨陵:西北农林科技大学,2013.
Shi Xiaohu. Response of Greenhouse Tomato with Drip Irrigation under Plastic Mulch to Water-nitrogen Coupling[D]. Yangling: Northwest A&F University, 2013. (in Chinese with English abstract)
[26] Justes E, Mary B, Meynard J M. Determination of a critical nitrogen dilution curve for winter wheat crops[J]. Annals of Botany, 1994, 74(4): 397-407.
[27] 薛晓萍,陈兵林,郭文琦. 棉花临界需氮量动态定量模型[J]. 应用生态学报,2006,17(12):2363-2370.
Xue Xiaoping, Chen Binglin, Guo Wenqi. Dynamic quantitative model of critical nitrogen demand of cotton[J]. Chinese Journal of Applied Ecology, 2006, 17(12): 2363-2370. (in Chinese with English abstract)
[28] 梁效贵,张经廷,周丽丽,等. 华北地区夏玉米临界氮稀释曲线和氮营养指数研究[J]. 作物学报,2013,39(2):292-299.
Liang Xiaogui, Zhang Jingting, Zhou Lili, et al. Critical nitrogen dilution curve and nitrogen nutrition index for summer maize in north China plain[J]. Acta Agronomica Sinica, 2013, 39(2): 292-299. (in Chinese with English abstract).
[29] Lemaire G, Salette J. Croissance estivale en matiere seche de peuplements de fetuque elevee (Festuca arundinacea Schreb) et de dactyle (Dactylis glomerata L.) danslouest de la France: I. Etude en conditions de nutrition azotee et dalimentation hydrique non limitantes[J]. Agronomie, 1987, 7(6): 373-380.
[30] Nash J E, Sutcliffe J V. River flow forecasting through conceptual models, part I-A discussion of principles[J]. Journal of Hydrology, 1970, 10: 282-290.
[31] Willmott C J, Matsuura K. Advantages of the mean absolute error (MAE) over the root mean square error (RMSE) in assessing average model performance[J]. Climate Research, 2005, 30(1): 79-82.
[32] Wu Fuzhong, Bao Weikai, Li Fanglan, et al. Effects of drought stress and N supply on the growth, biomass partitioning and water-use efficiency of Sophora davidii seedlings[J]. Environ Exp Bot, 2008, 63(1/2/3): 248-255.
[33] 赵犇,姚霞,田永超,等. 基于临界氮浓度的小麦地上部氮亏缺模型[J]. 应用生态学报,2012,23(11):3141-3148.
Zhao Ben, Yao Xia, Tian Yongchao, et al. Accumulative nitrogen deficit models of wheat aboveground part based on critical nitrogen concentration[J]. Chinese Journal of Applied Ecology, 2012, 23(11): 3141-3148. (in Chinese with English abstract).
[34] 向友珍,张富仓,范军亮,等. 基于临界氮浓度模型的日光温室甜椒氮营养诊断[J]. 农业工程学报,2016,32(17):89-97.
Xiang Youzhen, Zhang Fucang, Fan Junliang, et al. Nutrition diagnosis for N in bell pepper based on critical nitrogen model in solar greenhouse[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(17): 89-97. (in Chinese with English abstract)
[35] Wu F B, Wu L H, Xu F H. Chlorophyll meter to predict nitrogen sidedress requirements for short-season cotton (Gossypium hirsutum L.)[J]. Field Crops Res. 1998, 56:309-314.
[36] Debaeke P, Rouet P, Justes E. Relationship between the normalized SPAD index and the nitrogen nutrition index: Application to durum wheat[J]. Journal of Plant Nutrition. 2006, 29: 75-92.
[37] Singh V, Singh Y, Singh B, et al. Calibrating the leaf colour chart for need based fertilizer nitrogen management in different maize (Zea mays L.) genotypes[J]. Field Crops Res. 2011, 120: 276-282.
[38] Ziadi N, Brassard M G, Belanger A N, et al. Critical nitrogen curve and nitrogen nutrition index for corn in eastern Canada[J]. Agron. J.2008, 100: 271-276.
[39] Prost L, Jeuffroy M H. 2007. Replacing the nitrogen nutrition index by the chlorophyll meter to assess wheat Nstatus[J]. Agronomy Sustainable Development. 2007, 27: 321-330.
Estimation of nitrogen nutrition index of greenhouse tomato under different water and nitrogen fertilizer treatments based on leaf SPAD
Shi Xiaohu1,2, Cai Huanjie2※
(1.,030024,; 2.,,712100,)
Water and nitrogen have great influences on the production of tomato in greenhouses. This study aims to determine the applicability of the critical nitrogen concentration dilution curve model in different water conditions, and to suggest a rapid and accurate method of identifying the nitrogen condition of tomato. Greenhouse experiments with different water-nitrogen combinations were conducted in 2013-2015 in Yangling, Shaanxi. Four water treatments were investigated, i.e., full irrigation through the whole life span of tomato, deficit of 50% at seedling stage, deficit of 50% at flowering stage, and deficit of 50% through the whole life span. Three nitrogen treatments were investigated, i.e., 0, 150, and 300 kg/hm2. We validated and verified the critical nitrogen concentration dilution curve model with the data in 2013-2015. We verified the applicability of the model under different water treatments of greenhouse tomato in Northwest China. We built relationship between the model parameters and the average daily water consumption of tomato during the whole growth stage, and improved the applicability of the critical nitrogen concentration dilution curve model under different water treatments. Both the parameter a and the parameter b of the critical nitrogen concentration dilution curve model decreased first and then increased with the increase of the average daily water consumption during the whole growth period of the tomato.We analyzed the relationship between SPAD (soil and plant analyzer development) values and nitrogen nutrition index (NNI) at different leaf positions with the test data in 2013-2015. There was a linear correlation between SPAD and NNI at different leaf positions of tomato under different water treatments. The fitting relationship between the SPAD values and the NNI of the upper and lower leaves was poor, and the degree of fitting was greatly affected by the year and the treatment. The fitting relationship between the median leaf’s SPAD value and NNI was a significant linear positive correlation relationship and had good stability. Therefore, the tomato median leaf can be used as a suitable diagnostic leaf for nitrogen diagnosis. The results showed that: 1) The model could well estimate the critical nitrogen concentration of tomato with the absolute error of 0.13-0.34 g/ 100 g, the standard error of 0.14-0.39 g/ 100 g, and the decisive factor (2) of 0.94-0.99. 2) At the median position of canopy, there was a good linear correlation between the SPAD value and NNI, and the SAPD values of the middle leaves can be used to determine the nitrogen conditions of tomato. 3) The SPAD values of middle leaves at the NNI of 1 can be the indicators for appropriate nitrogen fertilizing. When the SPAD value of the median leaf in the different treatments is greater than the appropriate SPAD value, it indicates that the application of nitrogen in the treatment is excessive and should be appropriately reduced. When the SPAD value of the medial leaf in the test treatment is less than the appropriate SPAD value, it indicates that the application of nitrogen should be appropriately increased. Therefore, we have determined and validated the applicability of the critical nitrogen concentration dilution curve model under different water treatments of greenhouse tomato in Northwest China and constructed a nitrogen nutrition diagnosis method based on the daily water consumption of tomato, which can support nitrogen diagnosis and nitrogen management of tomato in greenhouses in this region.
chlorophyll; water; greenhouse; tomato; water treatments; critical nitrogen concentration; nitrogen nutrition index
10.11975/j.issn.1002-6819.2018.17.016
S152.7
A
1002-6819(2018)-17-0116-11
2018-03-24
2018-07-27
国家科技支撑计划(2011BAD29B01);国家自然基金(51179162);2011年度高等学校博士学科点专项科研基金资助课题(20110204130004)
石小虎,博士,主要从事农业节水理论研究。 Email:shixiaohu2006@126.com
蔡焕杰,教授,博士生导师,主要从事农业节水与水资源高效利用研究。Email:caih j@nwsuaf.edu.cn
石小虎,蔡焕杰. 基于叶片SPAD估算不同水氮处理下温室番茄氮营养指数[J]. 农业工程学报,2018,34(17):116-126. doi:10.11975/j.issn.1002-6819.2018.17.016 http://www.tcsae.org
Shi Xiaohu, Cai Huanjie. Estimation of nitrogen nutrition index of greenhouse tomato under different water and nitrogen fertilizer treatments based on leaf SPAD[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(17): 116-126. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.17.016 http://www.tcsae.org

