蛛网膜下腔出血合并脑室出血后继发吉兰-巴雷综合征1例
段晓琴 陈 岩 黄 萨 刘忠良△ 宋新光
1)吉林大学第二医院康复医学科,吉林 长春 130041 2)吉林大学第二医院神经外科,吉林 长春 130041 3)吉林大学第二医院放射线科,吉林 长春 130041 4)河南省人民医院,河南 郑州 450003
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是以周围神经和神经根的脱髓鞘病变及小血管炎性细胞浸润为病理特点的自身免疫性周围神经病[1-10]。经典的GBS称为急性炎症性脱髓鞘性多发性神经病[1,3],临床表现为急性对称性弛缓性肢体瘫痪。GBS爆发最常与空肠弯曲杆菌感染有关,但其他因素,如寨卡病毒、E型乙肝病毒等也与该病有关联[11-12]。但蛛网膜下腔出血后并发吉兰-巴雷综合征的病人临床较少见。本文报告吉林大学第二医院神经外科收治的1例蛛网膜下腔出血合并脑室出血继发吉兰-巴雷综合征患者,以期为该病的临床诊治提供参考。
1 临床资料
梁某,女,66岁,于2周前无明显诱因突然出现意识不清,呕吐白沫,四肢肌张力增高,持续约30 min后清醒,就诊于当地医院,头部CT检查示蛛网膜下腔出血,对症治疗后病情好转,1周前出现四肢活动不灵,体温间断升高、呼吸费力,为进一步诊治,于2016-11-30就诊于吉林大学第二医院神经外科,门诊以“蛛网膜下腔出血”收入院。既往高血压史15 a,糖尿病史10 a,自行胰岛素治疗,血糖尚可;因肾动脉狭窄行左肾动脉支架术后5 a。入院体格检查:患者嗜睡状态,唤醒后配合体格检查,言语缓慢,听力下降,双侧瞳孔等大等圆,直径约2.0 mm,对光反射迟钝,四肢肌张力正常,双侧上肢近端肌力2级,远端肌力3级,双侧下肢肌力0级,四肢腱反射对称减弱,双侧Babinski征阴性。入院时头部CT示,脑室系统内见高密度影,双侧侧脑室内见高密度影。双侧侧脑室增宽,前后角变顿,第三、四脑室扩张。双侧侧脑室旁及半卵圆中心可见较对称密度减低影,中线结构居中。诊断提示蛛网膜下腔出血破入脑室(图 1)。胸部CT示,两肺纹理增多,含气不均,两肺下叶见斑片状高密度影,边界不清,左肺上叶及右肺中叶见索条状高密度影,气管及主支气管开口通畅,纵隔未见肿大淋巴结,两侧胸膜走行欠规整。诊断提示两肺纹理增多;两肺下叶斑片影,不除外坠积性改变所致;左肺上叶及右肺中叶索条影;两侧胸膜增厚(图 2)。头颈CTA示,右侧颈总动脉可见非钙化斑块形成,管腔未见明显狭窄;右侧颈内动脉可见混合斑块形成,管腔轻度狭窄;左侧颈内动脉开口处可见非钙化斑块形成,管腔中度狭窄;双侧椎动脉V3、V4段可见多发轻到中度狭窄;基底动脉局部呈梭形扩张,双侧大脑前动脉可见多发轻到中度狭窄,双侧大脑中动脉及分支可见多发中到重度狭窄;左侧大脑后动脉可见多发中到重度狭窄。诊断提示头颈部动脉粥样硬化、基底动脉瘤(图3)。结合病史、体征及相关辅助检查,初步临床诊断为蛛网膜下腔出血合并脑室出血、双肺炎症、头颈部动脉硬化、动脉瘤(基底动脉)、2型糖尿病。
治疗上给予抗炎(头孢替唑)、营养神经(脑蛋白水解物)、预防血管痉挛(尼莫同)等药物治疗。于2016-12-02行神经电生理检查,EMG示,右三角肌、右胫前肌、左腓肠肌内侧头可见自发电位发放,MUP发放密度减少;余四肢被检肌未见自发电位发放,MUP发放减少甚至缺如。MNCV示,双尺神经、左腓深神经周围运动传导未引出;左桡神经周围运动传导(Erb’s点刺激)未引出;双腋神经Erb’s点刺激潜伏时轻度延迟、波幅降低、波形离散;左正中神经、右腓深神经、双胫神经末梢运动潜伏时轻度延迟,周围运动传导波幅降低;双股神经周围运动传导波幅降低、波形离散;左正中神经F波未引出;右正中神经、双尺神经F波出现率下降;双胫神经H反射未引出;余四肢被检神经周围运动传导未见异常。SNCV示,四肢被检神经末梢感觉传导未见异常;重复刺激试验:双正中神经重复衰减试验低频、高频阴性。考虑多发根并周围神经病变(吉兰-巴雷综合征),请结合临床。颈椎、胸椎MRI显示颈椎、胸椎骨质增生。头部MRI弥散成像未见异常。上述检查回报后给予免疫球蛋白冲击治疗,患者呼吸困难、肢体功能有所改善,此后患者经系统药物治疗好转后出院。
2 讨论
2009年,YARDIMCI等[13]首次报道了GBS可发生在蛛网膜下腔出血之后。2013年吴凌峰等[14]报道了1例蛛网膜下腔出血动脉瘤夹闭术后4 d出现四肢乏力的40岁男性,通过神经电生理检查及脑脊液检查诊断为吉兰-巴雷综合征。2017年王长明等[15]报道了1例蛛网膜下腔出血动脉瘤栓塞术后5 d合并吉兰-巴雷综合征病人,并认为其发病机制可能与免疫功能紊乱和脑血管痉挛有关。2016年,WU等[16]报道2例脑出血患者在急性期出现进行性弛缓性四肢瘫和危及生命的呼吸困难,结合脑脊液和肌电图结果被诊断为急性GBS。进一步研究发现,GBS和脑出血可以先后发生,但不同的发生顺序具有完全不同的发病机制。脑出血后的GBS与全身炎症反应的不平衡有关,而GBS后脑出血是由于血管自主功能障碍和静脉使用免疫球蛋白引起的。此外,WEI等[17]报告了1例51岁女性吉兰-巴雷综合征患者,伴窦性心动过速、高血压、胃肠动力症状和尿潴留,发展为全身性头痛和植物神经功能紊乱,3个月后MRI / MRA显示脑血管收缩和小量蛛网膜下腔出血,阐述了可逆性脑血管收缩综合征(其特征是头痛、局灶性神经功能缺损或癫痫发作以及可逆的脑血管收缩)并发于GBS自主神经功能障碍的潜在机制。SANGROULA等[18]报道了1例24岁健康男性,在诊断GBS肌肉无力之前2周出现植物神经功能紊乱,其行为症状包括抑郁症、焦虑症和遗忘症。因此,尽管GBS通常被认为是周围神经病变,但存在CNS受累的证据,对于新发病、不明确的精神病和中枢神经系统症状,应在鉴别诊断中考虑GBS并监测神经学特征。
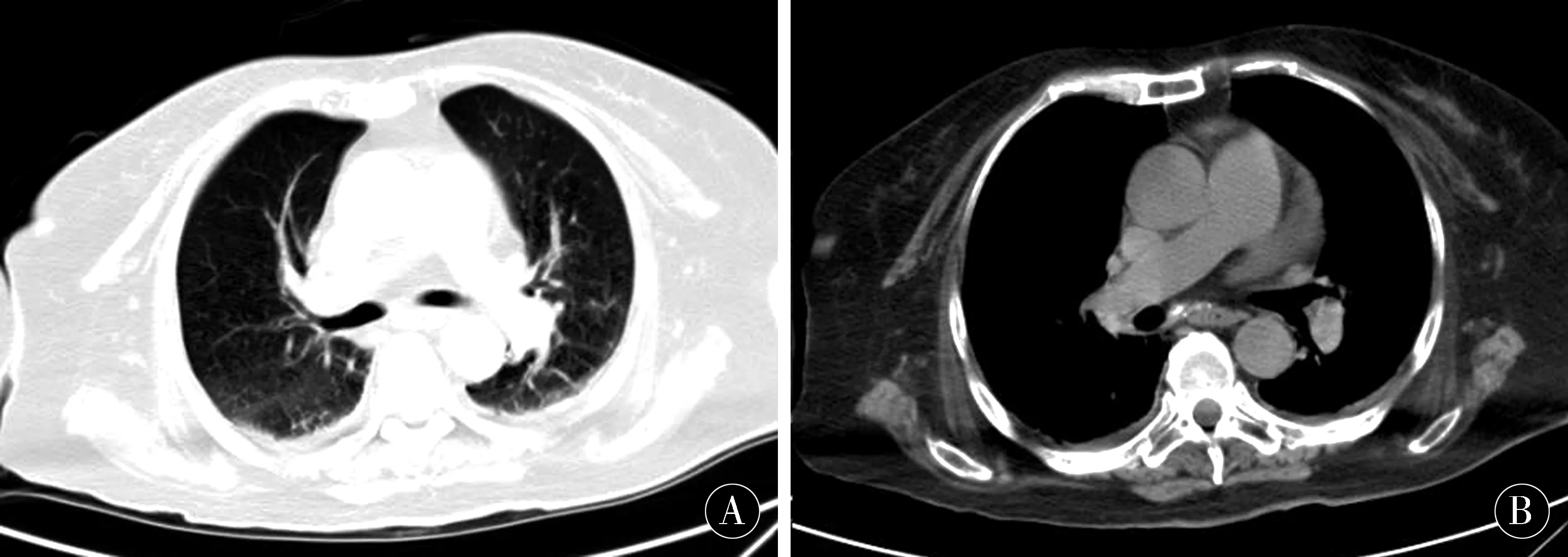
图2 胸部CT(2016-11-30)Figure 2 Chest CT(2016-11-30)
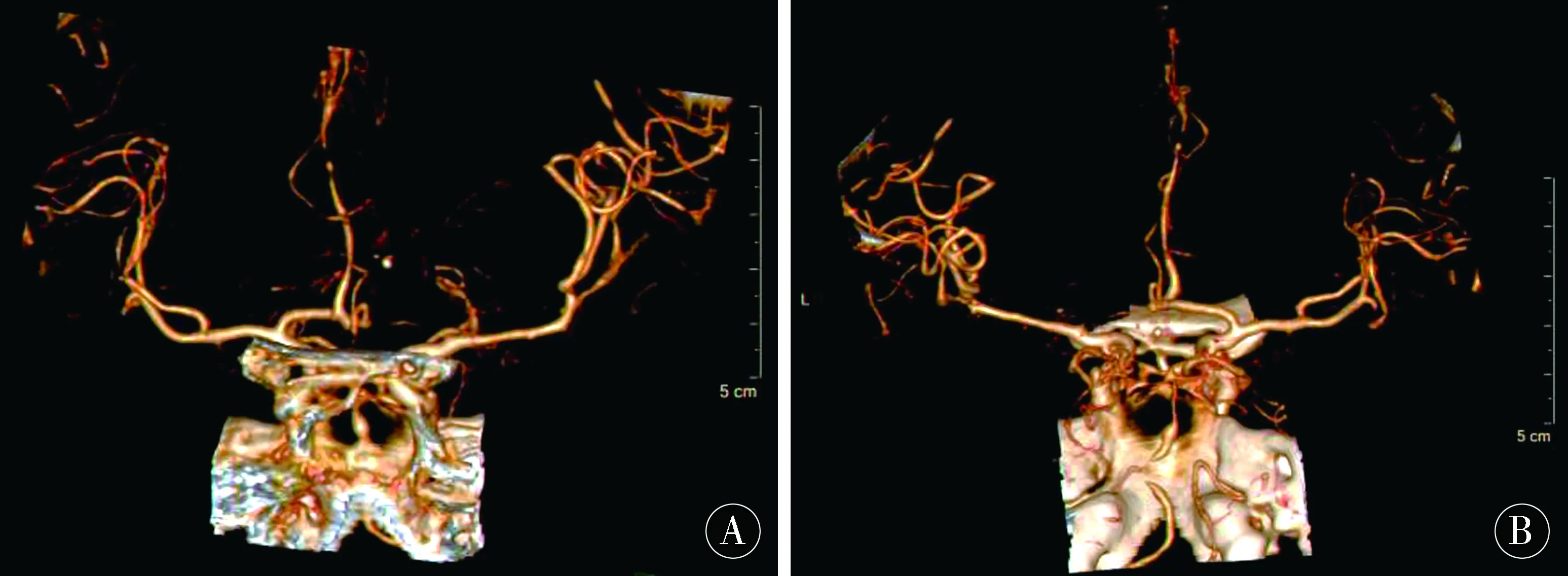
图3 头部CTA(2016-11-30)Figure 3 Head CTA(2016-11-30)
分析本例患者,蛛网膜下腔出血合并脑室出血后1周出现GBS表现,未发现其他可致急性周围神经损害的病因,且患者昏迷仅30 min,醒后药物对症治疗后脑部病情尚平稳,与重症病相关多发性神经病和肌病[19-20]不同。EGASHIRA等[21]曾在蛛网膜下腔出血的WT小鼠中发现,大脑白质在磁共振成像中显示血脑屏障破坏(蛋白泄漏)和T2高信号。ZHENG等[22]评估蛛网膜下腔出血中血浆肽素检测与胶质纤维性星形胶质细胞蛋白、髓鞘碱性蛋白、磷酸化轴突神经丝亚单位H、神经元特异性烯醇化酶和泛素羧基末端水解酶等发现,前述生物标记物的血浆浓度与世界神经外科医师联合会蛛网膜下腔出血量表评分高度相关。因此,笔者认为蛛网膜下腔出血合并脑室出血病人继发GBS的原因在于,蛛网膜下腔出血后急性中枢神经系统损伤[23-31],脑损伤的生物标志物,如髓鞘蛋白等渗透至血液中,引起神经根及周围神经免疫应答,从而导致神经脱髓鞘病变。因此,吉兰-巴雷综合征可继发于蛛网膜下腔出血,临床实践中应引起重视,及时依治,其发病机制待进一步研究。

