程序性细胞死亡受体1配体在弥漫大B细胞淋巴瘤中的表达及临床意义
梁莉,夏瑞祥,葛健
(安徽医科大学第一附属医院血液内科,安徽 合肥 230022)
弥漫大B细胞淋巴瘤(DLBCL)是成人非霍奇淋巴瘤中的主要类型,约占30%~40%,多见于中老年人,在中国以40~50岁患者居多。在近年治疗方法的进步下,一些患者预后良好,但仍有部分患者因疾病复发或者耐药面临治疗效果差[1],研究影响其临床特征及预后的因素,为新的治疗方案提供思路。
程序性死亡受体1配体(PD-L1)为B7家族中的一员,是一种跨膜蛋白。正常情形下免疫系统会对聚集在淋巴结或脾脏的外来抗原产生反应,促进具有抗原特异性的T细胞增生。而程序性死亡受体1(PD-1)及PD-L1结合后能产生抑制性信号,减少T细胞的产生,这一机制在自身免疫耐受及防止自身免疫性疾病中发挥重要作用。多种肿瘤细胞表面也表达 PD-L1,在肿瘤细胞中表达的PD-L1与肿瘤浸润淋巴细胞表面的PD-1分子结合,抑制淋巴细胞功能和细胞因子释放,诱导淋巴细胞凋亡,从而抵抗淋巴细胞杀伤,最终导致肿瘤发生免疫逃逸。与PD-L1结合的受体PD-1,在机制中也起着必不可少的作用,PD-1抗体已成为首款依照生物标志物进行癌症治疗的新药,用于治疗转移性黑色素瘤,转移性非小细胞肺癌,复发性及转移性头颈癌,难治性经典霍奇金淋巴瘤或是尿路上皮癌的特定患者。近些年研究已经证实PD-L1在多种肿瘤细胞和肿瘤组织中均有表达[2-3],对于PD-L1在DLBCL的表达相关研究仍需进一步进行,故本研究回顾性分析安徽医科大学第一附属医院80例DLBCL的患者病理组织中PD-L1的表达,并分析统计该些患者的年龄分期分组及疗效,探讨其相关性,为DLBCL患者的危险分层提供新的方向,为下一步治疗提供相关实验依据。
1 资料与方法
1.1一般资料收集安徽医科大学第一附属医院2012年2月至2015年6月期间于病理科经组织形态学及免疫组织化学新诊断为DLBCL患者的甲醛固定石蜡包埋的病理组织标本,诊断标准参照2008年WHO血液淋巴肿瘤分类标准[4]。要求:标本获得于新诊断且未接受任何化疗时,并且保证患者临床病例及预后资料完整,对于合并活动性乙型肝炎病毒(HBV)感染及其他肿瘤的患者排除。本研究获安徽医科大学第一附院医院伦理委员会批准,患者或近亲属对研究方案签署知情同意书。
1.2试剂和仪器兔抗人PD-L1抗体(一抗),Abcam公司;PV-6000聚合物免疫组织化学检测试剂盒(酶标羊抗小鼠/兔IgG聚合物),购自北京中杉金桥生物技术有限公司;浓缩型DAB显色试剂盒,购自北京中杉金桥生物技术有限公司;PBS缓冲液,购自无锡傲锐东源生物科技有限公司; 柠檬酸购自无锡傲锐东源生物科技有限公司;梯度酒精;二甲苯;苏木素;中性树胶封固剂; 组织防脱载玻片。
1.3实验方法根据选好的病理组织蜡块,由病理科老师切片及摊片,切片标注对应的病理号。实验步骤如下:(1)烤片-脱蜡-水化-抗原修复-画圈-孵育-吐温;(2)滴加一抗(PD-L1):根据组织大小自行调整滴加量,4 ℃温度下过夜孵育;(3)滴加二抗,室温下孵育30 min,再经PBS冲洗及DAB显色处理;(4)复染-蓝化-置于梯度浓度酒精及二甲苯中;(5)封片:滴加中性树胶封固剂,放置于封片机。
1.4结果判读对染色成功的切片,由2位资深病理科医师在未知患者信息的情况下进行独立读片,对于结果不一致的切片由第3位病理科医师复核,经讨论后获得一致结果,根据读片结果,PD-L1在细胞膜上表达,本实验PD-L1表达阳性的标准为PD-L1阳性细胞占所有细胞>30%,阳性标准基于既往研究的阳性标准[5-6],以便于横向对比。
1.5临床资料收集所有患者按Ann Arbor-Cotswolds分期,ECOG评分,IPI评分系统对患者进一步分期的评分,诊断后经过至少3个疗程CHOP(环磷酰胺、表柔比星、长春地辛及地塞米松)或RCHOP(CHOP方案联合利妥昔单抗)方案进行化疗,80例患者的平均中位评估时间为7个疗程,均在一线CHOP或R-CHOP方案化疗后进行评估,根据《2016年NCCN淋巴瘤治疗指南》进行疗效评估。
1.6统计学方法采用SPSS 23.0软件进行统计学处理,数据比较采用Pearson χ2检验分析PD-L1表达与患者临床特征的关系,不满足χ2检验条件时应用Fisher精确概率法。应用单因素和多因素logistic分析方法影响患者疗效的因素。采用多元逐步法回归分析(α剔除>0.1,α进入<0.05)。
2 结果
2.1患者临床及病理特征本研究纳入了80例DLBCL患者,其中男性49例(61%),女性31例(39%),发病年龄16~82岁,中位年龄58岁,年龄≥60岁者有29例(36%),患者PD-L1的表达与治疗效果相关,PD-L1阳性的患者的缓解率为58%,显著低于PD-L1阴性患者的缓解率(90%),差异有统计学意义(P=0.001),PD-L1阳性与non-GCB亚型相关,non-GCB亚型患者PD-L1阳性率为71%,而GCB亚型为29%(P=0.035),PD-L1的表达与患者的年龄、分期、IPI评分、B组症状的有无、ECOG评分、LDH升高、>1处结外受累无相关性。结果见表1。
2.2影响患者疗效的单因素分析结果显示年龄(OR=0.353,P=0.058),分期(OR=0.126,P=0.002)、IPI评分(OR=0.123,P=0.001)、结外受累>1(OR=0.180,P=0.006)、加用利妥昔单抗(OR=4.257,P=0.015),PD-L1(OR=0.157,P=0.002),DCBCL类型是影响疗效的因素。
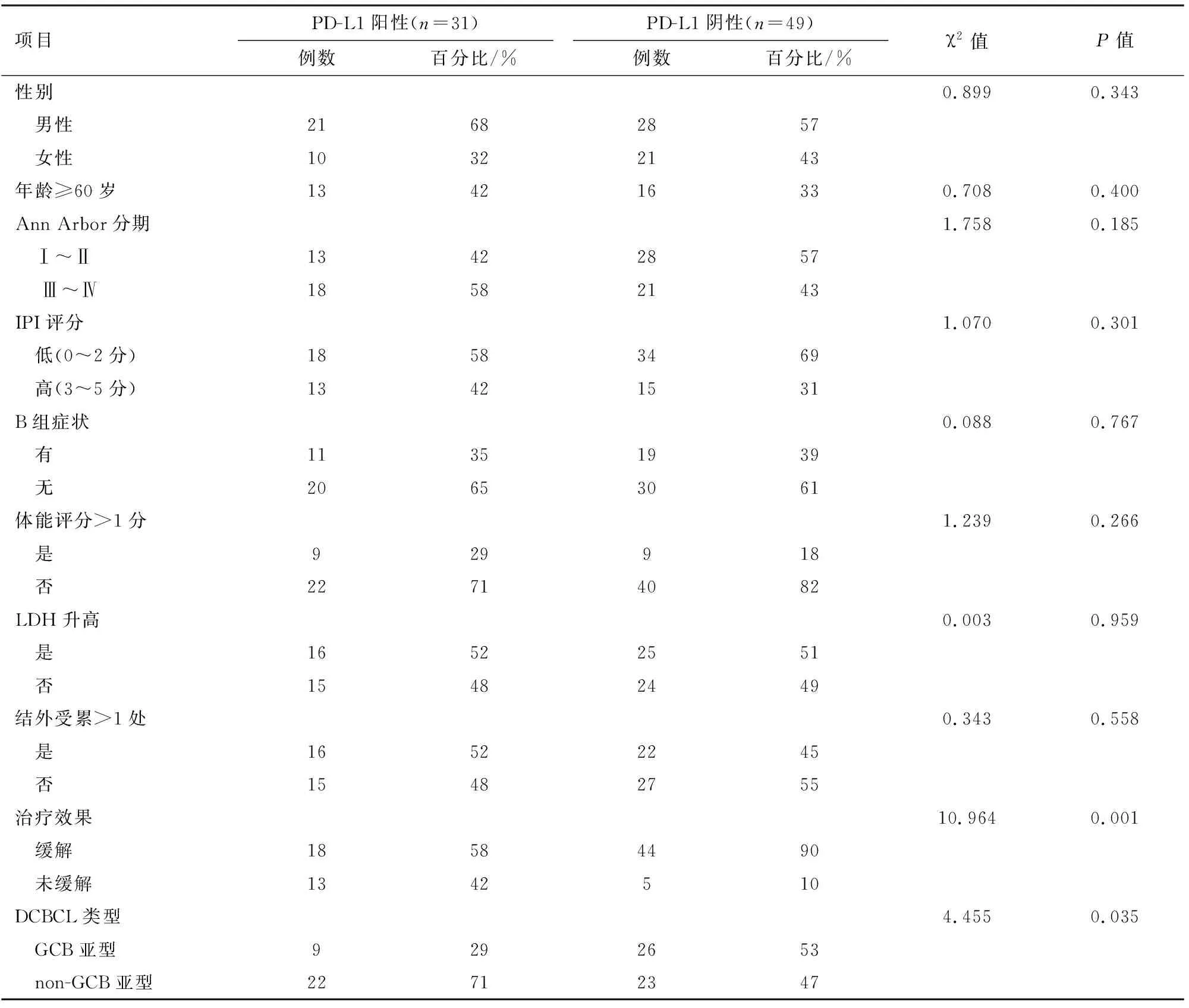
表1 PD-L1表达与患者临床资料列联表
2.3影响患者疗效的多因素分析采用P<0.1的变量进入多因素分析,因IPI评分包含年龄分期结外受累等因素,纳入PD-L1,IPI评分,DCBCL类型及加用利妥昔单抗四个因素,最终仅PD-L1阳性差异有统计学意义(P=0.006)。结果见表2。
3 讨论
近年来,随着大家对肿瘤微环境认识的提高,肿瘤免疫疗法兴起,PD-L1与PD-1作为重要的免疫负调控分子,尤受到大家的广泛关注。PD-L1/PD-1通路抑制T细胞的功能,使其丧失对肿瘤细胞的杀伤作用,降低IFN-γ、IL-2和IL-10的分泌,而由于CD4+T细胞的自分泌作用,此途径对CD8+T细胞的抑制作用更加显著[7]。肿瘤细胞通过此途径逃逸CTL的杀伤作用,减弱集体对肿瘤细胞的免疫应答,进而进一步影响患者疗效及预后。Muenst等[8]的试验中表明,乳腺癌患者病理组织中PD-L1的表达与年龄肿瘤大小,肿瘤分类,淋巴结状态,ER表达缺失等密切相关,在多元分析中,PD-L1表达仍是一个独立的不良预后因子。我们推断阻止此通路中两者的任一均可恢复宿主对肿瘤的免疫,目前已有试验表明在部分黑色素瘤,肺癌肾癌及膀胱癌患者中,阻断此通路取得了较好的疗效,能够显著延长患者的总生存期,副作用相对化疗药物较小。如应用PD-1抗体治疗非细胞肺癌患者,约20%~25%的患者获得客观缓解[9]。目前针对PD-L1/PD-1,FAD已批准数个单克隆抗体上市。确定哪些患者可以从免疫治疗中获益仍是一个重要的临床问题。
表2影响患者疗效的单因素与多因素logistic回归分析

项目单因素分析OR(95%CI)值P值多因素分析OR(95%CI)值P值年龄≥60岁0.353(0.121~1.036)0.058Ann Arbor分期0.126(0.033~0.483)0.002IPI评分0.123(0.038~0.401)0.001B组症状0.512(0.177~1.483)0.217体能评分>1分0.240(0.076~0.759)0.015LDH升高0.597(0.205~1.740)0.344结外受累>1处0.180(0.053~0.613)0.006PD-L1阳性0.157(0.049~0.506)0.0020.171(0.049~0.602)0.006DCBCL类型5.333(1.402~20.285)0.014加用利妥昔单抗4.257 (1.763~9.654)0.015
对于淋巴瘤患者,很多学者做了类似的试验,由于PD-L1在肿瘤组织中的表达的异质性,经典型霍奇金淋巴瘤及外周T细胞淋巴瘤常有PD-L1的高表达,而滤泡细胞淋巴瘤及Burkitt淋巴瘤PD-L1相对低表达。PD-L1的高表达对淋巴瘤患者临床特征及预后的影响也有相关文献报导,Paydas等[10]分析了87例HL患者石蜡病理组织中PD-L1的表达,表达阳性及阴性的患者OS及DFS差异明显,且差异具有统计学意义。在韩丽娟等[11]的研究表明,NK/T细胞淋巴瘤组织中PD-L1的表达水平与临床分期,LDH表达呈正相关,与临床疗效,IPI评分呈负相关。而对于弥漫大B细胞淋巴瘤的患者,有一项研究报道[6]PD-L1阳性患者占33%(以PD-L1阳性细胞/所有细胞>30%为阳性标准),PD-L1阳性与低CR率相关,PFS和OS低于PD-L1阴性患者。另一项研究[5]以PD-L1阳性细胞/所有细胞>20%为阳性标准,肿瘤微环境中PD-L1阳性表达的患者占15.3%,在多元分析后PD-L1阳性仍为独立的预后因子。本实验中PD-L1阳性的患者占所有患者的35.0%,结论与既往报导相仿。试验中所应用的免疫组织化学法是检测PD-L1在肿瘤组织中表达的主要方法,但仍有许多因素干扰,包括试验抗体的选取,操作步骤及读片,均增加了试验的难度。这也导致试验中的数据难以做到统一。
本实验结果表明,肿瘤病理组织中PD-L1的阳性水平与临床分期,IPI评分,LDH升高等临床特征无关,与疗效CR率呈负相关,表明PD-L1/PD-1通路对DLBCL患者疾病的发展及治疗有重要作用。因不同病理类型淋巴瘤PD-L1的表达存在异质性,仍需不断完善相关研究。但不同试验均表明,PD-L1是部分类别淋巴瘤患者预后的危险因素,这可能作为部分淋巴瘤危险分层指标和潜在治疗靶点。在弥漫大B细胞淋巴瘤中,有试验表明应用PD-1抗体治疗总反应率为近二分之一[12]。对于PD-1及PD-L1均阳性表达的病人,根据PD-1/PD-L1通路作用机制,PD-1抗体或者PD-L1抗体均可阻断通路并促进免疫恢复,PD-1抗体治疗有效已有实验验证,那么根据本实验初步推断PD-L1抗体也可提高患者治疗有效率,因此PD-L1抗体能否进一步完善将会是我们关注的热点,我们期待抗体应用范围逐渐扩大,为肿瘤患者带来更多的希望。

