马铃薯疮痂病研究进展
李 爽,杨美军,张 云,李婷婷,王振钰,曾 潆,韩玉珠
(吉林农业大学,吉林 长春 130118)
1 疮痂病的分布与危害
1.1 马铃薯疮痂病分布
马铃薯疮痂病(Streptomyces spp.)目前被视为世界上马铃薯重要病害之一,在美国[1-4]、日本、加拿大、韩国、芬兰、印度等马铃薯生产国均有报道。马铃薯疮痂病在中国马铃薯生产区普遍存在[5],各马铃薯生产区也均有相关报道。近年来,该病主要分布在河北[6-8]、甘肃[9]、四川[7,8]、贵 州[7,8]、 山 东[10]、 云 南[11,12]、 山 西[13]、 新 疆[14]、 陕西[15]、内蒙古[16]、黑龙江[17]、辽宁、吉林[18]等省、自治区。
1.2 马铃薯疮痂病危害
马铃薯疮痂病是由植物病原链霉菌引起的植物细菌性病害,可侵染马铃薯等多种植物。疮痂病菌属于放线菌科链霉菌属。可通过土壤和种薯等进行传播,该病主要侵染马铃薯块茎,可在其表面形成疮痂病病斑,使鲜薯外观变劣,布满疤痕,薯块质量和商品价值降低。疮痂病病原菌除侵染马铃薯外,对甜菜、萝卜等块茎类作物也会侵染。由于该病寄主不断增加,防治技术有限,该病已经成为世界种植业中重大疾病之一。
2 疮痂病病原菌研究概况
2.1 病原菌的分类
疮痂病病原菌多为链霉菌属,种类复杂,比较常见的病原菌包括Streptomyces turgidiscabies、S.scabies和S.acidiscabies[9]。此外还有几十种致病性病原菌被发现。1926年英国的Millard和Burr[19]将马铃薯疮痂病分为块茎表皮凸起、凹陷,表皮呈现出斑点、丘疹等不规则的疮痂病病斑;1953年瑞典学者Emilsson和Gustafsson[20]将马铃薯疮痂病分为块茎表皮粗糙,块茎表皮凹陷及凸起,普通疮痂四类;1991年Healy[21]将马铃薯疮痂病的症状共分为3个类型,分别为黄褐色疮痂,常见疮痂和酸痂,通常黄褐色疮痂又被称为折皱疮痂。后来依据马铃薯表皮凹陷程度将病斑分为凹陷型病斑、凸起型病斑和平状型病斑。
1890年,在美国康乃狄克州首次发现疮痂病菌的致病菌株,命名为Oospora scabies[22],后来又命名为Actinomyces scabies[23],最后将该菌株名字确定为Sreptomyces scabies[24]。该菌株具有螺旋形孢子链,灰色,表面光滑,培养基pH=5时适宜生长,产生黑色素[2]。
一般疮痂病病原菌在pH≈5的环境中不会被激发其致病性,但有一种疮痂病病原菌在1953年被发现,在pH=4.5的环境中马铃薯仍然可以被感染疮痂病,并且马铃薯被该疮痂病病原菌致病后表现出与S.scabies一样的疮痂病症状,1989年将该病菌定名为S.acidiscabies,该菌株具有直-柔曲状孢子链,培养基pH=4时适宜生长,孢子颜色会因培养基的不同而不同,表现出白色、黄色或红色,不能产生黑色素[3]。
1998年发现引起马铃薯凸状疮痂病病斑的致病性菌株,并命名为S.turgidiscabies,该菌株的孢子链是直-柔曲状,灰色,表面光滑,培养基pH=5时不能生长[25]。
国外研究者在马铃薯疮痂病病原菌种类方面做了大量研究。在美国报道的疮痂病病原菌有S.scabies、S.turgidiscabies、S.acidiscabies、S.europaeiscabiei等[1-4],芬兰疮痂病病原菌有S.scabies、S.turgidiscabies、S.aureofacoens等,韩国有 S.scabies、S.turgidiscabies、S.acidiscabies、S.puniciscabiei、S.luridiscabiei、S.niveiscabiei等,法国已报道的疮痂病病原菌有S.scabies、S.stelliscabiei、S.europaeiscabiei、S.reticuliscabiei等[5],加拿大的疮痂病病原菌有S.acidiscabies[26],新的致病菌种也在不断出现。国内的研究学者在马铃薯疮痂病病原菌的分类上也进行了大量研究,根据目前已有报道,甘肃疮痂病病原菌主要存在2种,分别为S.scabies和S.griseus,其中S.scabies为该地区优势菌种[7],河北有S.scabies、S.europaeiscabiei、S.diastatochromogenes等[6],黑龙江疮痂病病原菌有S.scabies、S.turgidiscabies、S.acidiscabies等[17],山西晋城疮痂病病原菌有S.scabies等[13],新疆主要存在2种疮痂病病原菌,分别为S.acidiscabies和S.scabies,S.acidiscabies为该地区优势菌种[14],其他地区病原菌种类需要进一步进行鉴定。
2.2 病原菌的致病性鉴定
疮痂病病原菌的致病性鉴定方法有很多,有盆栽试验、小薯片法、萝卜幼苗法、萝卜片法和幼薯检测法。盆栽试验是研究中使用较普遍的方法,一般参照Faucher等[26]的方法,该方法疮痂病菌株种类判断依据是新生薯块的发病情况。河北省刘伯[27]通过盆栽试验发现新的致病菌S.galilaeus具有致病性。病斑表现为凸起状病斑,细胞木栓化,病情严重的时候,马铃薯的皮下组织会褐色坏死、凹陷,产生黑色褐斑,致病力强于S.scabies。赵伟全[28]也采用了盆栽试验,发现马铃薯新生薯块可被10个省份的马铃薯疮痂病菌致病性菌株感染,产生典型的疮痂病病斑,但非致病性菌株则无影响。杜魏甫等[12]采用盆栽试验对云南地区的马铃薯疮痂病病原菌进行了致病性检测,从而得到,用一种病原菌对不同品种马铃薯所产生的疮痂病病斑的严重程度也不一样。甘肃省的康蓉和王生荣[29]同样采用盆栽试验发现分离到的菌株可以导致新生薯块产生疮痂病斑,说明此种病菌具有致病性。张海颖等[6]采用盆栽试验进行病原菌致病性检测,结果表明新鲜薯块能够被所有致病性菌株染病,表现出典型的疮痂病症状。
小薯片法和萝卜幼苗法在疮痂病病原菌的致病性检测方面效果也很显著,小薯片法多数参照Loria等[30]的方法,萝卜幼苗检测法参照Leiner等[31]的方法,杜鹃等[14]在用小薯片法检测致病性菌株时,结果发现为接种体可以被感染产生非常严重的褐色坏死病斑。同时也采用萝卜幼苗法检测,结果表现为幼苗的生长被致病性菌株抑制,2种方法表现出一致的效果。王丹等[13]采用小薯片法对山西晋城地区进行致病性菌株测定,7 d后菌株周围发现有轻微褐变,14 d后可观察到薯块上出现褐变和坏死。赵伟全[28]通过小薯片法和萝卜幼苗法对病原菌致病性进行了检测,2种方法表明致病性菌株均可以产生和病原菌相似的效果,其中小薯片法主要表现为接种点周围产生褐色坏死病斑,萝卜幼苗法则是对萝卜幼苗的生长产生一定的抑制,毒素、接种病原体、培养滤液三者都产生一定抑制效果,但毒素对幼苗的抑制效果更好。
幼薯检测法参照Lawrence等[32]的方法。信净净等[33]将S.galilaeus菌株CPS-2毒素R=0.38和R=0.47两条带组分采用小薯片法和幼薯法进行疮痂病不同毒素组分活性测定,结果发现,组分Ⅱ(分子量437.181)可以使薯块产生褐色坏死病斑,用显微镜观察可以发现细胞和淀粉粒周围发生褐色坏死,用此毒素接种幼薯,会发现薯块周围皮孔发生褐色坏死病斑,而组分Ⅲ(分子量313.1)没有产生任何变化,与清水对照相同,证明组分Ⅱ(分子量437.181)与病原菌相似,可以产生致病性毒素,组分Ⅲ(分子量313.1)可能只是参与了致病过程中的其他作用,但不能导致马铃薯发生病变。
2.3 致病性链霉菌的鉴定方法
疮痂病的病原菌适应能力非常强,当前的马铃薯品种对该病没有表现出很强的抗病能力,这对于马铃薯的生产是一种威胁,明确不同地区的疮痂病致病菌种类构成在马铃薯的发展中具有重要作用。对于马铃薯疮痂病致病性链霉菌分类的研究,Paradis等[34]采用化学分类的方法进行鉴定,该方法依据脂肪酸与蛋白质的特点;Faucher等[26]采用数值法对病原的分类进行鉴定,该方法的依据是菌株表现型的不同特征;DNA-DNA杂交法也是疮痂病病原菌种类鉴定中的一种,但此种方法表现的效果不是很理想[32],Jan等[35]和Song等[36]分别利用16S rRNA序列对芬兰和韩国的致病菌株进行鉴定,最后得到与形态学特征和生理生化特征表现一致的鉴定结果。
国外对马铃薯疮痂病的病原菌研究已经很深入,但中国对疮痂病的研究多数停留在防治方面[37-41]。目前国内部分研究学者对疮痂病的病原菌分类进行了研究。康蓉和王生荣[29]采用形态特征、生理生化特性测定和16S rRNA序列分析对来自甘肃的6株菌株进行了鉴定,结果表明,甘肃省内马铃薯疮痂病病原菌种类有S.scabies和S.griseus;王丹等[13]对山西晋城地区的疮痂病病原菌种类进行了鉴定,依据的方法是形态学观察、生理生化特性测定和16S rRNA序列分析3种鉴定方法,鉴定结果表明,S.scabies为该地区的疮痂病病原菌;张海颖等[6]依据菌株生物学特性和16S rRNA序列分析方法对河北省张北地区马铃薯疮痂病病原菌进行鉴定,结果表明,该地区存在3种病原菌,分别为S.scabies、S.diastatochromogenes和S.europaeiscabiei;杜鹃等[14]通过采用16S rRNA序列分析对新疆马铃薯疮痂病病原菌进行了病原菌种类鉴定,鉴定结果表明S.acidiscabies和S.scabies为该地区的病原菌,其中S.acidiscabies是该地区疮痂病的优势病原菌,致病力明显强于S.scabies。赵伟全[28]利用菌株的形态学特征、生理生化特性、16S rDNA序列和ITS方法对全国10个省区疮痂病病原菌进行鉴定,黑龙江病原菌为S.scabies;河北病原菌为S.scabies和一个未知病原菌;山西、陕西和内蒙古的致病性病原菌为未知病原菌;甘肃病原菌为S.scabies;山东病原菌为S.acidiscabies;四川、云南和贵州病原菌主要有S.turgidiscabies、S.aureofaciens和S.scabies。
DNA条形码技术在马铃薯疮痂病鉴定过程中也在被应用,DNA条形码技术是集分类学、遗传学和计算机科学于一身的技术,该技术利用基因组中存在的公认的、相对较短的DNA片断对物种进行鉴定。DNA条形码技术不但可以保证结果准确性,还可以提高检测效率。该技术在国内细菌方面研究很少,黑龙江省魏琪等[42]利用DNA条形码技术鉴定检测到了S.scabies,但还未检测到马铃薯其他疮痂病病原菌。
3 疮痂病病原菌的致病机制
马铃薯疮痂病是由多种病原菌引起的,虽然病原菌寄主范围广,但致病机制相似。疮痂病的致病因子存在染色体中被称为致病岛(Pathogenicity island,PAI)的区域,该区域的特点是可以水平移动到链霉菌属的其他种中,从而产生新的致病性菌株。第1个被发现具有PAI革兰氏阳性病原菌的是S.turgidiscabies。该菌的PAI区域中含有txt A基因、txt B基因、txt C基因、坏死诱导蛋白nec1基因和致病性因子tom A基因,这些基因与致病毒力相关。S.scabies的染色体中也存在txt A、txt B、txt C、nec1和tom A。遗传分析表明S.acidiscabies和S.turgidiscabies是PAI基因簇从S.scabies致病性菌中转移到腐生性菌中的产物。PAI基因簇的转移使腐生性链霉菌具有致病性。赵伟全[28]采用萝卜幼苗法和薯片法对中国马铃薯疮痂病病原菌进行了产毒的研究,发现不同种类疮痂病病原菌可以产生相似的毒素,只是产毒能力不同,此结果与Loria等[30]的研究结果相同。
txt A、txt B是毒素Thaxtomin的合成酶基因,是控制马铃薯疮痂病病原菌毒素生物合成的基因,也决定疮痂病菌株是否具有致病性。把Thaxtomin的合成酶质粒引入到txt A突变体中,突变体能够恢复本来原有的致病性并且产生Thaxtomin A,说明Thaxtomin A在致病性菌中起到非常重要的作用。在细胞中,Thaxtomin A主要作用于细胞膜,对细胞膜体系产生破坏作用,最后导致细胞质壁分离。疮痂病的病原菌毒素通过影响植物代谢过程和能量变化导致细胞膜透性增加。致病毒素产生作用的现象就是增加细胞膜透性。在低浓度的情况下,Thaxtomin A对幼苗的生长产生抑制作用,并因为Thaxtomin毒素可以使细胞异常膨大从而使幼苗根部和芽部径向膨大。但细胞数目没有增加,只是引起细胞的膨大而已;在Thaxtomin A高浓度的情况下,抑制细胞的生长和膨大,导致幼苗被杀死。Thaxtomin对马铃薯幼苗的影响与块茎上的作用是相似的,细胞的异常膨大致使形成凸状病斑,毒素会使细胞死亡,导致形成凹状病斑[17]。Goyer等[43]用S.scabies产生的Thaxtomin A对成熟的薯块进行处理,通过对细胞形态和超微结构进行观察,发现薄壁组织细胞中的原生质膜与细胞壁可以被毒素导致分离,最终细胞被裂解。也有研究提出Thaxtomin A能够抑制植物纤维素的合成并且引起植物细胞程序性死亡。
nec1是Thaxtomin的致病基因,S.scabies和S.turgidiscabies等中都有nec1基因的存在。nec1基因位于PAI中,尽管该基因在寄主和病原菌的互作上所起到的作用还处于研究阶段,但Bukhalid等[44]认为该基因在马铃薯和链霉菌的互作方面起着重要作用。在薯片上,nec1能够使非致病性菌S.lividans产生坏死并定殖。将nec1基因敲除,并不影响S.turgidiscabies合成Thaxtomin。nec1基因与链霉菌属中的染色体DNA相比,G+C的含量非常低,由此得出nec1基因来自于其他属中[17]。
tom A是合成Tomatinase的基因,Tomatinase在茄科作物的病原真菌中是一种良好表征的酶。信净净[45]采用质谱分析方法,结果发现S.galilaeus菌CPS-2产生的2个毒素与国外报道的Thaxtomin A的分子量相近并且性质相似,从而可以确定为同种毒素。研究中得到至少有2种毒素在S.galilaeus的致病过程中起作用。
高浓度的毒素可以抑制植物生长,浓度越高抑制萝卜幼苗生长效果越明显。毒素浓度较低促进细胞分裂。马铃薯上产生的凸起病斑的主要原因是细胞增生,侵染后期过程中,高浓度的毒素会使细胞死亡,导致病斑木栓化,当木栓化组织发生脱落而导致深坑出现。致病毒素对疮痂病的典型症状起主导作用,但毒素不会对表皮已经发生木栓化的马铃薯产生破坏,马铃薯变成熟,对毒素的抵抗能力也增强,致病菌在马铃薯生长后期便不能侵染[28]。马铃薯被疮痂病菌侵染程度受植物细胞完整性和马铃薯成熟度的影响,未成熟的马铃薯受侵染程度要强于成熟的马铃薯。也有研究者报道酯酶是导致产生疮痂症状的可能因素[46]。在病菌致病过程中分解马铃薯表皮细胞的酯酶起重要作用,但疮痂病病原菌的酯酶基因表达稳定性较差,相关研究还处于初级阶段。
4 品种资源及抗病性
病害发生程度受多方面因素的影响,为了有效地防止马铃薯疮痂病的发生,可以选育具有抗疮痂病的品种进行栽培。防治疮痂病最为理想和有效的办法之一是培育抗病品种。明确马铃薯品种和病原菌之间的相互作用,与病原菌的分布结合可以对马铃薯品种合理布局,以及马铃薯抗疮痂病的基因研究工作提供准确和可靠的依据。相关报道指出,容易感病的品种为白皮或薄皮品种,抗病品种为褐色或厚皮品种。
国外在马铃薯疮痂病抗性评价方面做了大量的研究,中国在这方面的研究尚少。Wanner和Haynes[47]用不同种与不同分子类型的链霉菌对马铃薯进行接种试验,结果表明,优势种或菌株的不同导致在不同的地区疮痂病发生的严重程度也不同。Haynes等[48]研究发现环境、基因型、环境和基因型互作对病斑面积和病斑类型有显著影响。
国外在马铃薯抗性品种筛选方面也做了大量研究,并且已有抗病品种方面的相关报道,国外很多抗病品种被研究者们首次发现(表1)。
目前国内关于抗疮痂病品种方面的研究较少,邢莹莹[17]通过盆栽接种法筛选得到高抗品种‘克新18号’;杜魏甫[11]通过盆栽接种法筛选得到中抗品种‘紫云1号’和‘靖薯1号’。
5 防治措施研究进展
5.1 农业防治
选择无病薯块是防治疮痂病的有效农业防治措施之一。选择保水性好的土地进行种植,特别是秋马铃薯应该加强水分管理,要保持土壤湿润,可以有效减轻发病。除甜菜、萝卜、胡萝卜等根菜类外,可以与其他作物进行轮作,如与葫芦科,百合科等作物实行4~5年轮作。农业防治在与其他防治方法结合的情况下可以达到更好的防治效果。
基质消毒可以降低马铃薯原原种疮痂病的发生,龙国等[54]采用对基质进行熏蒸消毒试验。研究发现每1 m3基质施用多菌灵25 g+杀毒矾25 g+敌克松25 g+辛硫磷40 g+硫磺粉60 g的处理效果最好,此处理不但对原原种的连作基质熏蒸消毒效果最好,而且病薯率低,产量高。
基质种类和配比不同也可以降低马铃薯微型薯疮痂病的发病率。赵萍等[55]采用基质配比不同的方法,研究发现,马铃薯微型薯疮痂病感病率最低的配比为糖醛渣与原网棚内的土比例为1∶1;全为原棚内的土感病率最高。含有糖醛渣的基质发病率低,降低染病的薯块数量,同时也降低了薯块的染病程度。当糖醛渣pH为4~5时抑制了疮痂病的发生,提高了健康薯率。白晓东等[56]在微型薯疮痂病防治方面发现蛭石∶火山石∶火炉渣∶草木灰∶糖醛渣的比例为1∶1∶1∶1∶1的配比情况下对预防微型薯疮痂病的发生效果较好。为防治病原菌,最好每种一茬更换一次基质,对马铃薯的产量和品质都是一种保障。
微生物有机肥是一种新型肥料,其中含有多种有益的拮抗微生物,对作物连作障碍有缓解的功效,将有机肥与化肥的优点集于一身。施用微生物有机肥对疮痂病起到一定防效,研究者在这方面做了相关的研究。靳海波等[57]研究表明,施用有机肥GSJ-1后疮痂病病情指数较连作马铃薯疮痂病病情指数下降至19.3%,对疮痂病的防效达到45.3%,说明微生物有机肥能够有效减轻由于马铃薯连作导致的疮痂病的发生。时新瑞等[58]研究表明,配方CJ-1对马铃薯疮痂病防治效果显著高于配方CJ-2,并且利用甲托加百菌清和石膏粉进行播前拌种对马铃薯疮痂病防治效果显著。
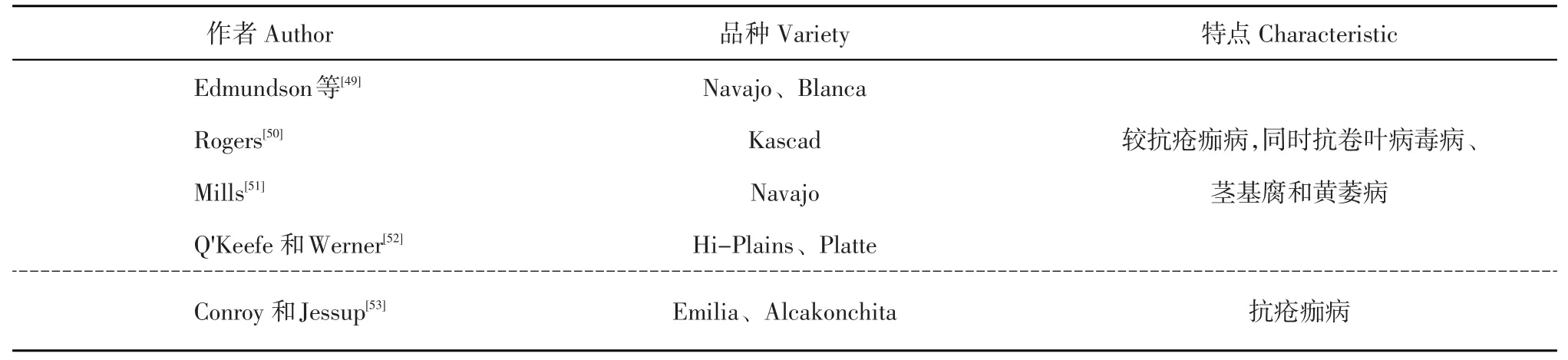
表1 国外马铃薯抗疮痂病品种及特点Table 1 Foreign potato variety common scab resistance and characteristic
杨忠和任月梅[37]的研究表明浇水次数对马铃薯微型薯疮痂病的发生有显著影响,在山西大同地区浇水次数间隔4 d为最适天数,疮痂病病情指数显著降低,生产数量又多。
5.2 植物生长调节剂防治
植物生长调节剂也是现在常用的防治疮痂病的方法,通过植物生长调节剂对马铃薯植株本身进行抗性诱导,来提高马铃薯植株的抗病性。众多研究者在植物生长调节剂防治疮痂病方面做了大量的研究。
周芳等[59]研究结果表明,喷施2,4-D对马铃薯疮痂病有一定的防治作用,但要浓度适宜,2,4-D对植物生长有一定的抑制作用。当喷施浓度为6.25 mg/L时,对植株抗疮痂病效果最好,产量最高,从而可以得到,喷施适宜浓度的2,4-D不仅不会对马铃薯造成药害,还可以防治马铃薯疮痂病,提高产量。汤晓莉等[39]研究表明,利用外源水杨酸(Salicylic acid,SA)降低叶片中超氧自由基和丙二醛(MDA)的含量也可提高马铃薯抗疮痂病的能力。诱抗剂BTH(Benzothiodiazole)可以诱导与防卫有关的基因表达,植物的抗病防御反应被激活,从而提高植物的抗病性。龚秀会等[60]研究结果表明,BTH的浓度在1.00 mmol/L时对疮痂病的防治效果最好。
5.3 化学防治
药剂防治是马铃薯疮痂病防治的主要措施,但对周围环境会造成一定破坏。播种前将种薯用40%福尔马林200倍液浸种2 h后晾干再切成块播种。可选用72%农用链霉素可溶性粉剂5 000倍液、新植霉素(100万单位)5 000倍液、45%代森铵水剂900倍液、47%春雷·王铜可湿性粉剂600倍液、77%氢氧化铜可湿性粉剂600倍液等喷雾,每隔7~10 d喷1次,连喷2~3次[61]。
由于化学防治见效快,在生产中施用最为普遍,众多研究者在这方面做了大量的研究。卞春松等[62]利用必速灭颗粒剂对马铃薯疮痂病的防效进行了研究,结果表明必速灭对微型薯疮痂病有较好的防治效果,感病率能够下降至少20%;张露等[63]发现对播种垄沟中薯块喷施1 000倍液氟啶胺药剂可以对疮痂病产生非常好的防治效果,发病等级达到0级,但是降低了块茎产量和品质。郭海英等[64]采用药剂浸种方法对马铃薯种薯防治效果进行了研究,发现1%对苯二酚组合对马铃薯进行浸种处理,对马铃薯种薯防治效果和出苗情况都很有益。苏军[65]研究表明50%春雷霉素·王铜可湿性粉剂在马铃薯疮痂病防治应用中是安全的,防治效果好,增产率高。
施用石灰等碱性肥料,容易导致土壤盐碱化,微碱性土壤能够加重疮痂病的发生。在pH为5.2以下的土壤环境中马铃薯很少发病,但在强酸性的环境中,会降低植株的长势和结薯数量。杨鑫等[66]研究表明,300倍的醋酸稀释液(pH≈4.48)对马铃薯疮痂病的防治效果最好,稀释倍数越高,防治效果越不理想,这与疮痂病致病链霉菌喜碱性有一定的关系,降低土壤的pH值从而抑制了疮痂病菌株的繁育。
此外,一部分研究者也进行了生物防治研究,刘大群等[67]、Kobayashi等[68]在生物防治方面进行了研究,发现拮抗链霉菌对疮痂病菌有很好的防治效果;Meng等[69]发现解淀粉芽孢杆菌BAC03可以有效防治疮痂病;高同国等[70]研究发现解淀粉芽孢杆菌对马铃薯疮痂病有明显的拮抗作用,为在防治马铃薯疮痂病生物方面的研究奠定了基础。在农业生态系统中,生物防治对植物的微生物环境起到一定的调节,安全持效,但目前生物防治的效果并不是很理想,暂时只能作为一种辅助控制措施。
6 存在问题与发展前景
马铃薯疮痂病目前是全世界都比较关注的问题,受多方面因素的影响,其危害马铃薯块茎表面,对马铃薯生产有严重影响。国外在马铃薯疮痂病抗病品种方面的研究比较深入。虽然目前国内对马铃薯疮痂病的病原菌致病机制方面研究较深入,但在抗病品种鉴定与评价方面研究很少。以后在马铃薯抗疮痂病育种方面,抗病种质资源筛选鉴定与优异抗源材料聚合的研究要尽快展开;研究苗期快速鉴定疮痂病的方法,以尽快选择抗疮痂病的品种,及早对感疮痂病的马铃薯品种采取防治措施;努力探索抗性基因,通过马铃薯疮痂病菌与抗性基因间的互作特点,对马铃薯抗疮痂病品种进行抗性评价;对抗源基因进行合理应用,为以后培育抗疮痂病的马铃薯品种在亲本选配和杂交后代筛选工作中奠定基础。

