3种评分工具对缺血性卒中伴心房颤动患者1年死亡风险评估的验证
李姝雅,赵性泉,2,刘丽萍,3,王春雪,4,刘改芬,王伊龙,王拥军
准确预测缺血性卒中患者早期不良预后和死亡风险可以更好地制定医疗决策,有效分配医疗资源。近10年来,随着大型高质量队列研究的逐渐发展和完善,研究者们提出了多个由不同危险因素组成的预测缺血性卒中患者风险评估的预测模型。缺血性卒中风险预测评分(ischemic stroke predictive risk score,IScore)作为不伴心房颤动的缺血性卒中患者1年死亡模型,在内部验证和外部验证中都得到了良好的预测效度,但操作略微烦琐[1]。住院前合并症、意识水平、年龄和局灶性神经功能缺损(preadmission comorbidities,level of consciousness,age,and neurologic deficit,PLAN)评分改进IScore,去掉了性别、卒中分型、实验室指标(血糖)和行为学因素(吸烟)等四项危险因素,增加了意识障碍一项危险因素,操作更简便[2]。瑞士洛桑卒中登记研究提出了用于预测缺血性卒中患者3个月不良预后风险的洛桑卒中量表(acute stroke registry and analysis of Lausanne,ASTRAL)[3]。IScore(C=0.82)和ASTRAL评分(C=0.81)已在中国国家卒中登记(China National Stroke Registry,CNSR)数据库的缺血性卒中患者中进行了验证,预测效度良好[4-5]。伴心房颤动的缺血性卒中患者预后差,死亡风险高,判断其预后结局对临床治疗决策的制定和医疗资源的分配意义重大。目前尚无针对心房颤动患者死亡风险的预测模型报道。基于上述考虑,本研究将IScore、PLAN评分和ASTRAL评分在CNSR数据库缺血性卒中伴心房颤动的患者中进行验证,评价各评分的预测能力,力图在现有资源中分辨出判断伴心房颤动的缺血性卒中患者死亡风险的最佳预测模型,优化临床决策。
1 研究对象与方法
1.1 研究人群与入排标准 本研究人群来自CNSR研究数据库。研究数据库背景及患者选择已发表[6]。本研究人群筛选流程见图1。
1.2 心房颤动诊断标准 符合以下条件之一的患者即诊断患心房颤动:①既往诊断为心房颤动伴至少有1张心电图(electrocardiogram,ECG)证实心房颤动心律,或已经开始服用相关药物;②首次ECG或者住院期间复查ECG示心房颤动心律,并确诊。
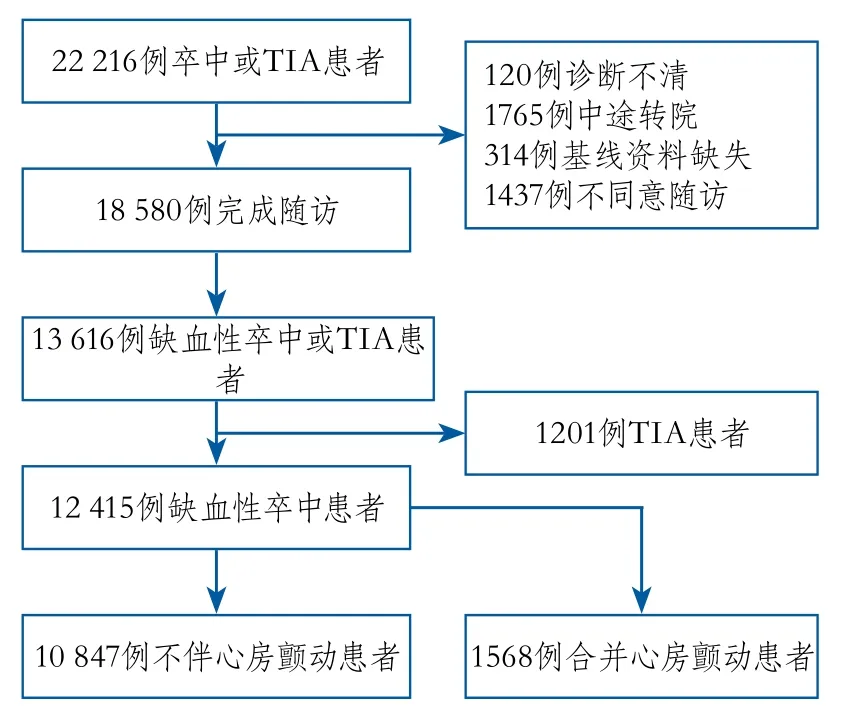
图1 研究人群筛选流程
1.3 主要评价指标 1年随访时卒中复发(包括非致死性卒中和致死性卒中复发);1年随访时死亡(包括全因死亡和卒中相关性死亡)。
1.4 质量控制 整个登记研究由专业的第三方监察公司定期电话或现场质量监察来保证数据的完整性及真实性。由专业的数据录入公司对数据进行盲法双录入。数据导入到SAS统计软件,通过设定合理区间进行数据清理,并对两个数据库进行有效性核查,封库后进行统计学分析。
2 结果
2.1 缺血性卒中伴或不伴心房颤动患者基线资料比较 本研究人群中,伴心房颤动患者平均年龄,女性比例,同时患有心衰、冠状动脉粥样硬化性心脏病、周围血管病的比例明显高于不伴心房颤动患者,比较差异均有统计学意义(P<0.01)。伴心房颤动患者入院时美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分是不伴心房颤动患者的2.75倍,而住院总花费是不伴心房颤动患者的1.25倍(表1)。
2.2 评分工具风险分层及终点事件发生率 本研究结果显示中国缺血性卒中患者1年全因死亡的事件发生率为13.4%,伴心房颤动患者的1年死亡率为34.6%,不伴心房颤动患者的1年死亡率为10.3%。根据各评分工具的风险分层计算各分层的事件发生率,可以看到事件发生率随着风险分层的升高而逐渐增加。伴心房颤动患者各风险分层的事件发生率高于不伴心房颤动患者(图2)。
2.3 评分工具预测效度在伴和不伴心房颤动患者中的比较 3种评分工具对于中国缺血性卒中患者1年死亡风险都有较高的预测能力,在伴心房颤动人群中同样具有较高的预测能力(表2)。
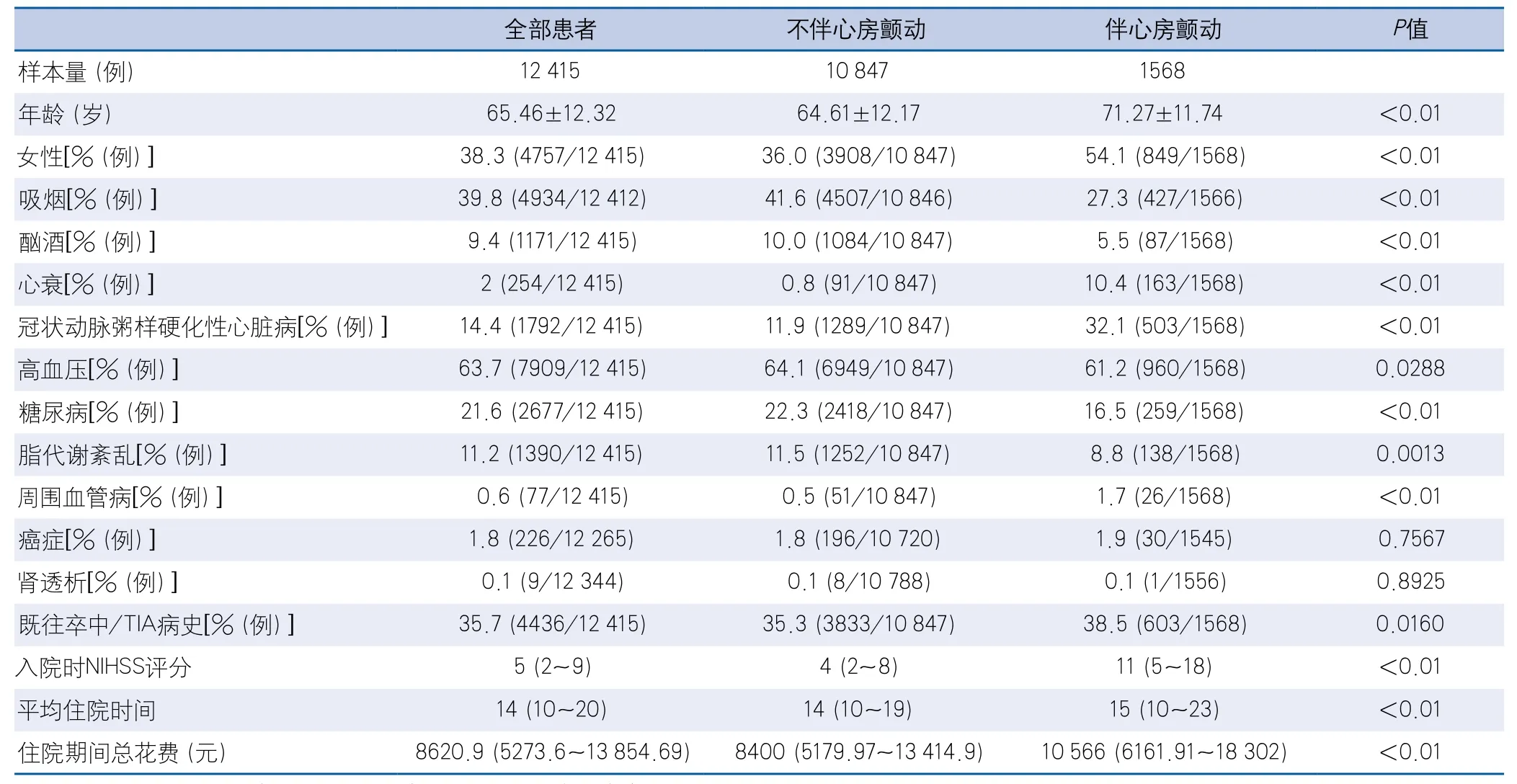
表1 缺血性卒中伴或不伴心房颤动患者基线资料比较
3 讨论
目前国际上尚无一个统一的判断缺血性卒中患者死亡预后的评价工具,分析原因有二:第一,缺血性卒中患者因发病机制不同,影响预后的危险因素存在差异,导致各评分工具的危险因素组成结构不同;第二,建立模型的人群特点不一,多因素分析得到的危险因素比值比大小不一,导致各评分工具对危险因素的赋值不同。本研究结果提示IScore、PLAN评分及ASTRAL评分适用于中国缺血性卒中患者,与其产生队列的C值基本一致,对于伴心房颤动的患者同样具有良好的预测能力。
死亡风险评分工具通过对危险因素进行赋值,计算总分判断患者预后。年龄和NIHSS评分是3种评分工具均包括的危险因素。年龄是卒中患者不良预后的危险因素已被多次证实[7-8]。IScore将年龄视为连续变量,每增加1岁,增加1分。PLAN评分每10岁增加1分,ASTRAL评分定义每增加5岁增加1分。一项加拿大的多中心队列研究提出80岁及以上的卒中患者死亡率较高,且康复回家的概率较低,老年卒中患者更应得到专业的照顾[9]。跟着指南走(get with the guidelinesstroke,GWTG-Stroke)研究得出在院死亡的独立危险因素包括卒中严重程度、年龄、女性、周末或夜间到院、心房颤动、心肌梗死病史、周围血管病和糖尿病。NIHSS评分本身即可很好地预测不良预后(C值0.83)[10]。IScore和ASTRAL评分直接纳入NIHSS评分,PLAN评分将NIHSS评分中的组成元素肢体无力作为危险因素,在评分中给予赋值,充分体现了NIHSS评分对死亡结局预测的重大贡献。
急性缺血性卒中患者有21%~44%合并糖尿病[11-12]。有研究将糖尿病与其他危险因素独立存在视为卒中的重要危险因素,发现2型糖尿病患者发生卒中的时间较非糖尿病患者要早10年[13]。CNSR研究结果提示糖尿病是缺血性卒中患者6个月死亡或致残的独立危险因素[14]。糖尿病作为危险因素被纳入心房颤动患者卒中风险分层工具[15-16],本研究结果提示包括急性期血糖升高的IScore和ASTRAL评分较未包括血糖因素的PLAN评分整体预测能力稍高。

图2 3种评分工具预测1年死亡的风险分层及终点事件发生率
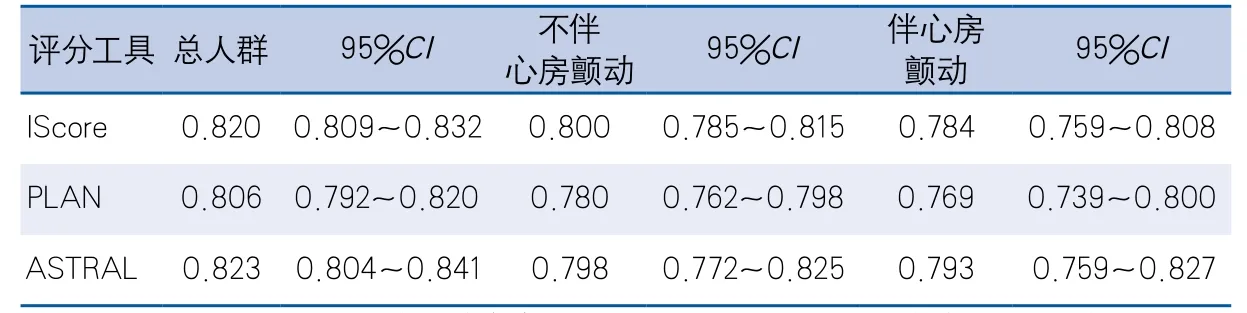
表2 3种评分工具预测死亡的C值比较
本研究存在一定局限性。首先,本研究验证了3种评分工具,为达到研究人群的统一,全部选用缺血性卒中患者作为研究人群,未纳入短暂性脑缺血发作患者,所有患者未区分是否接受抗血小板治疗,研究人群统一造成的对于各评分风险分层的事件发生率及评分工具预测能力的影响不可避免。其次,由于数据库中影像学及分子标志物信息收集不全,导致影像学及分子标志物相关的不良预后风险模型无法在本研究中得到验证。
【点睛】IScore、PLAN评分和ASTRAL评分可对缺血性卒中伴心房颤动患者1年死亡风险进行初步分层,优化临床决策。

