基于高分辨率磁共振成像的氯吡格雷和阿司匹林治疗症状性颅内动脉狭窄患者1年的疗效观察
李媛,边洋,刘建国,戚晓昆,王占军,王玮,邱峰
中国脑血管病负担非常重[1],缺血性脑血管疾病的主要原因是症状性颅内动脉狭窄(intracranial artery stenosis,IAS),尤其是大脑中动脉(middle cerebral artery,MCA)狭窄,几乎占中国患者的一半[2]。随着高分辨率磁共振成像(high-resolution magnetic resonance imaging,HR-MRI)技术的发展,临床诊断症状性IAS的患者大大增加。在华法林-阿司匹林治疗症状性颅内动脉疾病试验(Warfarin-Aspirin for Symptomatic Intracranial Disease,WASID)研究中,症状性MCA狭窄患者缺血性卒中2年复发率是19%[3]。口服抗血小板药物如阿司匹林和(或)氯吡格雷是IAS患者预防卒中复发的有效方法。目前针对血压、血糖、血脂控制在正常范围内的患者,国内外尚无氯吡格雷与阿司匹林治疗症状性IAS患者的对比研究数据,两种药物对IAS和斑块易损程度的影响数据亟待完善。本研究筛选症状性IAS患者,并采用HR-MRI观察氯吡格雷和阿司匹林药物治疗1年前后颅内动脉粥样斑块的变化,对比上述两种药物对IAS患者的卒中再发风险、不良反应及服药依从性,旨在指导症状性IAS患者合理使用抗血小板药物,降低卒中再发风险。
1 研究对象与方法
1.1 一般资料 选取2016年8月-2017年8月患者40例,其中男23例,女17例,年龄40~75岁,高血压33例,2型糖尿病29例,高脂血症32例。
1.2 入选标准 ①筛选MCA粥样硬化性狭窄的患者;血压控制在140/90 mm Hg以下;血糖控制在空腹全血血糖3.9~6.1 mmol/L,餐后血糖≤7.8 mmol/L,糖化血红蛋白4.2%~6.4%;低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平≤70 mg/dl(1.8 mmol/L);磁共振血管造影(magnetic resonance angiography,MRA)或计算机断层扫描血管成像(computed tomography angiography,CTA)初筛证实MCA M1段存在管腔狭窄50%~79%,经颅多普勒超声[MCA:收缩期峰值血流速度(Vs)>160 cm/s,平均血流速度(Vm)>100 cm/s]进一步证实MCA M1段存在管腔狭窄50%~79%[4-6],同时通过HR-MRI证实MCA M1段≥1处动脉粥样硬化性斑块。②无服用抗血小板药物禁忌。
1.3 方法所有入院患者均由1名神经内科专科医师确诊,随机将患者分为氯吡格雷组(20例)和阿司匹林组(20例),两组均给予相同的卒中基础治疗。氯吡格雷组给予硫酸氢氯吡格雷片(深圳信立泰药业股份有限公司,每片25 mg)75 mg口服1次/日,阿司匹林组给予拜阿司匹林肠溶片(拜耳医药保健有限公司,每片100 mg)100 mg口服1次/晚。严格按照中国缺血性卒中和短暂性脑缺血发作二级预防指南(2014)对入组患者进行规范化治疗1年[7],每3个月进行1次门诊随访。所有入组患者在第0、3、6、9、12个月时监测血压,化验血常规、生化、糖化血红蛋白及凝血功能,进行简易精神状态量表评分。达标标准同入选标准。在随访期间如有血压或实验室生化指标未达标者,视为病例脱落,药物治疗1年后对各项指标达标的患者进行HR-MRI检查。
通过HR-MRI对比加权黑血技术对比两组患者治疗前后管腔狭窄程度的百分比变化和易损斑块的变化,比较IAS患者服用上述两个药物的缺血性卒中复发率和药物不良反应发生率,以及患者对两组治疗药物的依从性。
管腔狭窄及易损斑块变化评定:(1)MRI检查:采用3.0T磁共振成像系统(HDX platform,GE Healthcare,Milwaukee)和8通道头颅线圈。扫描序列包括:①颅内血管的三维时间飞跃法磁共振血管成像(three dimensional time of flight magnetic resonance angiography,3D-TOF MRA),为后续MCA的管壁扫描定位;②双侧MCA管壁的HR-MRI,扫描方向垂直于M1段;③对比剂钆喷替酸葡甲胺经高压注射器给药,间隔1 min后启动T1加权成像(T1-weighted imaging,T1WI)增强序列扫描。(2)分析MRI图像:①根据3D-TOF MRA计算MCA狭窄程度(WASID法)[8],管腔狭窄程度百分比(%)=[(1-管腔面积)/参考管腔面积]×100%[9]。②对MCA的动脉粥样硬化斑块进行形态学分析:在T1WI、T2WI及3D T1自旋回波序列(3D T1-weighted sequence of volumetric isotropic turbo spin echo acquisition,3D T1VISTA)图像上将斑块分为4类:等信号斑块、高信号斑块、低信号斑块和混杂信号斑块。然后进行定量测量:利用CMRtools软件(Cardiovascular Imaging Solutions Ltd,UK)在T2WI图像中手动勾画最狭窄处的管腔和管壁边界,计算斑块负荷,斑块负荷=(管壁总面积-管腔面积)/管壁总面积×100%;同时将3D T1VISTA管壁强化部分的平均信号强度作为斑块的信号强度,计算斑块强化率。斑块:局限性的偏心管壁增厚,最厚处超过管壁最薄处1.5倍以上。①斑块纤维帽;②脂质核心;③出血[9-10];④钙化(图1、图2)。
缺血性卒中复发评定:首次脑梗死发病后原有症状痊愈或好转后,再次出现新的体征或原有症状加重,经头颅MRI检查提示有新发病灶或原有病灶扩大[11]。
药物不良反应判定:主要指胃肠道反应(包括上腹部烧灼感、恶心、呕吐、腹泻等症状)和颅内外出血(指脑出血、消化道出血、鼻出血、皮下出血等)[12]。
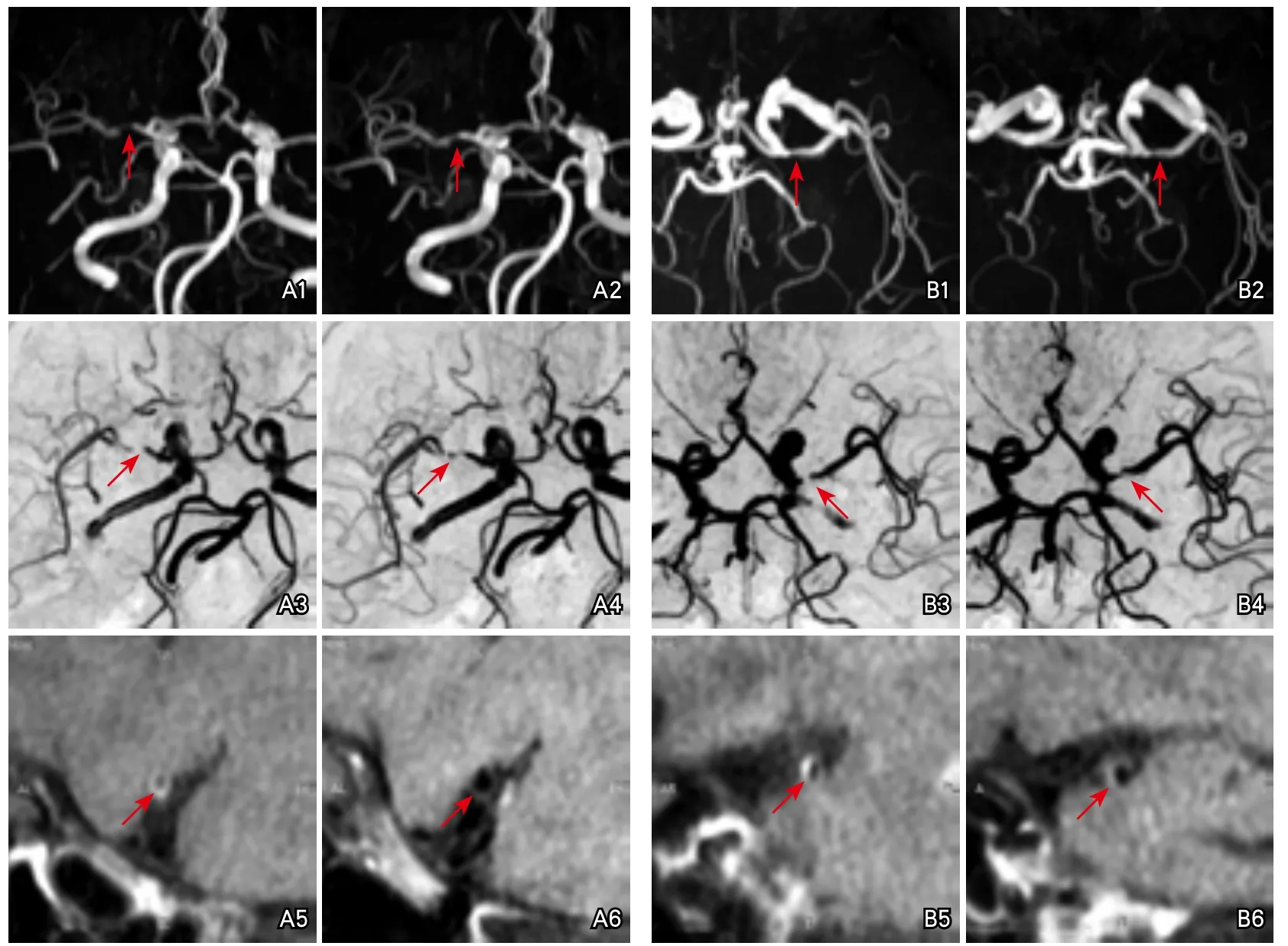
图1 阿司匹林治疗前后头颅磁共振对比
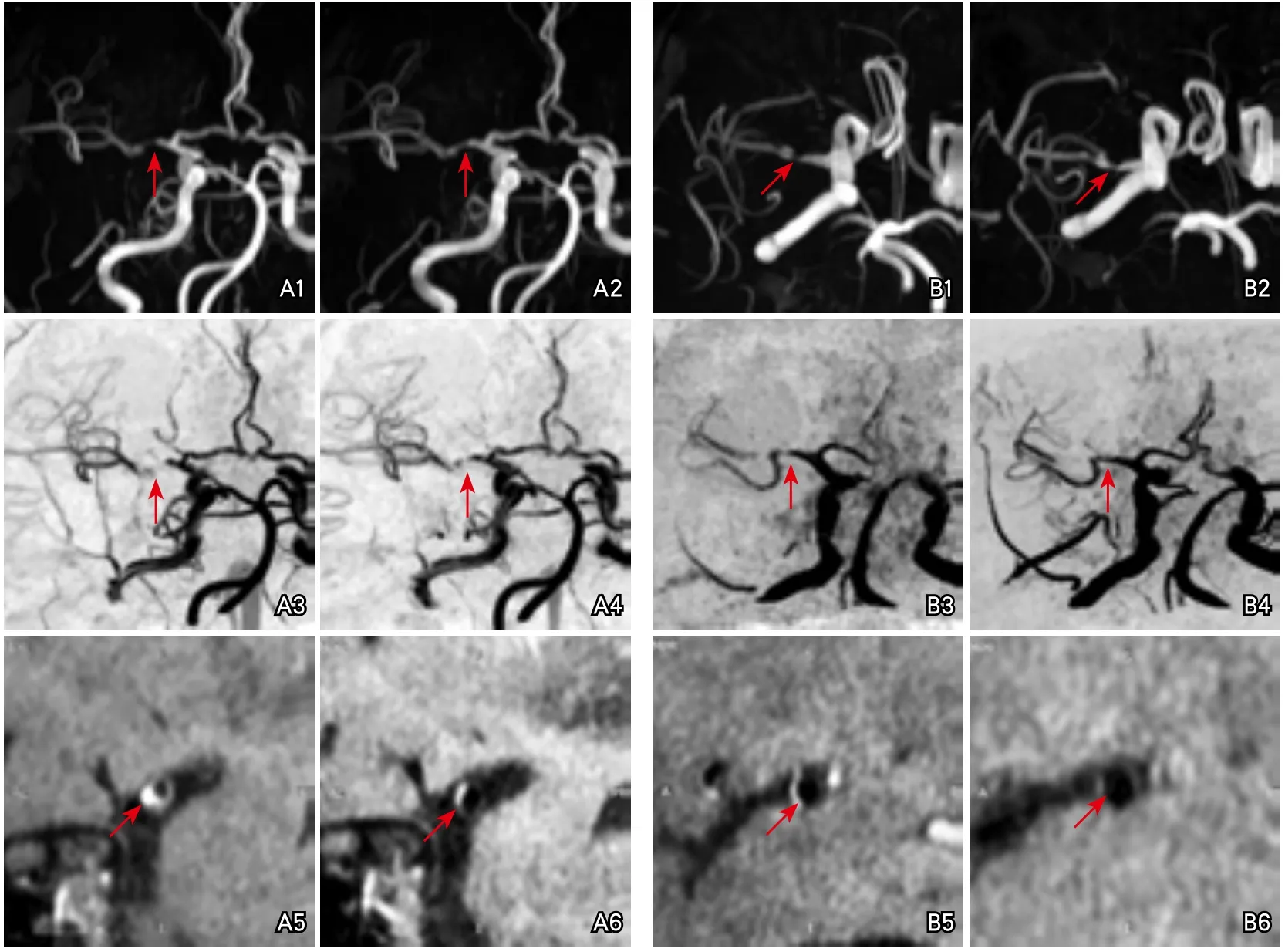
图2 氯吡格雷治疗前后头颅磁共振对比
药物依从性判定:是否按医嘱用药,包括服药次数、剂量以及时间是否改变。以上问题存在1个以上“否”回答即为依从性差,反之则为依从性好[13]。
1.4 统计学处理 应用SPSS 15.0统计软件进行统计分析,计量资料采用表示,组间比较采用t检验,计数资料采用χ2检验,若总例数<40,采用Fisher确切检验,若存在单元格期望频数<5时,采用连续校正χ2检验,P<0.05认为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较 两组患者年龄、性别、高血压、糖尿病、外周动脉疾病史、吸烟史、既往短暂性脑缺血发作或脑梗死病史等比较,差异均无统计学意义(表1)。
2.2 两组患者颅内动脉粥样硬化进展情况(管腔狭窄程度的变化百分比、易损斑块负荷、强化率变化和斑块在MRI上的形态学表现),卒中复发率,不良反应发生率和服药依从性比较 随访1年,两组患者的管腔狭窄程度、易损斑块负荷和斑块强化率均较治疗前有明显改善(F=333.331,981.411,2233.367,P<0.001),但组间比较差异无统计学意义(表2、表3)。
氯吡格雷组卒中复发率为10%(2例),阿司匹林组为11.1%(其中1例因消化道出血,1例因皮下紫癜换用其他药物,纳入统计复发率例数为18例),两组比较差异无统计学意义。氯吡格雷组1例出现胃肠道反应,阿司匹林组1例出现消化道出血,1例结膜出血,2例皮下出血,2例鼻出血,2例胃肠道反应,氯吡格雷组不良反应发生率为5%,阿司匹林组为35%,两组不良反应发生率比较,差异有统计学意义(χ2=3.906,P<0.05)。氯吡格雷组有2例(10%)停药,阿司匹林组有8例(40%)停药,氯吡格雷组服药依从性要高于阿司匹林组,比较差异有统计学意义(χ2=4.800,P<0.05)。
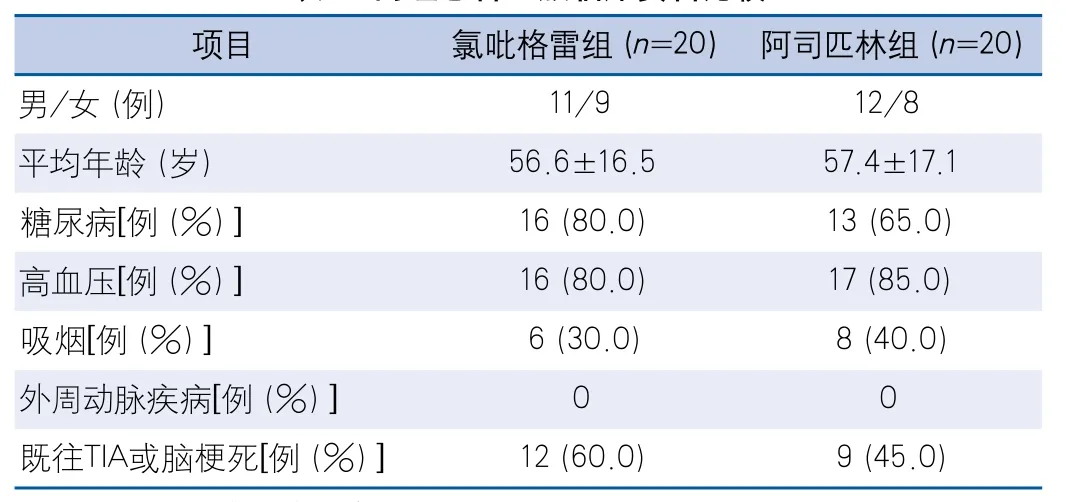
表1 两组患者一般临床资料比较
3 讨论
研究表明,IAS是我国缺血性脑血管病的主要病因,其与同侧缺血性事件的发生独立相关[14],严重影响患者生活质量且预后不良。因此IAS的早期发现、预防及控制有重要意义。HR-MRI技术能早期识别颅内动脉粥样硬化狭窄的病理变化,清晰显示IAS程度及管壁成分[11,15],Chang-Woo Ryu等[16]发现在评估MCA的狭窄程度时,由HRMRI所检出的狭窄程度与数字减影血管造影的结果具有很高的一致性。多项随机对照研究结果显示,对于非心源性缺血性卒中患者均推荐使用抗血小板药物降低卒中复发[17-18]。其中阿司匹林临床应用较为广泛,对预防卒中复发疗效明确,但由于具有一定的不良反应,影响患者依从性。氯吡格雷近年来在缺血性脑血管病二级预防中取得了一定的循证医学数据,有研究表明氯吡格雷还具有稳定斑块作用[12],可以改善血管狭窄程度和易损斑块破裂程度,因而在卒中预防上具有很大的选择性。但针对颅内动脉狭窄患者的抗血小板药物选择上,哪种更具有优势,目前缺少相应的证据。
本研究经过1年随访,通过HR-MRI筛选症状性IAS患者,发现氯吡格雷的疗效与阿司匹林相当,虽然氯吡格雷和阿司匹林均存在胃肠道反应,但氯吡格雷的不良反应发生率低于阿司匹林,与既往的研究结果类似[19]。有研究结果显示,氯吡格雷胃肠道出血风险显著低于阿司匹林[20];氯吡格雷与阿司匹林相比,颅内出血发生率更低[21]。因此,在药物安全性及依从性上,氯吡格雷优于阿司匹林,究其原因,可能与两种药物抗血小板途径相关。以往大量实验数据表明,两种药物均可有效发挥抗血小板作用,改善脑供血,从而降低缺血性卒中的发病率和复发率[22]。针对MCA狭窄患者,无论从哪一个途径抑制血小板聚集,都可以阻止血栓进一步形成,从而防止卒中复发。阿司匹林通过抑制环氧化酶抑制血小板聚集的同时,也减少了前列腺素的生成,抑制了胃、十二指肠上皮碳酸盐的分泌,破坏了胃肠道防御因子,削弱了胃黏膜屏障功能和上皮修复功能;而氯吡格雷发挥抗血小板作用不直接损伤消化道,只是抑制血小板衍生因子和血管内皮生长因子,从而影响了新生血管生成和溃疡的愈合。故两者均有不同程度的消化道不良反应,而氯吡格雷的不良反应发生率低于阿司匹林。一项对口服抗血小板药物不良反应的荟萃分析表明,与阿司匹林相比,氯吡格雷胃肠道安全性更好[23]。多数卒中尤其合并IAS的患者为高龄,常存在胃黏膜萎缩及修复功能下降,导致消化道出血发生率高,甚至部分患者因不良反应拒绝使用抗血小板药物。氯吡格雷虽然价格较高,但胃肠道反应相对较小,因此依从性好。
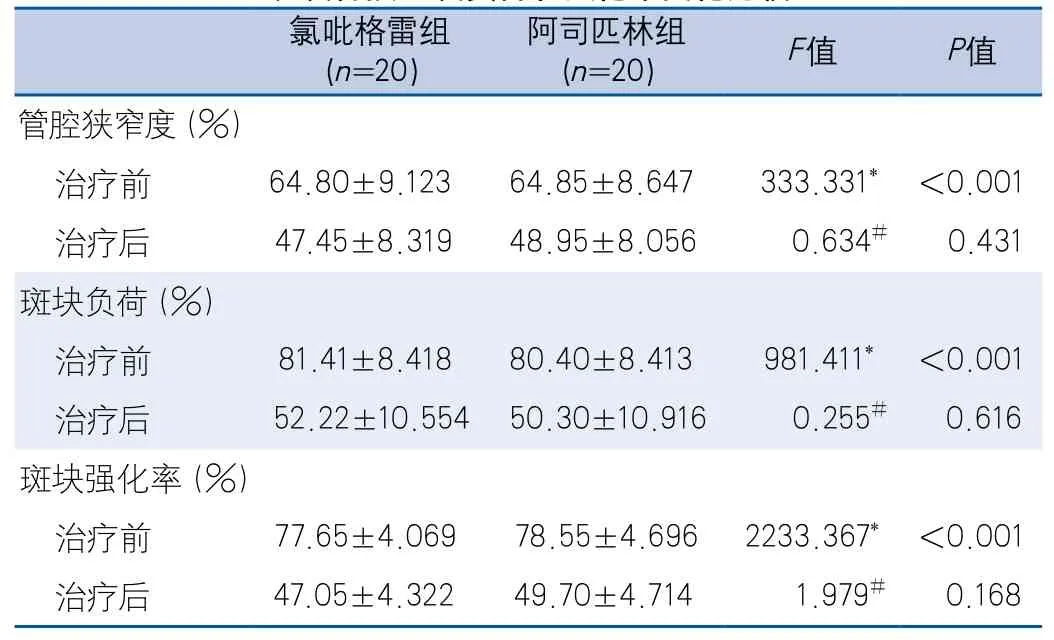
表2 氯吡格雷组和阿司匹林组管腔狭窄程度的变化百分比以及易损斑块负荷和强化率变化比较
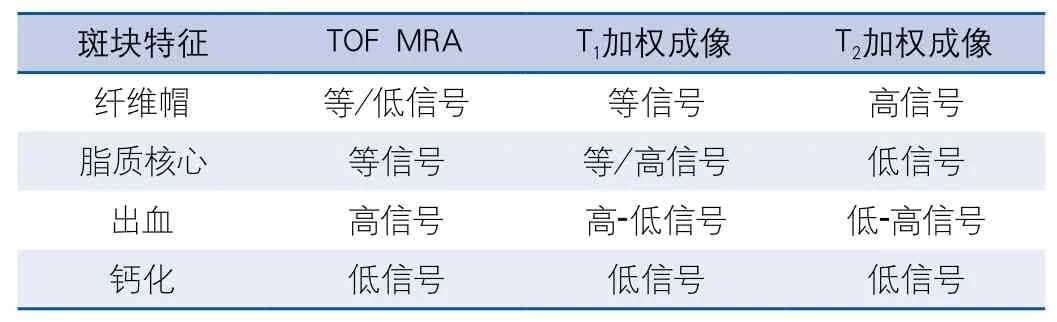
表3 不同形态学的动脉斑块多序列高分辨核磁成像特点
综合既往研究,本研究具有以下特点:①借助HR-MRI技术评价症状性IAS患者;②多个参数评估动脉硬化变化情况;③多种角度对比两种药物。同时本研究也存在一定的局限性:入选病例数量较少,随访时间较短,氯吡格雷与阿司匹林治疗症状性IAS患者的疗效和安全性仍需要更多的样本以及长时间的随访来证实。在临床工作中选择抗血小板药物时,要充分评估患者基本情况,在确保疗效的同时,尽量避免药物不良反应发生。
【点睛】氯吡格雷与阿司匹林治疗症状性颅内动脉狭窄患者疗效相当,选择药物需综合考虑,个体化选择。

