18F-PET-CT是Ia期非小细胞肺癌术前筛查首选吗?
何闯 袁晶 陈玉潇 杨丽 李良山 李廷源 黄学全
低剂量螺旋计算机断层扫描(computed tomography,CT)在肺癌高危人群进行肺癌筛查能降低20%的肺癌死亡[1],低剂量螺旋CT筛查高度怀疑为肺癌的肺部阳性结节者,需进行多学科讨论,对于适合于外科手术治疗者,一定首选外科治疗[2]。正电子发射型计算机断层显像(positron emission computed tomography, PET)-CT在非小细胞肺癌(non-small cell lung cancer, NSCLC)分期中的作用毋庸置疑,但是从我国卫生经济学考虑,2017版中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南将PET/CT作为可选择策略的2A类证据推荐。高危人群低剂量CT筛查怀疑肺癌的阳性结节,评估可手术治疗者,术前全身筛查方式目前未有更多研究。本研究主要目的是回顾性分析我院10年内Ia期(T≤3 cm)NSCLC术前筛查方式选择,了解采用PET-CT和BCME术前筛查后患者的无疾病进展期(progression-free survival, PFS)情况。
1 资料与方法
1.1 临床资料 选择陆军军医大学第一附属医院2007年1月-2017年12月期间行肺癌根治性手术切除的Ia期NSCLC患者366例,排除多源癌、术后短期内并发症死亡、磨玻璃结节患者。依据国际抗癌联盟(Union for International Cancer Control, UICC)肺癌肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期第8次修订版,I期分为Ia期和Ib期,其中Ia期又分为Ia1期、Ia2期、Ia3期。本研究将2007年-2016年资料按TNM分期第8次修订版进行再分期。最终300例患者纳入本研究,男性169例,女性131例,平均年龄(56.5±9.35)岁(34岁-77岁),在Ia期NSCLC中,T1aN0M0(≤1 cm)28例,T1bN0M0(1 cm-2 cm)169例,T1cN0M0(2 cm-3 cm)103例,术后病理诊断包括腺癌243例,鳞癌46例,其他类型11例。170例术前PET-CT筛查,130例术前BCME筛查,BCME术前筛查方法包括腹部B超、胸部CT、颅脑磁共振成像(magnetic resonance imaging, MRI)或CT、全身骨扫描(emission computed tomography, ECT)。将临床基本特征按1:1 PSM分析后,两组分别纳入114例患者进入研究(表1),男性138例,女性90例,平均年龄(56.8±9.4)岁(35岁-77岁)。生存时间从手术日起,截止随访时间为2017年12月31日,平均随访时间(44.7±30.2)个月(4个月-129个月)。
1.2 研究终点 主要研究终点是PFS,次要观察指标为筛查假阳性率和总生存期(overall survival, OS)。无疾病进展期定义为:手术日至首次确诊远处转移或未发生转移的末次随访时间。假阳性定义为:PET-CT或BCME既往影像诊断报告怀疑转移,在随访过程中排除为转移灶。总生存期定义为手术日至末次随访或任何原因死亡时间。
1.3 统计学分析 采用SPSS Statistics 24进行统计学分析。两组资料按1:1倾向性评分匹配,“卡钳值”设为0.02。正态数据用(Mean±SD)表示,率比较采用卡方检验,生存分析采用Kaplan-Meier生存曲线,组间采用Log-rank(Mantel-Cox)比较。采用单因素Cox回归分析以及多因素Cox回归(Forward:LR)生存分析,以P<0.05为差异有统计学意义。
2 结果
2.1 临床特点 本研究经PSM匹配分析后,共228例Ia期NSCLC纳入研究,两组基本临床特征无显著差异。至末次随访时PET-CT组,复发转移14例(12.2%),BCME组,复发转移19例(16.6%),两组复发转移率无显著差异(χ2=0.886,P=0.347),复发转移部位主要发生在肺、纵隔、骨骼和颅脑。至末次随访时间,26例患者死亡,其中25例发生肿瘤相关性死亡(11.0%),1例死于主动脉夹层破裂。
2.2 筛查假阳性率 PET-CT组出现假阳性10例,BCME组出现假阳性为8例,两组筛查的假阳率无显著差异(χ2=0.241,P=0.623)。
2.3 生存分析 经Kaplan-Meier生存分析显示。PSM匹配分析后,PET-CT组和BCME组的PFS分别为(44.9±27.2)个月、(44.1±33.1)个月,两组PFS无显著差异(χ2=1.284,P=0.257)(图1)。OS分别为(47.1±27.0)个月、(46.0±33.1)个月。通过Cox单因素分析发现肿瘤分期是PFS的危险因素(P=0.044)。Cox多因素分析发现肿瘤分期是PFS的风险因素(P=0.018),且非腺癌相较于腺癌术后更容易复发转移(P=0.036),而选择筛查方式不是PFS的影响因素(表2)。
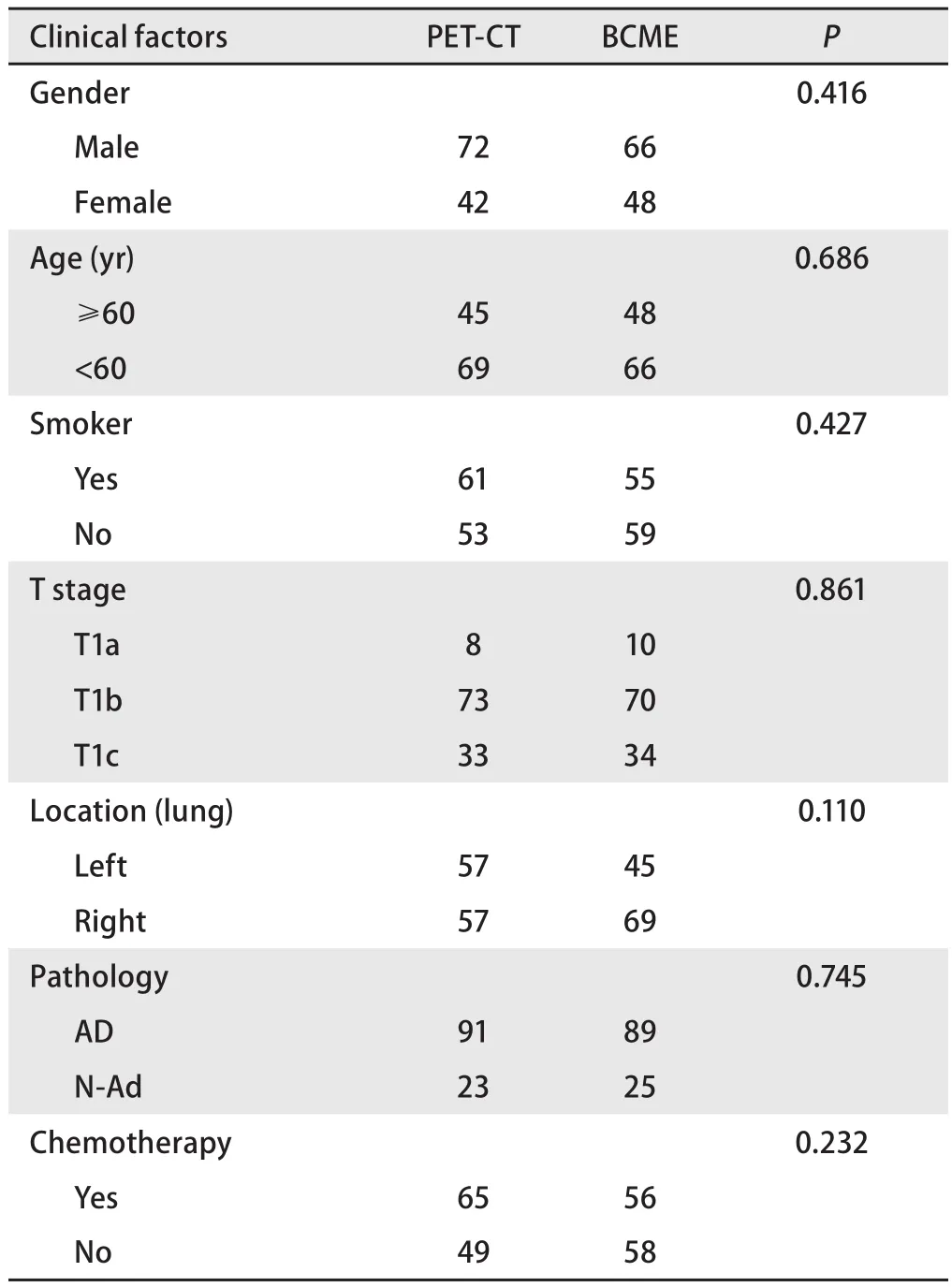
表1 患者临床资料Tab 1 Clinical characteristics of patients after PSM
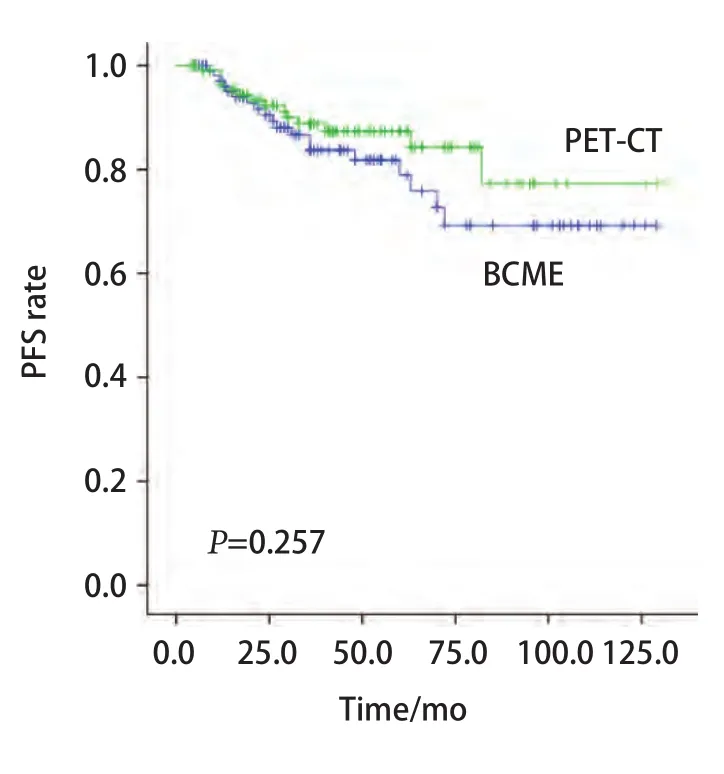
图1 两组PFS情况。PET-CT组和BCME组比较,两组PFS无显著差异(χ2=1.284,P=0.257)。Fig 1 PFS rates in patients with Ia stage non-small cell lung cancer.PFS was no significant difference in PETCT group compared with BCME group(χ2=1.284, P=0.257).
3 讨论
早期肺癌可以治愈,但是2/3的患者发现时已为晚期[3]。随着低剂量CT筛查手段在高危人群中的应用,越来越多的早期肺癌结节被发现,降低了肺癌的死亡率[1]。手术切除是NSCLC治愈主要手段之一,Ia期NSCLC的5年存活率>75%[4],在不增加并发症发生率的情况下,每个病人在根治性手术切除时都要行纵隔淋巴结取样[5]。18F-FDG PET-CT对NSCLC患者的筛查有助于临床医生选择,且患者能从手术中获益,但对淋巴结转移的鉴别具有较高的假阳性率[6],本研究中两组术前筛查方式均出现一定的假阳性率,但两组假阳性率的发生无显著差异,在临床随访过程中均已排除。2018版美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南建议>8 mm的肺部结节推荐PET-CT诊断或组织活检诊断[7],随着目前经皮穿刺活检、支气管内镜器械和技术的发展,术前病理诊断比较容易,但是筛查指南建议由于肿瘤原因、患者心肺功能异常不能耐受外科手术治疗,或者患者本人不愿意接受外科手术治疗者方可实施穿刺活检[2],笔者建议在明确病理诊断后有条件者行PET-CT筛查。对于在高危人群中低剂量CT筛查出怀疑肺癌的阳性结节(Ia期),PET-CT筛查在这部分人群中获益多少仍不清楚。
本研究对选用两种术前筛查方式患者的PFS作对比,至截访日,本研究组死亡26例,其中1例非肿瘤性死亡,因结局事件数较少可能会导致数据过度拟合,故本研究未将OS纳入分析。本组出现疾病进展33例,平均出现时间(30.3±20.8)个月,基本可以排除因术前筛查漏诊导致PFS的缩短,经多因素分析也证明,选择PET-CT术前筛查并不一定是PFS的影响因素。T分期较早也可能存在远处转移,常规BCME检查可能会出现漏诊,PET-CT对于淋巴结转移和胸腔外转移有更好的诊断效能[8],若病灶较小,因肝脏、大脑皮髓质交接区代谢较高,易出现假阴性结果,相较于常规筛查略显不足。上述两种术前筛查方式都可能存在漏诊,导致筛查的不准确,本组数据显示筛查漏诊的几率不高,PFS未受筛查方式影响。但是两种筛查均存在一定假阳性率,在临床中需要谨慎对待此类病例。
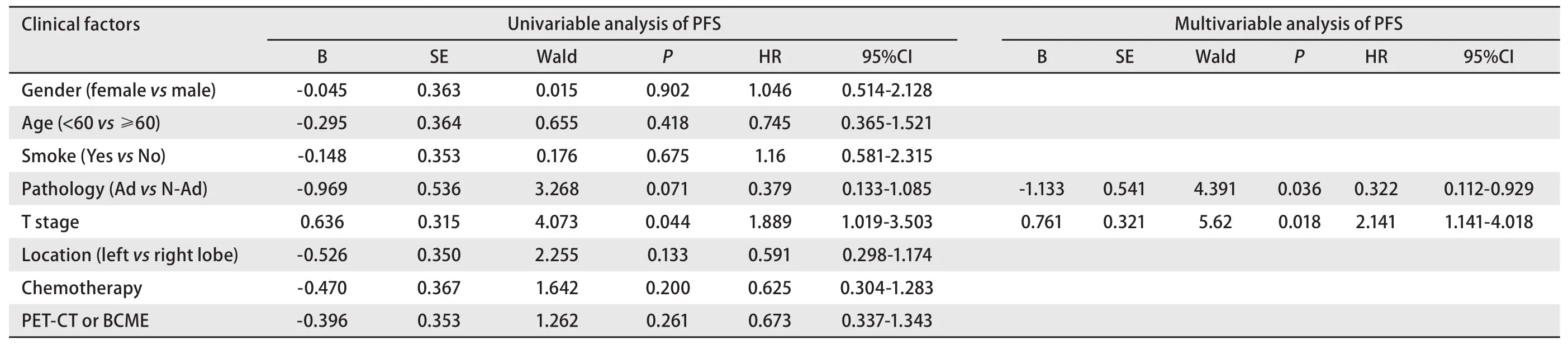
表2 PFS的预测因素Tab 2 Univariable and multivariable analyses of predictors of PFS after PSM
综上所述,通过本组回顾性数据提示,当发现肺部可疑Ia期肺癌时,选择PET-CT和BCME进行术前全身筛查均能达到临床需求,筛查后患者的PFS无显著差异,在临床抉择过程中需进行个体化选择。

