白花丹素对E.coli藻酸盐合成的抑制作用
陈 菲, 熊晓宇, 谢明杰
(辽宁师范大学生命科学学院 辽宁省生物技术与分子药物研发重点实验室,辽宁 大连 116081)
细菌的耐药性问题是目前临床医学面临的严峻问题,而细菌生物被膜(bacterial biofilm,BF) 的形成是导致细菌耐药和引起细菌持续性感染的主要致病机制之一[1]。BF是由细菌菌体及胞外的分泌物如多糖和蛋白等相互作用而形成的群体结构,细菌可借由形成的BF逃避机体免疫系统的攻击和抗菌药物的杀灭作用,从而形成对抗生素产生耐药性的超级细菌[2-3]。因此通过控制和破坏细菌生物被膜的形成,是解决细菌耐药和治疗细菌持续性感染的有效途径。白花丹素(Plumbagin,PLN)是传统药用植物白花丹的主要活性成分,近年来的研究表明,白花丹素具有抗氧化、抗炎、抗菌和抗癌等多种生物活性[4]。李欣燃等的研究结果显示,白花丹素对大肠埃希菌生物被膜有抑制作用[5],但目前关于白花丹素对大肠杆菌生物被膜的作用机制研究尚未见相关报道。本研究以E.coli10389为供试菌株,通过测定白花丹素对藻酸盐合成的影响及其对rseA和rpoE基因表达量的影响,探讨白花丹素对大肠埃希菌生物被膜形成的抑制作用及机制,旨在为解决大肠埃希菌的耐药问题提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 供试菌株E.coli10389、阴性对照菌株E.coli8739,均购自中国工业微生物菌种保藏管理中心。
1.1.2 培养基 刚果红培养基,LB培养基。
1.1.3 试剂与仪器 白花丹素,纯度分析≥90%,购自大连赛拓生物科技有限公司;藻酸盐标准品、刚果红、氯化三苯基四氮唑(TTC)、二乙基焦炭酸酯(DEPC)、Real-Time PCR相关试剂等,购自上海生工生物工程有限公司。IECCL31R Multispeed型超速冷冻离心机,美国Thermo公司;TC512型PCR仪,英国TECHNE公司;实时定量PCR仪Stralagen Mx3005P,美国Agilent公司; 实时荧光定量PCR仪TaKaRa TP800,大连宝生物工程有限公司。
1.2 方法
1.2.1 供试菌株BF的形成能力 将培养至对数期的E.coli点接种于刚果红固体平板表面,37 ℃培养24 h后观察结果。菌落黑色、光亮和干燥的为产BF菌株;菌落白色、光滑的为不产BF菌株。
1.2.2 供试菌株BF形成过程的测定 用结晶紫半定量法测定生物膜形成过程:于96孔板中加入200 μLE.coli菌悬液(106cfu/mL),37 ℃分别培养不同时间后弃上清,PBS洗3次。然后用甲醇固定15 min,每孔加入2%结晶紫染色8 min。水洗后,每孔再用乙醇∶ 丙酮(80∶ 20)悬浮菌体,于酶标仪570 nm下测定吸光值,每组设置3个复孔,取平均值。用显微镜观察生物被膜形成过程:把无菌载玻片放入12孔板中,每个孔板各加入上述菌悬液1 mL,37 ℃分别培养不同时间后取出载玻片,用结晶紫染色并在光学显微镜下观察。
1.2.3 白花丹素抑制E.coli10389 BF形成和成熟BF的MIC和MBC测定 在96孔板中分别加入200 μL供试菌悬液(103cfu/mL),再加入20 μL不同浓度的白花丹素,使其终浓度分别为2、4、8、16、32、64和128 μg/mL,以不加药物为空白对照。37 ℃培养24 h,每孔分别加入20 μL 0.2%TTC,继续避光培养4 h。以没有红色还原物甲瓒产生的最低浓度作为最低抑菌浓度(minimum inhibitory concentration, MIC)。然后从大于MIC的孔中,分别吸取20 μL涂布于LB固体培养基上,37 ℃培养24 h,以没有菌落生长的最低浓度作为最低杀菌浓度(minimal bactericidal concentration, MBC)。实验重复3次,取平均值。抑制成熟BF的MIC和MBC的测定是在96孔板中先培养成熟的BF后,再加入不同浓度的白花丹素进行测定。
1.2.4 白花丹素对E.coli10389产胞外多糖的影响[6]将E.coli10389菌悬液接种到白花丹素终浓度分别为1/8MIC、1/4MIC、1/2MIC、MIC和2MIC的刚果红平板上,37 ℃培养24 h,以不含药平板作为空白对照。
1.2.5 白花丹素对E.coli10389分泌藻酸盐的影响 于12孔板中的载玻片上培养E.coli10389成熟BF,弃上清后分别加入1 mL终浓度分别为1/4MIC、1/2MIC和MIC的白花丹素,37 ℃培养24 h,将载玻片取出放入离心管中,捣碎后加入600 μL 0.85%的生理盐水,振荡培养20 h,12 000 r/min离心30 min。取上清,加入2 mL硫酸硼酸溶液(0.25 mmol/L硼酸,1 mL蒸馏水,9 mL浓硫酸)和500 μL 1%卡唑溶液(1 mg咔唑,10 mL无水乙醇)混匀,沸水加热30 min后冷却,用分光光度计测定530 nm的吸光度值,以不加药组为空白对照。藻酸盐标准曲线的制作参照文献[7],所测得的标准曲线方程:y=0.001 8x-0.001 8,R2=0.998 7。
1.2.6E.coli10389产藻酸盐合成基因的检测 利用Primer 5.0软件及参考文献[8-9],设计rseA和rpoE基因引物。引物序列为(5′→3′):rseA-F:GTCAACCGGCGACATTGAT;rseA-R:ACGCTGCT-CCTGTACCTGCT;rpoE-F:TGGCTGTATCGGATT-GCTGT;rpoE-R:ACGTGAACGCACCGTACCTA。PCR 扩增条件为94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环,72 ℃ 10 min。
1.2.7 白花丹素对藻酸盐合成基因rpoE和rseA表达量的影响 将培养至对数期的菌悬液接种到白花丹素的终浓度为0、1/4MIC、1/2MIC和MIC的LB培养液中,37 ℃、120 r/min培养24 h。采用Trizol法提取RNA并对其浓度进行定量。采用两步法反转合成模板cDNA,根据rseA和rpoE引物进行扩增,设置反应条件:①95 ℃、30 s;②95 ℃、5 s,53 ℃、30 s ,40个循环;③95 ℃、15 s,60 ℃、30 s,95 ℃、15 s。以16S rRNA为内参基因。待反应结束后分析RT-PCR的扩增曲线和融解曲线,并计算rseA和rpoE的相对表达量。rseA和rpoE RT-PCR引物序列(5′→3′):rseA-F:GTCAACCGGCGACATTGAT;rseA-R:GACGCCAA-
CGATAACTGCAA;rpoE-F:TGGATGGCCTGAGCT-
ATGAA;rpoE-R:CGCCTGATAAGCGGTTGAA。
1.2.8 统计学方法 采用 SPSS 17.0 及Curve Expert 1.3统计软件进行分析,计数资料用率来表示,组内比较采用单因素方差分析,组间采用t检验。以P<0.05为具有统计学意义。
2 结果与分析
2.1 供试菌株BF的形成能力和形成时间的测定
刚果红平板结果显示(图1),供试的E.coli10389能形成黑色、光亮的干燥菌落,表明该菌株可形成BF。结晶紫半定量结果显示(图2),E.coli10389随着培养时间的增加,BF内的细菌数量逐渐增加,待培养至48 h时其BF内的菌量达到最大,表明E.coli10389形成成熟BF的时间为48 h。
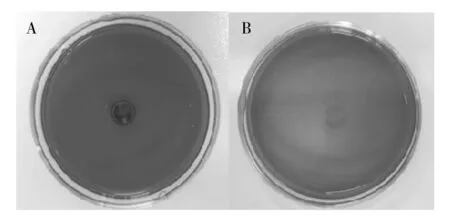
图1 刚果红平板的鉴定结果Fig.1 Identification of the Congo red plate A: E.coli 10389;B:E.coli 8739
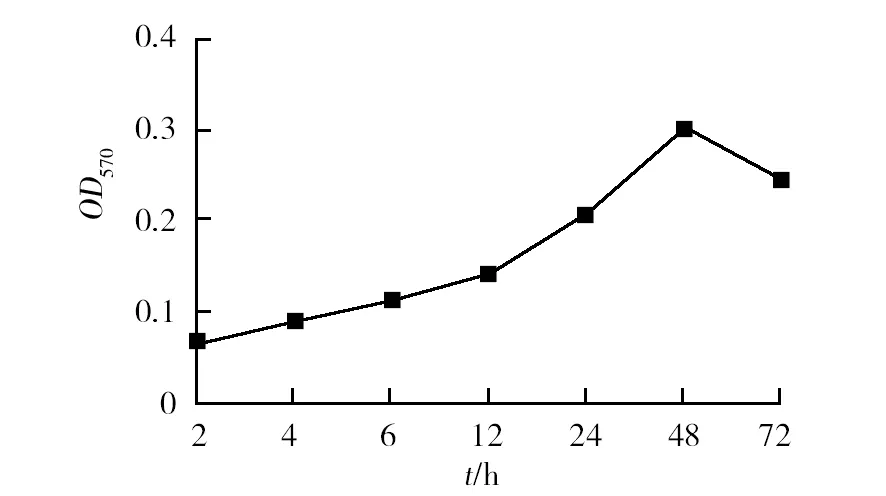
图2 E.coli 10389BF 的形成过程Fig.2 The formation of E.coli 10389 biofilm
2.2 白花丹素抑制供试菌株BF形成和成熟BF的MIC和MBC的测定结果
实验结果显示(表1),白花丹素能抑制BF的形成,其抑杀E.coli10389的MIC 和MBC分别为16和64 μg/mL。白花丹素对E.coli10389成熟BF内的细菌也有破坏作用,其抑杀E.coli10389成熟生物被膜内细菌的MIC 和MBC分别为64和128 μg/mL。
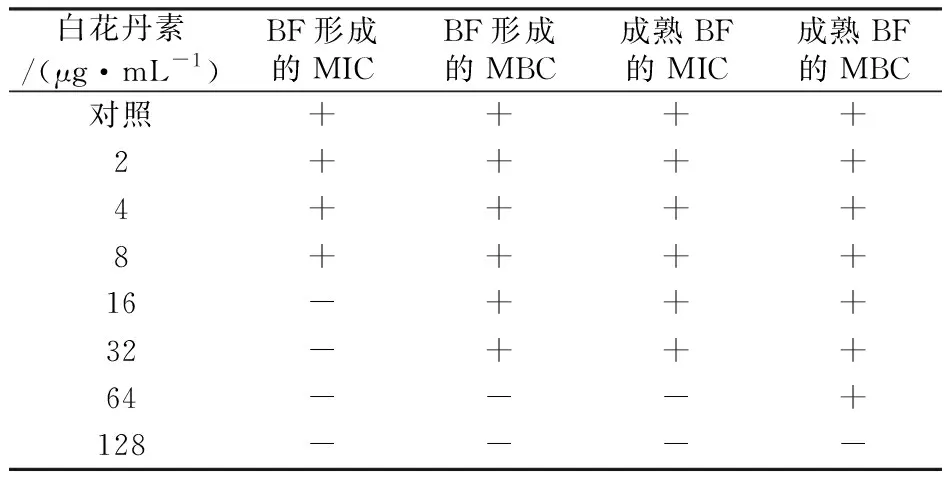
表1 白花丹素抑制供试菌株BF形成和成熟BF内细菌的MIC和MBC
注:“-”表示没有菌生长; “+”表示有菌生长
2.3 白花丹素对E.coli10389产胞外多糖的影响
刚果红平板结果显示(图3),随着白花丹素浓度的增加,E.coli10389产胞外多糖的量逐渐减少。藻酸盐含量的测定结果显示(图4),白花丹素能抑制E.coli10389藻酸盐的合成,其中1/2MIC的白花丹素作用E.coli10389 24 h后,与对照组相比,藻酸盐的含量降低了34.83%(P<0.01)。

图3 白花丹素对E.coli 10389胞外多糖的影响Fig.3 Effect of E.coli 10389 extracellular polysaccharide expression by PLN
2.4 白花丹素对rseA和rpoE 表达量的影响
由于rseA和rpoE基因为藻酸盐合成的调控基因,本研究首先证明E.coli10389菌株中是否存在rpoE和rseA基因,并采用RT-PCR法测定白花丹素对E.coli10389 菌株rpoE和rseA基因表达量的影响。结果显示,在供试菌株中存在与藻酸盐合成相关的rpoE和rseA基因 (图5)。
RT-PCR结果显示(图6),白花丹素能降低E.coli10389rseA和rpoE基因的相对表达量,其中1/2MIC的白花丹素作用E.coli10389 24 h后,与对照组相比,rseA的表达量上调了17.43%,rpoE的表达量降低了12.8%(P<0.05)。
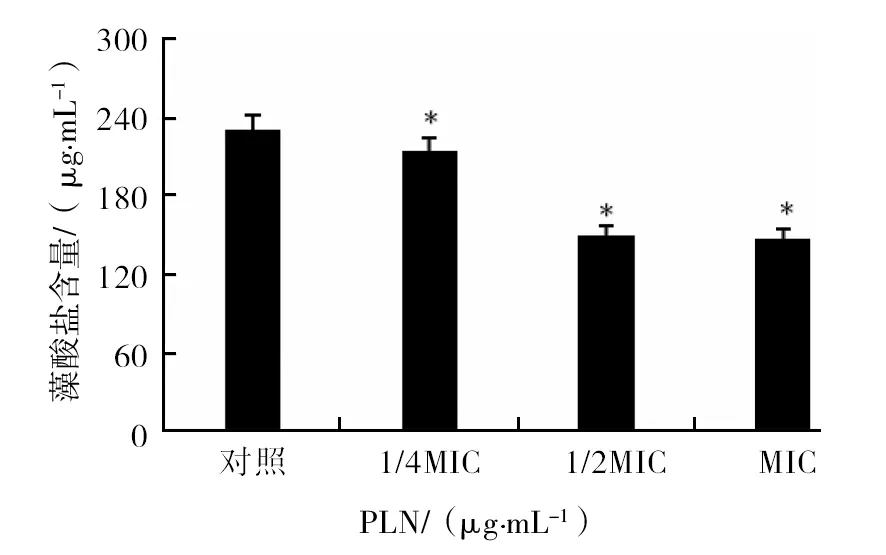
图4 白花丹素对藻酸盐含量的影响Fig.4 Effect of alginate content by PLN 与对照组相比,*P<0.01*P<0.01, compared with control group
图5 E.coli 10389 rseA和rpoE基因的琼脂糖凝胶电泳图Fig.5 Agarose gel electrophoresis of E.coli 10389 genes rseA and rpoE
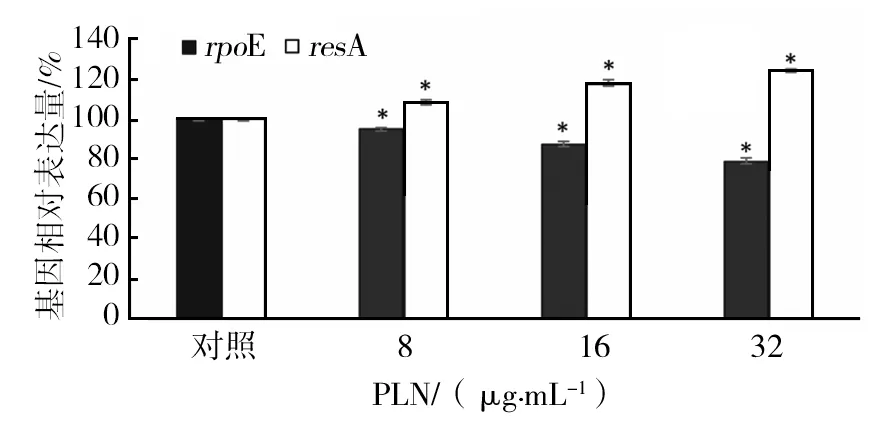
图6 白花丹素E.coli 10389 rseA和rpoE表达量的影响 与对照组相比,*P<0.05Fig.6 Expression of rseA and rpoE in E.coli 10389 to PLN与对照组相比,*P<0.05*P<0.05, compared with control group
3 讨 论
由于细菌在成熟条件下都可以形成生物被膜,因此BF的形成是造成院内细菌持续性感染的主要原因之一。BF一旦形成,其对抗生素和消毒剂的抵抗能力要比浮游菌显著增强。目前临床分离的大肠埃希菌形成BF的概率极高,黄璨等[10]的研究结果显示,川贝母可显著抑制大肠埃希菌生物被膜的形成。本研究结果也证明,白花丹素对大肠埃希菌生物被膜的形成以及成熟生物被膜内的大肠埃希菌有抑制和杀灭作用。
大肠埃希菌BF的形成过程包括定殖、黏附、聚集、成熟和播散5个阶段,其中藻酸盐等胞外多糖的合成和分泌在BF形成的黏附和聚集阶段发挥重要作用,是维持BF稳定性的主要组成成分[11-12]。藻酸盐是一种阴离子黏性多糖蛋白复合物,几乎所有的细菌都能分泌藻酸盐。有研究表明,可以通过药物破坏藻酸盐多糖蛋白复合物的结构,来清除和破坏细菌的生物被膜,以达到防治细菌生物被膜造成的感染[13-15]。本研究结果显示,白花丹素能抑制E.coli10389藻酸盐的合成量。其中1/2MIC的白花丹素作用E.coli10389 24 h后,与对照组相比,藻酸盐的合成量降低了34.83%(P<0.01)。
藻酸盐的合成受许多基因调控,有研究表明,在E.coli中,rpoE基因编码的产物可以激活藻酸盐合成基因的启动子,促进藻酸盐的合成;而rseA能编码螯合激活子的蛋白抑制藻酸盐的表达[16-18]。本研究结果显示,白花丹素能降低rpoE的表达量,促进rseA的表达量,表明白花丹素抑制E.coli10389藻酸盐的合成与rseA和rpoE有关。
综上所述,白花丹素能够抑制E.coli10389 BF的形成,其作用机制是通过影响藻酸盐合成的rseA和rpoE基因,抑制藻酸盐的合成量来影响E.coli10389 BF的形成。由于BF的形成是受多种因子和多基因共同调控的过程,因此关于白花丹素抑制BF形成的其他作用机制还有待进一步研究。

