纳米银对聚磷菌吸磷和释磷的影响及毒性效应
苑志华,林晓锋,周婷婷,3,陈文祥,张磊峰,郑煜铭*
纳米银对聚磷菌吸磷和释磷的影响及毒性效应
苑志华1,2,林晓锋1,2,周婷婷1,2,3,陈文祥4,张磊峰4,郑煜铭1,2*
(1.中国科学院城市污染物转化重点实验室,福建 厦门 361021;2.中国科学院城市环境研究所,福建 厦门 361021;3.安徽理工大学地球与环境学院,安徽 淮南 232001;4.集美大学食品与生物工程学院, 福建 厦门 361021)
利用硼氢化钠还原硝酸银,并使用聚乙烯醇(PVA)作为分散剂,制备出分散良好、粒径为(14±3)nm的纳米银颗粒,考察了其对聚磷菌()好氧吸磷和厌氧释磷的影响,以及产生的毒性效应.结果表明,在好氧状态下,7mg/L的纳米银能够完全抑制聚磷菌的生长(<0.01),达到10mg/L时才能完全抑制聚磷菌的吸磷能力(=0.01);在厌氧状态下,大于20mg/L的纳米银才使聚磷菌释磷能力受到部分抑制(<0.05).活性氧簇(ROS)和扫描电子显微镜(SEM)的检测结果表明,纳米银使细菌体内ROS水平降低,部分细菌菌体表面塌陷,这说明,纳米银不但可以毒害聚磷菌菌体表面,还可以降低菌内ROS水平.
纳米银;聚磷菌;好氧吸磷;厌氧释磷;毒性效应
纳米银(AgNPs)具有优良的杀菌性能,成为市场上应用最广泛的工程纳米材料之一,被大量应用在纺织品、食物容器、电子电器、医药和个人护理品等商品中[1-4].然而,纳米银被释放到环境中,所产生的环境风险也引起了科学界的广泛关注[5-8].从物质流分析来看,消费产品中的纳米银受到人类活动的影响,一部分会经过下水道系统进入城市污水处理厂[9-12],对污水处理厂中的生物处理系统产生影响,进而影响污水处理系统的稳定性.
有研究认为,纳米银的毒性主要来源于纳米颗粒本身和其释放的银离子,以及二者所产生的活性氧簇(ROS),其毒性大小与纳米银团聚状态、颗粒大小和形成的银复合物种类有关[13-16].已有的研究发现:纳米银可以降低污水生物处理系统对磷的去除效率,主要原因是影响了污泥中的微生物种群结构和抑制了磷去除相关的酶活性[17-18].而且,纳米银所释放的银离子对除磷效率的影响更大[17].污水中磷的去除主要由活性污泥中的聚磷菌(PAB)完成,聚磷菌通过厌氧释磷和好氧吸磷,达到去除磷的目的[19].然而,纳米银对聚磷菌除磷的影响和毒性效应的研究还比较缺乏.本文采用硼氢化钠还原硝酸银,并用聚乙烯醇分散,制备了分散良好的纳米银悬浮液,通过研究其对聚磷菌的影响,得到纳米银对聚磷菌的毒性效应.
1 材料与方法
1.1 试剂与菌种
硝酸银(AgNO3,99.8%)(上海申博化工有限公司);聚乙烯醇(PVA,1750±50,³99.0%)(北京索莱宝科技有限公司);银标准溶液(1000mg/L)(国家有色金属及电子材料分析测试中心);蛋白胨和酵母提取物(OXOID(UK)公司);硝酸(GR,65%)和其它化学试剂(国药集团化学试剂有限公司),均为分析纯或者以上级别.聚磷菌为(DSM 10555)(德国微生物菌种保藏中心).试验中使用的水为超纯水(Milli-Q,USA).
培养基配方为:0.5g/L葡萄糖、0.5g/L蛋白胨、0.5g/L酵母提取物、0.5g/L谷氨酸钠、0.5g/L KH2PO4、0.1g/L (NH4)2SO4和0.1g/L MgSO4,pH 7.0,培养温度为30℃,摇床150r/min避光培养.
1.2 纳米银的制备与表征
根据文献的方法[14],制备纳米银悬浮液,步骤:1mL 14mmol/L的硼氢化钠加入18mL 0.06wt%聚乙烯醇(PVA)中,再滴加1mL 14mmol/L的硝酸银,并搅拌10min(避光),制备出纳米银悬浮液.采用透射电子显微镜(TEM, Hitachi H-7650,日本)观察纳米银的形态.
1.3 纳米银对聚磷菌生长的影响
培养48h后的聚磷菌,使用高速离心机(CR22GII,日本日立)在5000、4℃离心20min后,倒掉培养基,使用清洗液洗涤后在5000、4℃再次离心20min,倒掉清洗液,再用培养基重悬浮后放在4 ℃冰箱备用.使用OD600定量细菌的含量.
为了评估纳米银对聚磷菌生长的影响,先把适量培养基分装于250mL已灭菌的三角瓶中,再加入不同浓度的纳米银.最后,加入定量后的细菌菌液,使三角瓶内最后的细菌OD600为0.05.随后,加入细菌和纳米银的培养基放在摇床中按照细菌生长条件培养,并在一定时间内分别检测OD600值.为了确定分散剂PVA对聚磷菌的影响,设置PVA实验组,加入与10mg/L纳米银同等剂量的PVA.同时设置一组不含纳米银的空白对照组.实验均设置3重复.
1.4 纳米银对聚磷菌好氧吸磷的影响
按照1.3的实验步骤,加入纳米银和聚磷菌后的三角瓶,放入摇床中按照细菌生长条件培养,在一定时间内取一定量菌液,经过0.22μm滤膜过滤后,用流动注射仪(Hach QC8500,USA)检测培养基中的磷含量变化.同时,在暴露过程中,取一定量菌液,放入Amicon超滤膜装置(Millipore 3kDa)中[14],在4℃、5000r/min速度下过滤,过滤液使用电感耦合等离子体发射光谱仪(ICP-OES,PerkinElmer Optima 7000DV,美国)检测Ag+的变化.
1.5 纳米银对聚磷菌厌氧释磷的影响
把一定量的培养基分装到厌氧瓶中,加入除氧剂和氧指示剂,氮吹除氧,压盖密封后灭菌.把培养好的菌液收集定量,加入到灭菌后的厌氧瓶中,同时加入一定量的纳米银悬浮液,放入摇床中,30℃、150r/min避光培养.培养48h后,分别用注射器取样,经过0.22μm滤膜过滤后,用流动注射仪检测培养基中磷含量的变化.
1.6 活性氧簇(ROS)的检测
培养48h后的聚磷菌,使用高速离心机在5000、4℃离心20min后,倒掉培养基,使用清洗液洗涤后再次离心,倒掉清洗液,再用培养基重悬浮,并调整细菌浓度为升1.0´106个/mL.取一定量的细菌,在30℃条件下,暴露纳米银2h,再用PBS清洗3次,加入荧光探针,按照细胞内ROS试剂盒(Sigma MAK142)的操作说明,利用荧光酶标仪在650nm激发波长、675nm发射波长下测定不同纳米银浓度暴露下聚磷菌内的ROS水平.
1.7 聚磷菌形态的变化
按照1.3的实验步骤,加入纳米银悬浮液到聚磷菌中,在30℃暴露培养48h后,离心倒掉上清液,加入2.5%戊二醛-磷酸盐缓冲液,固定1h,再使用磷酸盐缓冲液(pH=7.4)清洗3遍,并依次使用30%、50%、70%、90%和100%酒精脱水,每次各15min,再用100%酒精脱水20min,立即用临界点干燥仪(Tousimis Samdri-PVT-3D, USA)进行干燥.干燥后的样品进行溅射喷金,使用扫描电子显微镜(SEM, Hitachi S-4800, Japan)观察聚磷菌接触纳米银前后的形态变化,并进行能谱(Genesis XM2)分析.
1.8 数据处理
每组试验单独重复3次,结果取平均值.数据采用Origin8.1软件分析.
2 结果与讨论
2.1 纳米银的形态
图1显示出纳米银呈圆球状,分散效果良好,颗粒大小不均匀.经统计分析,其颗粒平均直径为(14±3)nm.

图1 纳米银的TEM
2.2 纳米银对聚磷菌生长的影响
使用对数期的生长率表示聚磷菌的活性,并以此计算纳米银对聚磷菌的抑制效率.图2说明了分散剂PVA对聚磷菌生长没有影响,而纳米银对聚磷菌生长具有一定的抑制作用.如图2所示,未暴露纳米银的聚磷菌显示正常的生长周期,包括迟缓期、对数期和稳定期.然而,暴露纳米银后,细菌生长受到了一定的影响,1mg/L的纳米银对聚磷菌的生长仅产生了微量的影响,其抑制效率为3.3%,影响较小.当纳米银增加到3mg/L时,其对聚磷菌对数生长期有一定的抑制(>0.05),抑制效率达到22.2%.然而,随着暴露时间达到58h,聚磷菌的生长逐渐恢复到未暴露纳米银的水平,这可能由于纳米银接触聚磷菌后,抑制了部分细菌的活性,但是随着暴露时间的延长,纳米银受到菌体、培养基成分等的影响,出现了团聚、形态转化等[14,20-21],进而毒性降低,对细菌的影响变小[22].因此,聚磷菌又逐渐恢复到未暴露纳米银的生长状态.当纳米银达到5mg/L时,其对聚磷菌生长的抑制效率达到70.3%(<0.05),但是,随着接触时间的延长,聚磷菌的生长状态有逐步恢复的趋势(图2).而纳米银的加入量达到7mg/L时,聚磷菌的生长被完全抑制(<0.01),即使暴露时间达到58h,聚磷菌的活性仍未恢复.这说明,当纳米银达到7mg/L以上时,能够完全抑制聚磷菌的生长.已有的研究发现,相同粒径和分散剂的纳米银使氨氧化细菌完全抑制的浓度为3mg/L[14],而使聚磷菌生长完全停止的浓度为7mg/L,这说明不同细菌由于本身结构特征、生长环境等因素的不同,表现出对纳米银不同的耐受程度[23-24].

2.3 纳米银对聚磷菌好氧吸磷的影响
在好氧培养中,聚磷菌在多聚磷酸盐激酶(PPK)的作用下,可以过量吸收培养基中的磷酸盐,以多聚磷酸盐(poly-P)的形式存储,其反应过程为:ATP+ (poly-P)«ADP+(poly-P)+1[25].如图3所示,未加纳米银的聚磷菌吸收培养基中的磷,使培养基中的磷含量逐渐降低,48h时对磷的吸收达到最大值.而加入纳米银后,聚磷菌活性受到抑制,磷吸收能力减弱.纳米银在1~7mg/L时,对聚磷菌好氧吸磷能力均有一定程度的影响,当达到10mg/L时,完全抑制了聚磷菌的吸磷能力(=0.01).而7mg/L的纳米银已经完全抑制了聚磷菌的生长(图2),这说明该浓度下聚磷菌的裂殖受到影响,但是部分细菌仍具有一定的活性.纳米银对细菌产生毒性的原因是[6,14-15,26]:(1)释放的自由Ag+,可以破坏细胞ATP的产生和DNA的复制,最终使细胞死亡;(2)诱导产生强氧化性ROS,进而破坏细胞结构;(3)纳米粒子直接损伤细胞膜.

图3反映出纳米银浓度小于5mg/L时,并没有引起暴露体系中银离子含量的增加,而大于7mg/L时,银离子含量才有很少程度的上升.这说明,在该暴露体系中,纳米银对聚磷菌的毒性并不是主要由Ag+引起的.纳米银在溶解氧和质子存在时,很容易被氧化而释放出自由Ag+[27],然而释放的Ag+很快被培养体系中的其它离子络合[27-28],因此,检测时,自由Ag+的含量很少.纳米银对细菌的毒性主要涉及抑制蛋白功能、基因表达和能量产生等[14],对聚磷菌好氧吸磷的抑制也可能是影响到有关除磷酶的活性[17,29].
2.4 纳米银对聚磷菌厌氧释磷的影响
在厌氧环境中,长链多聚磷酸盐在多聚磷酸盐酯酶(PPX)的催化下,不断释放出无机磷酸盐,达到厌氧释磷的目的,其反应过程为:(poly-P)«(poly-P)-1«(Pi)[25].如图4所示,厌氧反应48h后,未加纳米银的体系中,无机磷含量达到78.3mg/L,而加入5,10mg/L纳米银时,体系中磷含量均未受到明显影响.但是,加入20,30mg/L纳米银后,体系中磷含量降低,说明聚磷菌释磷受到一定程度的抑制(<0.05).纳米银对聚磷菌释磷的影响,可能通过抑制PPX的活性,来抑制多聚磷酸盐的分解,从而抑制了无机磷的释放[17,29].从整体上看,纳米银的毒性在厌氧状态下更小,这是因为纳米银在厌氧状态下,银离子的释放和ROS的产生都受到了明显的抑制,再加上纳米银颗粒团聚和被其它离子络合[27,30],其毒性被大量降低.

图4 纳米银对聚磷菌厌氧释磷的影响
2.5 细菌内ROS的变化
图5显示在好氧条件下,加入不同浓度的纳米银后,细胞内ROS的水平变化.纳米银加入后,细胞内ROS呈现降低趋势.之前的研究发现,暴露纳米银后的细菌,细胞内ROS水平上升,而升高的ROS则是导致细菌死亡的重要原因之一[26,31-32].然而,聚磷菌暴露纳米银后,菌体内ROS水平并没有升高,反而呈现一定的降低趋势,这与Hsiao等[33]的发现一致.当纳米银进入细胞内,很快被ROS氧化,并在细胞内释放出自由Ag+,Ag+对细胞产生毒性,引起细胞死亡,同时,细胞内ROS水平被降低[33],这也很好地解释了纳米银对聚磷菌的毒性来源.纳米银含量越高,聚磷菌活性越低(图2和图3),生长受到的抑制也越大,但是培养基中(细菌菌体外)的Ag+并没有明显增加(图3),细菌菌体内的ROS水平也没有升高.因此,纳米银对聚磷菌的毒性除了直接作用于聚磷菌菌体外,很可能与菌体内的ROS水平密切相关.
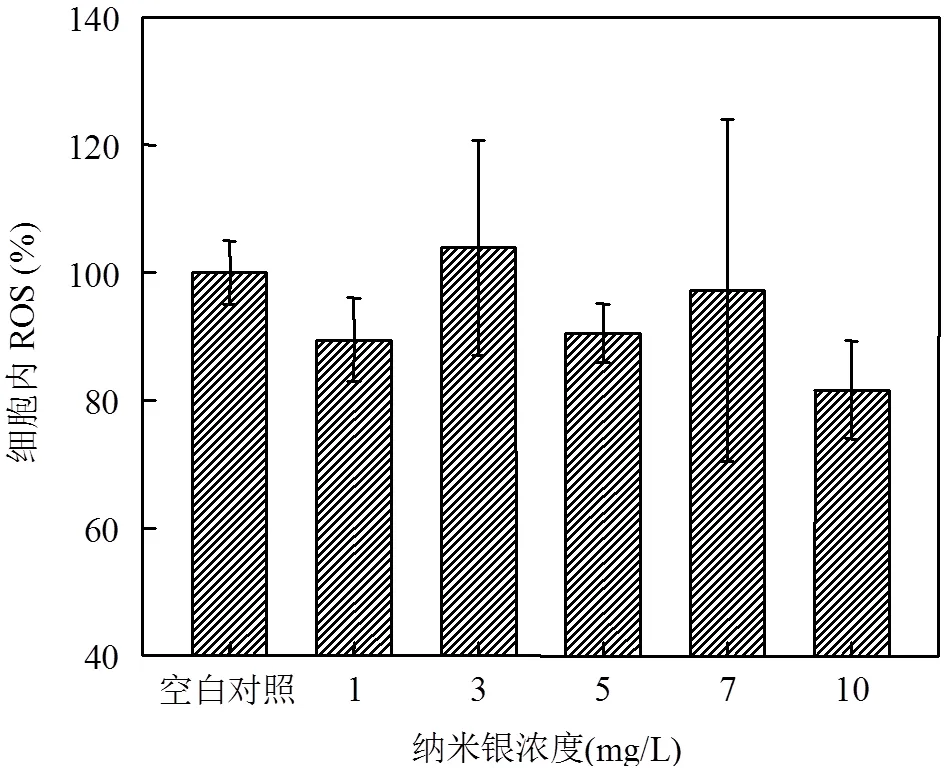
图5 纳米银对细菌内ROS的影响
2.6 聚磷菌表面形态的变化
如图6所示,聚磷菌暴露纳米银前,菌体表面光滑,没有出现破损.经过10mg/L纳米银暴露后,部分细菌细胞壁出现塌陷现象,然而,更多的细菌表面并没有出现特别明显的变化.实验结果显示,10mg/L的纳米银已经完全抑制了细菌的生长(图2),同时,也使其丧失了吸磷能力(图3),但是在此浓度下,聚磷菌表面形态受到的影响有限,仅有部分出现塌陷.之前的研究已经发现,纳米银释放的银离子,可以作用于细菌的细胞膜,与细胞膜上的蛋白成分结合[31,34],最后引起细胞膜的破裂[14,31],但是,释放的银离子主要被溶液中的其它离子络合,仅少数银离子作用于细胞膜上[31],所以,对细胞膜的影响有限.Yuan等[14]的研究也发现,在纳米银完全抑制浓度下,多数氨氧化细菌表面也没有出现明显变化,但是,内部细胞核已经完全解体.结合了ROS的结果来看,纳米银可能透过细胞膜,进入细胞内部,进而对聚磷菌产生毒性效应.

箭头处为菌体塌陷部位
因此,纳米银对聚磷菌的毒性很可能主要是由于纳米银进入聚磷菌内部;此时,细胞内产生的ROS氧化了纳米银[31],使其释放出银离子;银离子进而对菌体内物质产生影响,如抑制磷代谢有关的酶;最后,使聚磷菌生长和除磷有关的活动停止.
2.7 纳米银对污水生物除磷影响的启示
以上研究可以得知,在不同的条件下,聚磷菌纯菌对纳米银暴露表现出不同的耐受程度.在好氧条件下,10mg/L的纳米银才可以完全抑制聚磷菌的吸磷能力,然而,1mg/L的纳米银对聚磷菌的吸磷行为已经表现出一定的不利影响(图3),在厌氧条件下,纳米银在20mg/L时才会产生影响,影响相对较小(图4).这说明纳米银对聚磷菌的影响在好氧条件下较为明显.不同的文献中都发现了纳米银能够降低污水生物除磷的效率[18,35-37],主要是影响了细菌的种群结构和除磷有关的酶活性[17,35],从纳米银和银离子的对比来看,银离子对除磷的影响远远大于纳米银的影响[17].因此,如果在厌氧条件下银离子释放得以控制[30,38],同时,在环境条件的影响下,单个纳米银颗粒很快团聚成大颗粒[39-40],其进入聚磷菌内部的可能性就大量降低.因此,在此情况下,纳米银对污水厂聚磷菌的影响就会相对较小.但是,纳米银可以在污泥中富集[41],富集纳米银后的污泥在一定条件下释放出的银离子[41],则提高了对污水除磷影响的可能性.综上所述,关注纳米银对聚磷菌和污水生物除磷的影响,更应集中在纳米银含量上,污水厂进水中纳米银低于1mg/L时,对聚磷菌的影响是可以忽略的.
3 结论
3.1 利用化学法制备出分散良好、粒径为(14±3)nm纳米银颗粒,其在好氧状态下,7mg/L时能够完全抑制聚磷菌的生长.
3.2 纳米银能够抑制聚磷菌的好氧吸磷和厌氧释磷能力,且对好氧吸磷的抑制作用更强,10mg/L时能够使聚磷菌完全失去吸磷能力.
3.3 纳米银对聚磷菌的毒性效应除了直接作用于细菌菌体表面外,也与细菌菌体内ROS水平密切相关.
[1] Ilić V, Šaponjić Z, Vodnik V, et al. Bactericidal efficiency of silver nanoparticles deposited onto radio frequency plasma pretreated polyester fabrics [J]. Industrial & Engineering Chemistry Research, 2010,49(16):7287–7293.
[2] Walser T, Demou E, Lang D J, et al. Prospective environmental life cycle assessment of nanosilver T-shirts [J]. Environmental Science & Technology, 2011,45(10):4570–4578.
[3] Wigger H, Hackmann S, Zimmermann T, et al. Influences of use activities and waste management on environmental releases of engineered nanomaterials [J]. Science of The Total Environment, 2015,535:160–171.
[4] Hendren C O, Mesnard X, Dröge J, et al. Estimating production data for five engineered nanomaterials as a basis for exposure assessment [J]. Environmental Science & Technology, 2011,45(7):2562–2569.
[5] McGillicuddy E, Murray I, Kavanagh S, et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology [J]. Science of The Total Environment, 2017,575:231–246.
[6] Zhang W, Xiao B, Fang T. Chemical transformation of silver nanoparticles in aquatic environments: Mechanism, morphology and toxicity [J]. Chemosphere, 2018,191:324–334.
[7] Zhang C, Hu Z, Deng B. Silver nanoparticles in aquatic environments: Physiochemical behavior and antimicrobial mechanisms [J]. Water Research, 2016,88:403–427.
[8] 苑志华,汤晓琳,白炎青,等.纳米银对小球藻光合作用和呼吸作用的影响 [J]. 中国环境科学, 2013,33(8):1468–1473.
[9] Li L, Stoiber M, Wimmer A, et al. To what extent can full-scale wastewater treatment plant effluent influence the occurrence of silver based nanoparticles in surface waters? [J]. Environmental Science & Technology, 2016,50(12):6327–6333.
[10] Brunetti G, Donner E, Laera G, et al. Fate of zinc and silver engineered nanoparticles in sewerage networks [J]. Water Research, 2015,77: 72–84.
[11] Kaegi R, Voegelin A, Ort C, et al. Fate and transformation of silver nanoparticles in urban wastewater systems [J]. Water Research, 2013, 47(12):3866–3877.
[12] Li L, Hartmann G, Döblinger M, et al. Quantification of nanoscale silver particles removal and release from municipal wastewater treatment plants in Germany [J]. Environmental Science & Technology, 2013,47(13):7317–7323.
[13] Burchardt A D, Carvalho R N, Valente A, et al. Effects of silver nanoparticles in diatomandsp [J]. Environmental Science & Technology, 2012, 46(20):11336–11344.
[14] Yuan Z H, Li J W, Cui L, et al. Interaction of silver nanoparticles with pure nitrifying bacteria [J]. Chemosphere, 2013,90(4):1404–1411.
[15] Guo Z, Chen G, Zeng G, et al. Are silver nanoparticles always toxic in the presence of environmental anions? [J]. Chemosphere, 2017,171: 318–323.
[16] 陈 铮,罗专溪,邱昭政,等.纳米金、银对氨氧化细菌及其氨氧化作用的影响 [J]. 中国环境科学, 2014,34(3):705–712.
[17] Chen Y, Chen H, Zheng X, et al. The impacts of silver nanoparticles and silver ions on wastewater biological phosphorous removal and the mechanisms [J]. Journal of Hazardous Materials, 2012,239–240: 88–94.
[18] Yuan Z-H, Yang X, Hu A, et al. Long-term impacts of silver nanoparticles in an anaerobic–anoxic–oxic membrane bioreactor system [J]. Chemical Engineering Journal, 2015,276:83–90.
[19] Carvalheira M, Oehmen A, Carvalho G, et al. The effect of substrate competition on the metabolism of polyphosphate accumulating organisms (PAOs) [J]. Water Research, 2014,64:149–159.
[20] Levard C, Mitra S, Yang T, et al. Effect of chloride on the dissolution rate of silver nanoparticles and toxicity to[J]. Environmental Science & Technology, 2013,47(11):5738–5745.
[21] Thuptimdang P, Limpiyakorn T, Khan E. Dependence of toxicity of silver nanoparticles onbiofilm structure [J]. Chemosphere, 2017,188:199–207.
[22] Lee S-W, Park S-Y, Kim Y, et al. Effect of sulfidation and dissolved organic matters on toxicity of silver nanoparticles in sediment dwelling organism, Chironomus riparius [J]. Science of The Total Environment, 2016,553:565–573.
[23] El Badawy A M, Silva R G, Morris B, et al. Surface charge-dependent toxicity of silver nanoparticles [J]. Environmental Science & Technology, 2010,45(1):283–287.
[24] Dimkpa C O, Calder A, Gajjar P, et al. Interaction of silver nanoparticles with an environmentally beneficial bacterium,[J]. Journal of Hazardous Materials, 2011,188(1–3):428–435.
[25] 袁林江,周国标,南亚萍.微生物聚磷及其酶学调控 [J]. 环境科学学报, 2015,35(7):1955–1961.
[26] Marambio-Jones C, Hoek E M V. A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment [J]. Journal of Nanoparticle Research, 2010, 12:1531–1551.
[27] Garg S, Rong H, Miller C J, et al. Oxidative dissolution of silver nanoparticles by chlorine: Implications to silver nanoparticle fate and toxicity [J]. Environmental Science & Technology, 2016,50(7):3890– 3896.
[28] Chambers B A, Afrooz A R M N, Bae S, et al. Effects of chloride and ionic strength on physical morphology, dissolution, and bacterial toxicity of silver nanoparticles [J]. Environmental Science & Technology, 2014,48(1):761–769.
[29] Sun J, Yang Q, Wang D, et al. Nickel toxicity to the performance and microbial community of enhanced biological phosphorus removal system [J]. Chemical Engineering Journal, 2017,313:415–423.
[30] Molleman B, Hiemstra T. Surface structure of silver nanoparticles as a model for understanding the oxidative dissolution of silver Ions [J]. Langmuir, 2015,31(49):13361–13372.
[31] Loo S-L, Krantz W B, Fane A G, et al. Bactericidal mechanisms revealed for rapid water disinfection by superabsorbent cryogels decorated with silver nanoparticles [J]. Environmental Science & Technology, 2015,49(4):2310–2318.
[32] 黄 俊,衣 俊,强丽媛,等.粒径和包裹物对纳米银在海洋微藻中的毒性影响 [J]. 环境科学, 2016,37(5):1969–1977.
[33] Hsiao I L, Hsieh Y-K, Wang C-F, et al. Trojan-horse mechanism in the cellular uptake of silver nanoparticles verified by direct intra- and extracellular silver speciation analysis [J]. Environmental Science & Technology, 2015,49(6):3813–3821.
[34] Padmos J D, Boudreau R T M, Weaver D F, et al. Impact of protecting ligands on surface structure and antibacterial activity of silver nanoparticles [J]. Langmuir, 2015,31(12):3745–3752.
[35] Quan X, Cen Y, Lu F, et al. Response of aerobic granular sludge to the long-term presence to nanosilver in sequencing batch reactors: Reactor performance, sludge property, microbial activity and community [J]. Science of The Total Environment, 2015,506–507: 226–233.
[36] Zhang Z, Gao P, Li M, et al. Influence of silver nanoparticles on nutrient removal and microbial communities in SBR process after long-term exposure [J]. Science of The Total Environment, 2016,569– 570:234–243.
[37] Yang Y, Wang Y, Hristovski K, et al. Simultaneous removal of nanosilver and fullerene in sequencing batch reactors for biological wastewater treatment [J]. Chemosphere, 2015,125:115–121.
[38] Sigg L, Lindauer U. Silver nanoparticle dissolution in the presence of ligands and of hydrogen peroxide [J]. Environmental Pollution, 2015,206:582–587.
[39] Yin Y, Shen M, Tan Z, et al. Particle coating-dependent interaction of molecular weight fractionated natural organic matter: Impacts on the aggregation of silver nanoparticles [J]. Environmental Science & Technology, 2015,49(11):6581–6589.
[40] Ngamchuea K, Batchelor-McAuley C, Sokolov S V, et al. Dynamics of silver nanoparticles in aqueous solution in the presence of metal ions [J]. Analytical Chemistry, 2017,89(19):10208–10215.
[41] Yuan Z-H, Yang X, Hu A, et al. Assessment of the fate of silver nanoparticles in the A2O-MBR system [J]. Science of The Total Environment, 2016,544:901–907.
Effect of silver nanoparticles on phosphorus uptake and release of polyphosphate-accumulating bacteria and toxic effect.
YUAN Zhi-hua1,2, LIN Xiao-feng1,2, ZHOU Ting-ting1,2,3, CHEN Wen-xiang4, ZHANG Lei-feng4, ZHENG Yu-ming1,2*
(1.Key Laboratory of Urban Pollutant Conversion, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China;2.Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China;3.School of Earth and Environment, Anhui University of Science and Technology, Huainan 232001, China;4.College of Food and Biological Engineering, Jimei University, Xiamen 361021, China)., 2018,38(8):2990~2996
Silver nanoparticles (AgNPs) were obtained from the reduction of silver nitrate by sodium borohydride in the stabilizing agent of polyvinyl alcohol (PVA). The as-prepared AgNPs demonstrated an excellent property of dispersibility, with the nanoparticle size of (14±3) nm. The AgNPs were used to investigate the effect of silver nanoparticles on phosphorus uptake and release of phosphorus-accumulating bacteria (PAB) and toxic effect. The results showed that 7mg/L of AgNPs totally inhibited the growth of PAB (<0.01), and 10mg/L of AgNPs completely suppressed the phosphorus uptake ability of PAB under aerobic condition (=0.01). Under the anaerobic condition, AgNPs with concentration higher than 20mg/L only partly inhibited the phosphorus release of PAB (<0.05). The results indicated that AgNPs decreased the ROS level of PAB, and made the partial collapse of bacteria surface structure by the SEM. These revealed that AgNPs can decrease the ROS of bacteria besides the direct effect on the bacteriasurface membrane structure, which both might be the important reasons for AgNPs toxicity on PAB.
Silver nanoparticles;polyphosphate-accumulating bacteria;aerobic phosphorus uptake;anaerobic phosphorus release;toxic effect
X171.5
A
1000-6923(2018)08-2990-07
苑志华(1983–),河南周口人,助理研究员,博士,主要研究方向为纳米材料毒理和废水处理技术.发表论文20余篇.
2018-01-21
国家自然科学基金资助项目(21407142);厦门市科技计划项目(2017S0065);福建省科技计划项目(2016H0042)
* 责任作者, 研究员, ymzheng@iue.ac.cn

