肝癌临床标本原位移植模型的建立及其影像学评估*
谭邓旭 张彩勤 赵宁宁 张 贺 赵 勇 白 冰 师长宏
(第四军医大学实验动物中心,西安 710032)
肝癌是最常见的恶性肿瘤之一,死亡率高居全球前三位[1-2]。随着HBV患者逐年增多,肝癌的发病率也在不断增加[3-4]。肝癌早期诊断仍较困难[5],确诊时多为晚期,术后5年生存率也只有10%~20%[6-7]。因此建立模拟临床特征的肝癌动物模型对研究肝癌的发生机制、早期诊断、术中导航和新型治疗方法的评估具有重要的意义。
基于临床新鲜肝癌肿瘤标本建立的(patient-derived xenograft, PDX)模型,可以准确地反映患者肿瘤特性[8-9]。进一步将肿瘤组织移植到与原发部位相应动物器官的原位移植(patient-derived orthotopic xenograft,PDOX)可提供适合肿瘤生长的体内微环境;有利于肿瘤特异性抗原的表达,维持肿瘤的异质性;由于移植部位血供丰富,有利于肿瘤转移的发生。与皮下移植相比,PDOX模型更准确、客观地模拟人体肿瘤的体内演进过程,易形成与临床肿瘤相似的转移特征。因此我们拟在建立肝癌PDX模型的基础上,进一步采用原位移植的方法建立PDOX模型,通过小动物活体成像和PET/CT评估模型的特征。
1 材料与方法
1.1 实验动物
SPF级雄性NPG小鼠,5只,8周龄,体质量25~27 g,由北京维通达生物技术有限公司提供[SCXK(京)2014~0001];SPF级雄性裸鼠,20只,8周龄,体质量23~25 g,由常州卡文斯实验动物有限公司提供[SCXK(苏)2016-0010],饲养于第四军医大学实验动物中心SPF级动物设施[SYXK(陕)2014-001]。设施内温度22~24 ℃,相对湿度35%~45%,12 h昼夜交替,饮用水为高压灭菌水,动物自由摄食饮水。
本研究中的动物实验通过了第四军医大学实验动物福利及伦理委员会批准(编号:14013)。肝癌肿瘤标本(编号:C34566)来自第四军医大学第一附属医院西京医院,肿瘤标本的获取经过了患者本人及家属同意,并签署知情同意书,仅供实验研究。人体标本实验通过了西京医院医学伦理委员会的批准(批准编号:2015432)。
1.2 设备及试剂
Caliper Lumina II小动物活体成像仪(Caliper公司,美国),异氟烷麻醉剂(深圳市瑞沃德生命科技有限公司),小动物PET-CT(Mediso公司,匈牙利),光学显微镜(Olympus),近红外荧光染料IR-783由美国Cedars Sinai Medical Center Leland Chung 教授馈赠[10-11],18F-FDG由西京医院核医学科提供,基质胶购自美国BD公司,CEA和AFP抗体由英国abcam公司提供,羊抗鼠免疫组化试剂盒(康为世纪,中国),胎牛血清(浙江天杭生物科技股份有限公司,中国),苏木精和伊红染色液(北京雷根生物技术有限公司,中国),组织基因组DNA提取试剂盒(天根生化科技有限公司,中国)。
1.3 肝癌 PDX模型的建立
新鲜肝癌手术标本置于10%胎牛血清、1%青链霉素1640培养基中,用冰盒快速运输至动物房。手术器械提前高压灭菌处理。超净台内标本拿出置于一次性无菌培养皿,用剪刀将标本处理至直径1 mm左右小块与等量基质胶1∶1混匀置于冰上。异氟烷麻醉5只NPG小鼠,手持电动剃毛机将小鼠背部接种部位毛发剃除,用酒精棉消毒并去除残留毛发,将与基质胶混匀的肿瘤标本置于套管针内,于小鼠背部皮下注入,伤口用5-0缝合针线缝合,用碘伏消毒创口后放回笼盒观察,命名为P0代。
1.4 PDX模型组织病理学、肿瘤标志物IHC及STR溯源评估
待肿瘤生长至1 000 mm3(肿瘤长度(l)和宽度(w),肿瘤体积(V),计算公式为:V=1/2 ×(w2×l))左右,异氟烷麻醉生长有肿瘤组织的1只NPG小鼠,肿瘤部位剃毛,酒精消毒后做表皮切口,取肿瘤组织置于一次性无菌培养皿,伤口重新缝合并消毒后放回饲养笼盒。将取出的肿瘤组织分为三份:一份用4%多聚甲醛固定,做病理及相关肿瘤标志物IHC检测使用;一份使用DNA提取试剂盒提取基因组DNA,酶标仪测定DNA浓度为100 ng/mL,然后用蒸馏水稀释至5 ng/mL,送至第四军医大学司法鉴定中心进行STR(short tandem repeat)溯源检测;第三份肿瘤组织保证无菌,将其切成1 mm3肿瘤块以备PDX传代和PDOX模型制备使用。异氟烷麻醉生长有肿瘤组织的其余4只NPG小鼠,取出肿瘤组织用于组织冻存以及在10只裸鼠皮下的传代。
组织病理学观察:将4%多聚甲醛固定超过24 h的肿瘤标本,进行石蜡包埋切片,HE染色封片晾干,光学显微镜下观察。
肝脏肿瘤标志分子(AFP、CEA)的IHC检测:组织切片二甲苯完全脱蜡;抗原修复;Hydrogen Peroxide Block 中孵育 10~15 min降低内源性过氧化物酶;滴加 Ultra V Block封闭非特异性的背景染色;一抗AFP、CEA 分别37 ℃孵育2 h,加入二抗(羊抗鼠)室温孵育20 min,DAB显色后,苏木精复染脱水透明封片晾干,光学显微镜下观察。
1.5 肝癌PDOX模型的建立
离体肿瘤组织在一次性无菌平皿修剪尽可能小,36 ℃胶原蛋白酶和分散酶消化肿瘤组织20 min,期间每5 min震荡混匀一次,加入血清终止消化,1 000 r/min离心去上清后加入基质胶和少量1640培养基悬浮肿瘤组织置于冰面。异氟烷麻醉10只裸鼠,仰卧固定,上腹部消毒;于小鼠剑突下缘处做1 cm横向切口,充分暴露肝脏;用钝头镊子将一页肝小心牵拉出体外,将悬浮肿瘤组织吸入5 mL注射器内,肝脏穿刺并注入适量悬浮肿瘤组织,撤离针头迅速用无菌脱脂棉按压。小心将肝脏放回体内,缝合腹壁和表皮,伤口消毒置回笼盒,完成组织悬液PDOX模型制作。
1.6 肝癌PDOX模型的活体成像及肿瘤组织形态学观察
肝癌PDOX模型建立4周后,对模型鼠进行腹腔注射NIRF染料IR-783(100 μmol/L,100 μL/只),24 h后通过Caliper Lumina II小动物活体成像仪检测模型鼠肝脏部位的肿瘤荧光信号。
解剖分离脏器和肿瘤分别进行成像,查看染料在小鼠脏器和肿瘤各部位的分布情况。最后将肝脏的肿瘤部分用4%多聚甲醛固定后,做组织病理学HE染色观察。
1.7 肝癌PDOX模型PET/CT检测
将肝脏部位有明确荧光信号的模型鼠送至西京医院核医学科进行小动物PET/CT检测。模型鼠尾静脉注射18F-FDG显影剂150~200 μCi/只,注射后体内代谢1 h[10-11],再使用异氟烷呼吸麻醉裸鼠后进行PET/CT 全身扫描; 扫描结束后3D图像的构建利用Nuclinenano Scan软件(Mediso公司)完成。
2 结果
2.1 肝癌 PDX肿瘤组织STR溯源检测和组织形态病理结果
选取16个人源化STR位点联合检测。检测结果显示,该16个人源化位点均被检出(图1A),可以确定该肿瘤的人源性。PDX组织H&E染色见图1B,患者源发肿瘤和PDX进行比较,组织形态基本相似:细胞呈现多面体形;细胞核居中,大且圆,部分可见双核,常染色质丰富,符合肝癌组织病理特征。肝癌特异性标志物AFP和CEA在原发瘤和移植瘤中均阳性表达,提示PDX模型较好地保存了原发瘤的遗传和病理学特征。
2.2 肝癌PDOX模型的活体成像结果
图2A显示了小动物活体成像仪检测的近红外荧光染料IR-783成像结果。IR-783在24 h后在肝脏部位富集,荧光信号只是在肿瘤部位显像,并不是整个肝脏区域均有荧光信号。
PET/CT检测后麻醉处死模型鼠,取心、肝、脾、肺、肾等脏器组织进行近红外荧光成像,图2C中明显可见IR-783染料主要富集在肝脏下缘的肿瘤部位,肝、肾等主要的代谢器官无富集。
制备的10只裸鼠肝癌PDOX模型,在成像结束后,将模型鼠安乐死后解剖发现,其中有两只裸鼠接种的肿瘤生长在腹腔内壁,其余8只均生长在裸鼠的肝脏中。模型制备成功率为80%左右(8/10=80%)。
2.3 PET/CT评估PDOX建模状况
PET/CT检测结果如图2B所示,除脑、心、肺、脊柱、膀胱显示较强信号,这些部位显示信号强是由于糖代谢水平高。此外,小鼠肝脏部位局部也可见明显信号(见图2B中红色圆圈 处),此信号部位即为肝肿瘤部位。
2.4 肝癌PDOX模型的组织形态观察
组织块直接植入后可见肿瘤组织生长于小鼠肝脏,表面可见光滑包膜,边缘较清晰,未见弥漫生长,无可见转移灶。组织病理形态观察,肿瘤边界较清晰,正常肝脏内肿瘤细胞浸润不明显,图3中红色箭头所指区域即是原位移植的局限性生长的肿瘤。
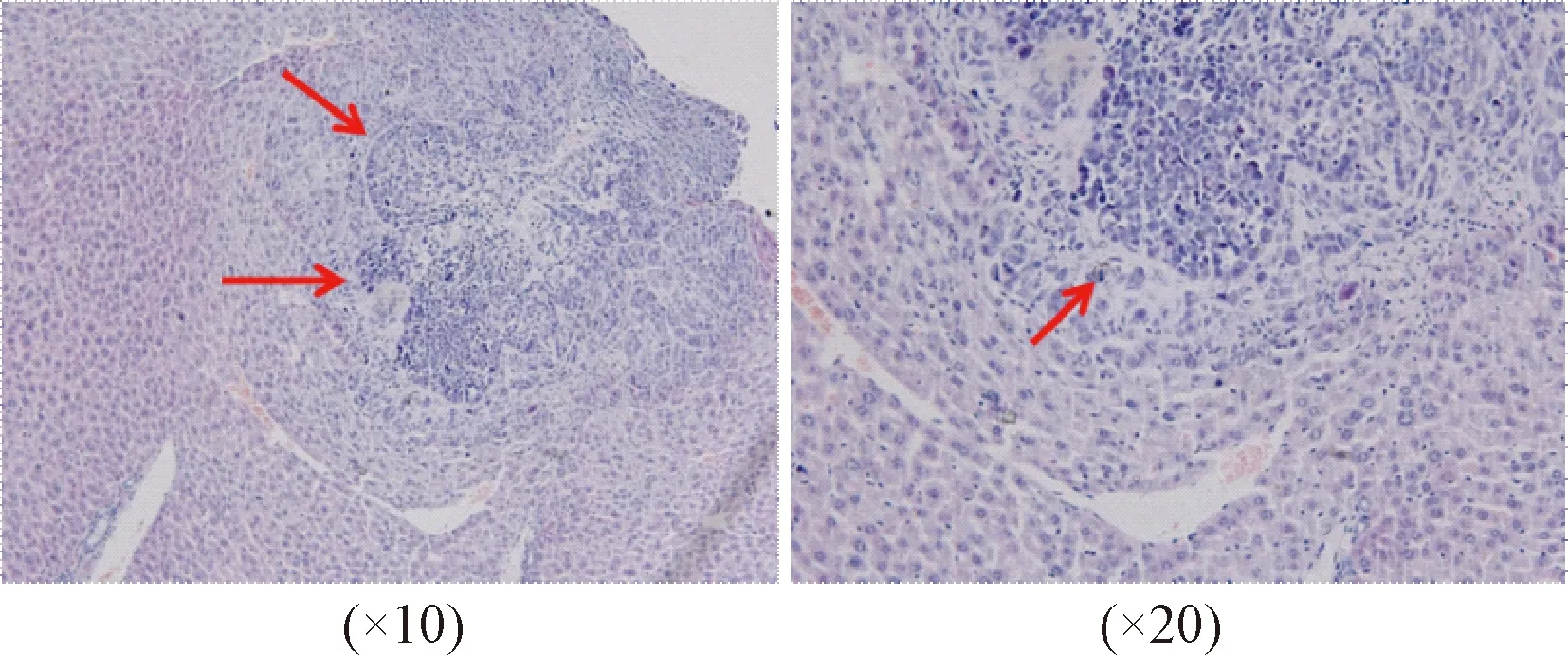
图3 肝癌PDOX模型肿瘤样本的HE染色结果Fig.3 HE staining results of PDOX tumorsample from liver cancer
3 讨论
成功建立的PDX模型必须确保与原发瘤的组织形态和遗传特征相似。本研究使用肝癌患者新鲜肿瘤标本建立了皮下移植模型,分别从组织病理形态、肿瘤标志物和STR分型对移植瘤组织进行了分析,确认了与原发瘤的相似性,明确肝癌PDX模型的成功建立(见图1)。进一步将PDX模型的瘤组织进行原位移植,提供与原发瘤相似的生长环境,有利于肿瘤特异性抗原的表达,维持肿瘤的异质性,采用HE染色的方法确认了组织形态的一致性(见图3)。
与皮下移植瘤不同,肝脏原位移植瘤无法用肉眼观察,只能等到动物发生明显的体征后才能确认肿瘤的发生。而小动物分子影像技术则提供了有效方法对脏器内肿瘤进行有效评估,如MRI、PET和近红外荧光(near infrared fluorescence,NIRF)活体成像。相比于前两种方法,NIRF 活体成像特异性强,背景干扰小,方便直观。常规NIRF技术通过将NIRF染料标记肿瘤特异性的靶向片段,使用光学设备检测生物体内荧光信号,可实现对癌细胞的实时监测。PDX模型由于是瘤组织移植,无法进行特异性标记。我们实验室与美国的Leland W.K. Chung教授合作发现一类七甲川菁(Heptamethine cyanine)近红外荧光染料,如IR-783和MHI-148可特异性识别肿瘤细胞,不需标记探针可直接用于肿瘤模型的活体成像,具有成像和靶分子的双重功能[11]。先前的研究中证实了该类染料具有多种肿瘤的靶向性,如前列腺癌、乳腺癌、肾癌等[10-12],其靶向机制可能是有机阴离子转运肽(organic anion-transporting peptides,OATPs)介导了该类染料的吸收[13]。本研究结果表明在原位移植30 d后,通过腹腔注射IR-783可以清晰观察到肝脏部位荧光信号的聚集,进一步通过离体实验确认肝脏肿瘤的发生(见图2)。
小动物PET用于脏器内肿瘤检测具有良好的灵敏度。本研究将功能代谢显像(PET)和组织结构显影(CT)两种分子影像技术结合起来进行PET/CT双模态成像系统。由于肿瘤细胞代谢旺盛,糖代谢水平高于正常肝组织,静脉注射18F标记的氟代脱氧葡萄糖(fluorodeoxyglucose,FDG)。肿瘤对标记核素的高摄取通过PET/CT显像可准确判断肿瘤位置甚至肿瘤大小[14-15]。PET/CT显像结果显示,除了代谢旺盛器官如脑、心、脊柱等之外,在腹部肝区,明显看到核素富集,轮廓清晰,区别于正常肝组织(见图2B)。定期进行PET/CT检测,可以准确判定肿瘤生长转移等情况,实现对模型动物体内肿瘤的实时监测。
综上所述,本研究中建立的肝癌PDOX模型,较好地保留了原发病人的肿瘤特异性和异质性,是进行肝癌发病机制研究以及治疗药物筛选研究的良好动物模型。

