骨髓间充质干细胞对小鼠骨髓抑制模型造血功能的影响
郑佳琳,黄小红,武 昕,黄小琼,曾素丹,邝少松
(广东省医学实验动物中心,广东佛山528248)
骨髓抑制是化疗最常见的毒副作用之一,不但影响了治疗的连续性,而且严重的骨髓抑制可引起明显的白细胞、血小板、红细胞减少,导致患者易感染和出血,甚至死亡[1]。从某种意义上来说,对骨髓抑制的控制是化疗成功与否的关键[2]。为了最大限度的杀伤肿瘤细胞,同时又能最大程度减轻化疗药物的毒性作用,快速地恢复机体的造血功能,造血干细胞和骨髓间充质干细胞移植技术已开始越来越多地用于临床[3],骨髓间充质干细胞扩增能力强,免疫原性低,多向分化潜能在体内外都已得到充分证明,在移植治疗肝损伤、心肌梗死、脊髓损伤等产生了良好的治疗效果[4]。本研究通过建立小鼠骨髓移植模型,探讨小鼠骨髓间充质干细胞联对环磷酰胺诱导严重骨髓损伤小鼠造血功能的影响。
1 材料和方法
1.1 实验动物及实验环境
SPF级BALB/c小鼠,雄性,体重18~22 g,购于广东省医学实验动物中心 〔SCXK (粤)2013-0002〕。动物饲养在广东省医学实验动物中心SPF级动物房〔SYXK(粤)2013-0002〕。 夜间断照明;饲养室条件始终保持稳定,以保证试验结果的可靠性。自由进食饮水,饲料和动物饲养条件:5只/箱,群养,饲养温度与湿度:20~26℃,40~70%,采用10h:14h昼饮用水均由广东省医学实验动物中心提供。
1.2 主要试剂与仪器
环磷酰胺(CTX)、重组人粒细胞集落刺激因子注射液(rhG–CSF),细胞周期试剂盒;JEA3001系列电子天平、BCD-5000全自动血液细胞分析仪、BD AccuriC6流式细胞仪。
1.3 细胞培养
体外大量培养小鼠骨髓间充质干细胞,选择处于对数生长期及状态良好的细胞进行给药治疗。
1.4 动物造模
将检疫合格的40只雄性BALB/c小鼠按照体重随机分为空白对照组、模型对照组、阳性对照组、小鼠骨髓间充质干细胞组,每组10只。除空白对照组外,其余小鼠腹腔注射环磷酰胺20 mg·kg-1·d-1,1 次/d,连续 7 d,诱导小鼠产生骨髓抑制。
1.5 动物给药
末次给予环磷酰胺次日,小鼠骨髓间充质干细胞组一次性尾静脉注射1.0×107个小鼠骨髓间充质干细胞;阳性对照组小鼠腹腔注射 125 μg·kg-1·d-1 rhG–CSF,空白对照组和模型对照组灌胃给予等量纯净水,每天1次,连续给药7天。
1.6 外周血血常规检查
分别于实验第8,10,14天,取尾静脉血20 μL置于130 μL肝素抗凝稀释液中,充分混匀。用Mek-7222k型全自动血球计数仪检测小鼠外周血白细胞、淋巴细胞、红细胞、血红蛋白、红细胞压积和血小板的变化。
1.7 骨髓有核细胞悬液的制备及有核细胞计数
实验第14天颈椎脱臼处死各组小鼠,取出右侧股骨,除净软组织,用6号针头以1 mL PBS冲出骨髓细胞,200目筛网过滤后裂解红细胞,将单个骨髓细胞悬液1000 r/min离心5 min,去上清,用预冷PBS洗涤2次,弃上清,用 PBS定容至5 mL。按白细胞计数法进行骨髓有核细胞计数。并计算绝对数量。
1.8 骨髓有核细胞细胞周期的分析测定
取上述制备好的骨髓单核细胞悬液1000 r/min离心5 min,弃上清,加入70%预冷乙醇固定打散细胞,4℃固定过夜,用 PBS将上述细胞洗 2次,加 100 μL PBS 混匀,加 PI染液(4℃,避光 30 min),以标准程序用流式细胞仪检测细胞周期的变化,一般计数1~2万个细胞,结果用软件FlowJo7.6分析细胞周期。结果以细胞周期各时相细胞百分率表示,并按以下公式计算细胞增殖指数 (proliferation index,PI):PI=(S+G2/M)/(G0/G1+S+G2/M)×100%。
1.9 骨髓组织病理学检查
取小鼠左侧股骨固定、脱钙,石蜡切片苏木精-伊红染色,观察股骨骨髓组织形态学变化。
1.10 统计方法
2 结果
2.1 骨髓间充质干细胞对骨髓抑制小鼠外周血象的影响
与空白对照组比较,实验第8天,其余各组小鼠外周血中白细胞、淋巴细胞、红细胞、血小板数和血红蛋白、红细胞压积值均显著降低 (P<0.05),证明造模成功。实验第14天,模型组小鼠的白细胞、淋巴细胞、血小板数和血红蛋白、红细胞压积值均有所升高,但仍均显著低于空白对照组(P<0.05)。
与模型对照组比较,实验第10天(即治疗第3天),阳性对照组和小鼠骨髓间充质干细胞组的白细胞、淋巴细胞、红细胞、血小板数和血红蛋白、红细胞压积值均开始升高,到实验第14天(即治疗第7天),逐渐恢复正常水平;其中,小鼠骨髓间充质干细胞组白细胞数目与血红蛋白在实验第10天,白细胞数目、血红蛋白与红细胞压积值在实验14天均显著升高(P<0.05);结果见表1和表2。
表1 各组小鼠白细胞、淋巴细胞与红细胞的比较(±s,n=10,♂)
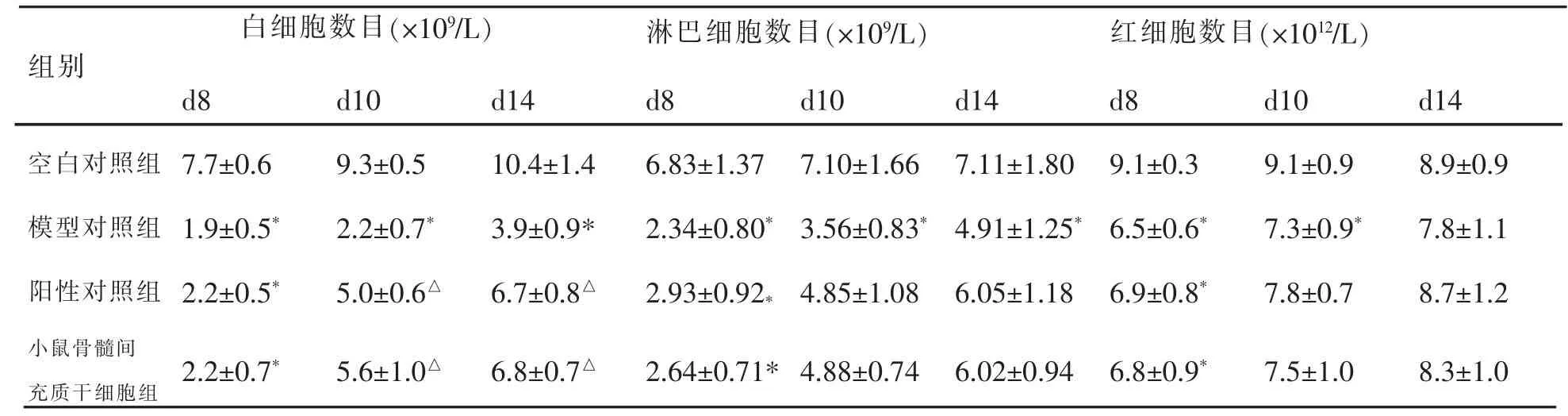
表1 各组小鼠白细胞、淋巴细胞与红细胞的比较(±s,n=10,♂)
注:与空白对照组比较,*P<0.05;与模型组比较,△P<0.05。
组别白细胞数目(×109/L) 淋巴细胞数目(×109/L) 红细胞数目(×1012/L)d8 d10 d14 d8 d10 d14 d8 d10 d14空白对照组 7.7±0.6 9.3±0.5 10.4±1.4 6.83±1.37 7.10±1.66 7.11±1.80 9.1±0.3 9.1±0.9 8.9±0.9模型对照组 1.9±0.5* 2.2±0.7* 3.9±0.9* 2.34±0.80* 3.56±0.83* 4.91±1.25* 6.5±0.6* 7.3±0.9* 7.8±1.1阳性对照组 2.2±0.5* 5.0±0.6△ 6.7±0.8△ 2.93±0.92*4.85±1.08 6.05±1.18 6.9±0.8* 7.8±0.7 8.7±1.2小鼠骨髓间充质干细胞组 2.2±0.7* 5.6±1.0△ 6.8±0.7△ 2.64±0.71* 4.88±0.74 6.02±0.94 6.8±0.9* 7.5±1.0 8.3±1.0
表2 各组小鼠的血小板数目、血红蛋白与红细胞压积值比较(±s,n=10,♂)
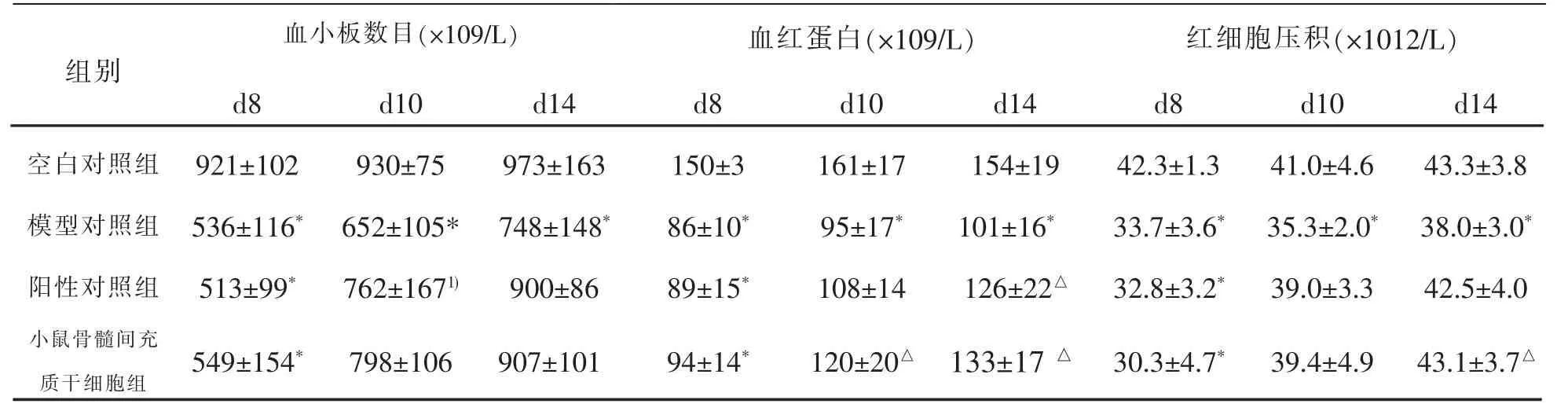
表2 各组小鼠的血小板数目、血红蛋白与红细胞压积值比较(±s,n=10,♂)
注:与空白对照组比较,*P<0.05;与模型组比较,△P<0.05。
血小板数目(×109/L) 血红蛋白(×109/L) 红细胞压积(×1012/L)d8 d10 d14 d8 d10 d14 d8 d10 d14空白对照组 921±102 930±75 973±163 150±3 161±17 154±19 42.3±1.3 41.0±4.6 43.3±3.8模型对照组 536±116* 652±105* 748±148* 86±10* 95±17* 101±16* 33.7±3.6* 35.3±2.0* 38.0±3.0*阳性对照组 513±99* 762±1671) 900±86 89±15* 108±14 126±22△ 32.8±3.2* 39.0±3.3 42.5±4.0组别小鼠骨髓间充质干细胞组 549±154* 798±106 907±101 94±14* 120±20△ 133±17 △ 30.3±4.7* 39.4±4.9 43.1±3.7△
2.2 骨髓间充质干细胞对骨髓抑制小鼠骨髓有核细胞的影响
与空白对照组比较,模型对照组小鼠骨髓有核细胞(BMC)数量显著降低(P<0.05);与模型对照组比较,阳性对照组和小鼠骨髓间充质干细胞组均可以显增加骨髓抑制小鼠的骨髓BMC数量(P<0.05);结果见表3。
2.3 骨髓间充质干细胞对骨髓抑制小鼠骨髓细胞周期变化的影响
与空白对照组比较,造模后骨髓细胞细胞周期出现了停滞的状态,模型组小鼠G0/G1期细胞显著增加,S期和G2/M期细胞均显著减少,细胞增殖指数(PI)显著降低(P<0.05)。
与模型对照组比较,阳性对照组和小鼠骨髓间充质干细胞组均能解除 G0/G1期细胞阻滞,促进G0/G1期细胞进入增殖周期,使G2/M期细胞增加,增加骨髓抑制小鼠骨髓细胞的增殖指数(P<0.05);结果见表3。
表3 各组小鼠骨髓有核细胞数和细胞周期的比较(±s,n=10,♂)
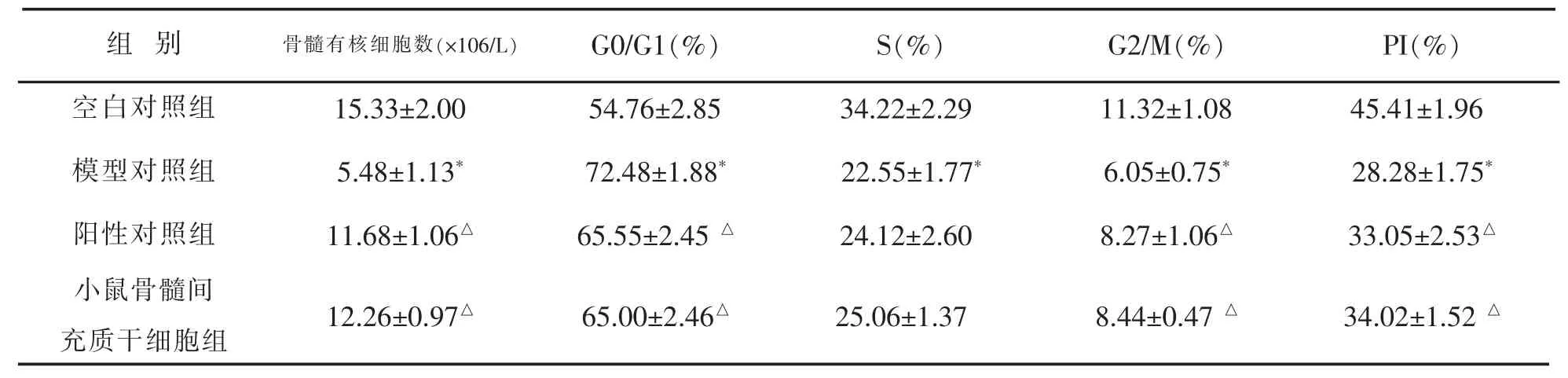
表3 各组小鼠骨髓有核细胞数和细胞周期的比较(±s,n=10,♂)
注:与空白对照组比较,*P<0.05;与模型组比较,△P<0.05。
组 别 骨髓有核细胞数(×106/L) G0/G1(%) S(%) G2/M(%) PI(%)空白对照组 15.33±2.00 54.76±2.85 34.22±2.29 11.32±1.08 45.41±1.96模型对照组 5.48±1.13* 72.48±1.88* 22.55±1.77* 6.05±0.75* 28.28±1.75*阳性对照组 11.68±1.06△ 65.55±2.45△ 24.12±2.60 8.27±1.06△ 33.05±2.53△小鼠骨髓间充质干细胞组 12.26±0.97△ 65.00±2.46△ 25.06±1.37 8.44±0.47△ 34.02±1.52△
2.4 骨髓间充质干细胞对骨髓抑制小鼠骨髓组织病理学的影响
各组小鼠骨髓病理切片见图A~D。空白对照组小鼠骨髓造血细胞比例正常且分布均匀,未见明显的脂肪组织(图A);模型对照组小鼠骨髓腔充满脂肪组织,出现大量空白区,,造血细胞残余少量,成熟红细胞增多(图B);阳性对照组(图C)、小鼠骨髓间充质干细胞组(图D)小鼠的骨髓抑制均有所改善,病理切片可见脂肪细胞明显减少,造血细胞增生且比例未见异常,成熟红细胞数量正常。
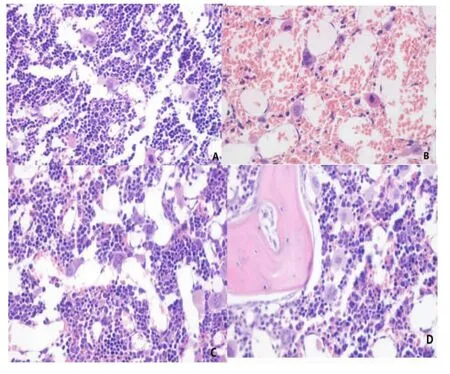
图A~D各组小鼠骨髓病理切片HE染色(×400)
3 讨论
环磷酰胺是临床上常用的抗肿瘤药物之一,主要用于血液系统及各种实体肿瘤的治疗[5]。但是由于环磷酰胺是一种细胞周期非特异性细胞毒药物[5],在抑制肿瘤细胞增殖的过程中也会影响正常细胞的增殖与分化,从而引起骨髓抑制等诸多不良反应。大剂量连续腹腔注射环磷酰胺,常用于动物实验中制备骨髓抑制模型。
骨髓间充干细胞具有高增殖和多向分化潜能,易于采集、分离纯化和体外扩增,在细胞治疗、基因治疗中具有广泛的应用前景。近年来证实,骨髓间充干细胞除具有促进造血干细胞移植后造血重建外,还具有免疫调节作用,防治移植物抗宿主病[6]。
本研究观察了小鼠骨髓间充干细胞对小鼠骨髓抑制模型的造血功能的影响,结果表明,与模型对照组比较,小鼠骨髓间充质干细胞能促进骨髓造血细胞进入细胞增殖周期,G0/G1期细胞比例降低,G2/M期细胞比例升高,提高细胞增殖率和造血细胞比例的作用。以上结果提示,小鼠骨髓间充干细胞能够拮抗环磷酰胺对骨髓细胞的抑制作用,提高骨髓细胞的增殖和外周血象,促进造血功能恢复,有利于缓解骨髓抑制病征。

