Indian Hedgehog 表达量在大鼠骨关节炎早期变化的研究
王春理 边森 李刚 赵瑞鹏 石一李鹏翠 卫小春
作者单位:030001 太原,山西医科大学第二医院骨科实验室
骨关节炎 ( osteoarthritis,OA ) 是一种中老年人常见的关节退行性病变,临床表现为关节疼痛、僵硬、肿胀和畸形等。大多数患者确诊时已为 OA 晚期,只能进行人工关节置换术,给家庭、社会带来沉重的负担[1]。早期诊断预测 OA 的发生,人为干预OA 的进展,有助于 OA 的早期治疗[2]。
虽然有研究表明 OA 的发病与增龄、创伤、负重、遗传等因素密切相关,但具体发病机制目前仍不清楚[3-6]。有研究认为,OA 的发病是各因素导致的关节软骨的异常分化,这种分化类似于胚胎期软骨内成骨和发育期骨骺生长板软骨内成骨过程中关节软骨的终末分化[5]。在软骨内成骨的过程中,软骨细胞经历增殖、成熟、终末分化 ( 肥大化、骨化、凋亡自噬 ) 的过程。肥大软骨细胞表达十型胶原 ( type X Collagen,COL X ) 和基质金属蛋白酶( matrix metalloproteases,MMPs ) 来诱导软骨降解[7],它们被认为是典型的肥大化的标志物。关节的透明软骨与软骨内成骨过程中的透明软骨具有同源性。而在正常成年人的关节软骨内软骨细胞成熟后并不会出现肥大化等终末分化的改变[5-6],这种肥大化的表达却会在成年 OA 软骨中发生。
印度豪猪 ( Indian hedgehog,Ihh ) 蛋白主要由前肥大软骨细胞合成和分泌,调节生长板软骨细胞的肥大化和软骨内成骨的过程[8]。前肥大细胞分泌的 Ihh 蛋白与软骨细胞的跨膜受体 patched 1 ( Ptch1 )结合,使原本与 Ptch1 紧密结合的跨膜蛋白的Smoothened ( Smo ) 解除抑制,激活 Hh 通路,激活了下游转录因子 Gli1、2、3 的活性,活化的转录因子转移入细胞核,激活相应的靶基因表达,从而促进软骨细胞肥大化的进程[8]。在生长板软骨细胞,Ihh可以通过激活 Gli 来诱导 Runx2 表达,促进软骨细胞肥大化[9]。因此,Hh 信号通路的激活有一系列下游基因的参与,检测这些基因的表达也可反映 Hh 信号通路的活性[10]。
前期有研究者运用基因鼠发现,激活 Hh 信号通路会导致关节软骨厚度变薄且蛋白多糖含量减少,而抑制 Hh 信号通路则导致相反的结果[8],上调 Hh 信号通路的活性会加重关节退变和软骨细胞肥大化的程度[11]。对人膝关节 OA 的研究发现,Ihh促进了软骨细胞肥大化,并且增加了 MMP-13 的的表达[3];条件性敲除 Ihh 基因可延缓小鼠 OA 的进程[12]。因此,在人和鼠中,Ihh 都发挥了促进 OA 进展的作用。近期有直接证据表明,在人膝软骨损伤早期,关节滑液中 Ihh 的浓度与关节软骨的损伤程度相关[13]。据此推断,滑液中 Ihh 可能成为早期发现软骨损伤新的生物标记物[13-14]。但 Ihh 在损伤后随时间进展中的表达情况尚不清楚,且抽取滑液对关节损伤较大,作为预防诊断的实用性较差。
本实验探究大鼠创伤性骨关节炎 ( PTOA ) 早期进展中 Ihh 表达量的变化情况,探讨 Ihh 作为生物标志物早期预测 OA 的可能性。
材料与方法
一、实验对象与分组
3 月龄健康雄性 SD 大鼠 ( 山西医科大学动物中心 ) 80 只,重量 ( 120±20 ) g,采用数字随机表法分为 8 组:伪手术组 ( Sham 组 )、实验 1 天组、实验3 天组、实验 7 天组、实验 2 周组、实验 4 周组、实验 2 个月组、实验 3 个月组,每组 10 只。每组大鼠实验前体重用单因素方差分析,组间差异无统计学意义。
二、实验方法
1. PTOA 大鼠模型的建立[15]:所购大鼠适应环境 5 天,实验组行前交叉韧带切断术 ( ACLT ),Sham 组仅打开关节囊。术前 1 天备物 ( 高压灭菌烘干 )。10% 的水合氯醛 ( 0.3 ml / 100 g ) 腹腔注射麻醉,待大鼠睫毛反射消失、肌松程度良好,即达到麻醉状态。碘伏消毒 3 次、铺单、暴露右膝,固定大鼠右膝伸直位,提拉膝部皮肤、切开,沿髌骨内侧缘打开关节囊约 2 cm,抽屉试验确定无胫骨移位,切断前交叉韧带。检查抽屉试验有明显胫骨向前移位,视为造模成功。生理盐水冲洗关节腔,缝合关闭关节囊,皮肤外翻缝合,术后注射青霉素4 U。术后连续 3 天腹腔注射青霉素 ( 4 U / 次,1 次 /日 ),并观察伤口有无出血、感染、撕咬开线等不良情况,及时处理。
2. 取材与保存:ACLT 组各组大鼠依时间点处理:10% 水合氯醛 ( 2 ml / 只 i.p ) 麻醉,心脏取血4~5 ml,追加麻醉处死大鼠,分离右后肢,摄 X 线片;6 只分离胫腓骨,刮取关节软骨放入 EP 管 ( 装有 2.5 ml EDTA ),-80 ℃ 条件保存;其余 4 只膝关节剥除多余软组织,用于组织切片。血样冰上静置30 min,离心 ( 4000 rmp、r=10 cm,10 min ),取上层血清于 2.5 ml EP 管,-80 ℃ 条件保存。Sham 组每对应时间点随机处理 1 只,摄 X 线片、取血样,刮取软骨,最后时间点全部处理,留取关节,标本保存条件同上。各阶段样本统一处理。
3. 右膝摄 X 线片:用小动物 X 线机扫描分离的右后肢,摄取正、侧位 X 线片,保持每次摄取固定位置相同。
4. 印度墨水染色:10 ml 印度墨水+10 ml 蒸馏水配成染液,剥离软组织的关节软骨浸于染液中 5 min,流动水冲洗 3 min,显微镜下拍照观察,印度墨水染色按照改良 Mankin’s 评分评价损失程度[16]。
5. RT-PCR 检测:液氮条件下研磨软骨组织为粉末状,trizol 法提取细胞总 RNA,NanoDrop 2000检测 RNA 量和纯度。用逆转录试剂盒 ( PrimeScriptTMRT Master Mix Takara ) 将 RNA 逆转录为 25 μl 体系的cDNA,以 5 μl 分装保存。以 cDNA 为模板,利用扩增试剂盒 ( SYBR Premix Ex Taq TM II Takara ) 进行PCR 扩增反应,BIO-RAD IQ5 软件分析结果。扩增引物见表 1,扩增条件如下:预变性 95 ℃ 10 min;接着 40 个循环:95 ℃ 10 s、59 ℃ 30 s、72 ℃ 30 s,退火温度因基因调整,各样本设 2 个副孔,mRNA相对表达量用 2-ΔΔCt 表示。
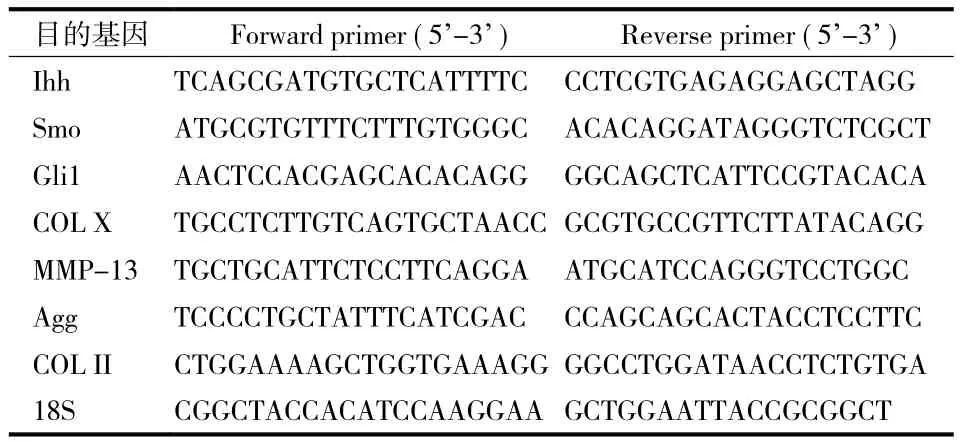
表1 RT-PCR 扩增引物序列Tab.1 Primer sequences used in RT-PCR
6. 酶联免疫吸附试验 ( ELISA ):室温解冻全部血清,用 Ihh 的 ELISA 试剂盒 ( 武汉优尔生生物有限公司 ) 定量检查血清中 Ihh 浓度,严格依照试剂盒说明操作,450 nm 滤光片检测样品吸光度值,用CurveExpert 软件拟合最优标准曲线,利用吸光度值推算浓度。
7. 组织学切片:各组关节放入 4% 多聚甲醛( 大于样本的 4 倍体积 ) 固定 3 天,超声脱钙机脱钙1 个月 ( 每 7 天更换脱钙液 ),用脱水机梯度酒精脱水、浸蜡 ( 70% 2 h、75% 2 h、80% 2 h、85% 2 h、90% 2 h、95% 16 h、100% 40 min、100% 40 min、二甲苯 20 min、二甲苯 20 min、浸蜡 3 h、浸蜡2 h ),石蜡包埋。标本切为 4 μm 厚的石蜡切片,烤片备用。
8. 免疫组化:预先烤片后 30 min,切片脱蜡水化 ( 二甲苯 10 min、二甲苯 10 min、无水乙醇2 min、无水乙醇 2 min、95% 乙醇 2 min、95% 乙醇2 min )。用磷酸盐缓冲液 ( PBS ) 浸洗 ( 3 次,3 min /次 ),3% H2O2浸片 ( 室温 避光 10 min ),PBS 浸洗,抗原修复 ( 复合消化液 37 ℃ 30 min ),PBS 浸洗,血清封闭抗原 ( 室温 30 min ),滴加一抗 ( sc-1196 santa cruz 稀释比例 1∶500 ),4 ℃ 过夜 ( 对照组用PBS ),PBS 浸洗,滴加二抗 ( cs-2354 HRP 标记驴抗山羊 IgG 二抗 1∶1000 ) 37 ℃ 孵育 40 min, DAB 显色,OLIMPUS 显微镜拍照。
9. 番红 O 观察软骨的损伤程度及糖胺多糖的含量:切片脱蜡水化,用苏木素浸染 ( 1 min )、蒸馏水洗 ( 2 次,3 min / 次 ),滴盐酸酒精 10 s,蒸馏水洗( 2 次,3 min / 次 ),fast green ( 6 min ),1% 乙酸滴洗<10 s,番红 O 6 min,脱水封片观察。
三、统计学处理
使用 Graph Pad Prism5 软件进行统计学分析,结果采用±s表示,实验组多组数据比较采用单因素方差分析,各组数据间的组间比较用 Tukey 检验法,P<0.05 为差异有统计学意义。
结 果
一、抽屉试验、X 线证实 PTOA 造模成功
术中做抽屉试验对比前后活动度,出现明显胫骨前移,可认为前交叉韧带已经断裂。取样后拍摄 X 线片发现:4 周组膝关节周围开始出现骨质硬化;3 个月组观察到关节间隙狭窄、关节周围骨质硬化、关节面毛糙、关节边缘骨赘生成 ( 图 1 )。
二、关节软骨内 Ihh 及下游基因的 mRNA 相对表达量在 7 天组显著升高
关节软骨中 Ihh 的 mRNA 相对表达量在 ACLT组中总体高于 Sham 组。在术后早期 ( 4 周内 ) 出现显著表达升高,7 天组最高;7 天组的 mRNA 相对表达量显著高于 Sham 组、1 天组、3 个月组 ( 表 2,图 2 ),差异有统计学意义 ( P<0.05 )。Hh 信号通路下游分子:Smo、Gli1 的 mRNA 相对表达量,都出现类似的表达峰值。

图1 右膝关节正侧位 X 线:Aa、Bb、Cc 分别为 Sham 组、4 周组、3 个月组的 X 线片Fig.1 The anteroposterior and lateral radiographs of the right knee. Aa, Bb and Cc were the X-ray films of the Sham group, 4-week group and 3-month group respectively
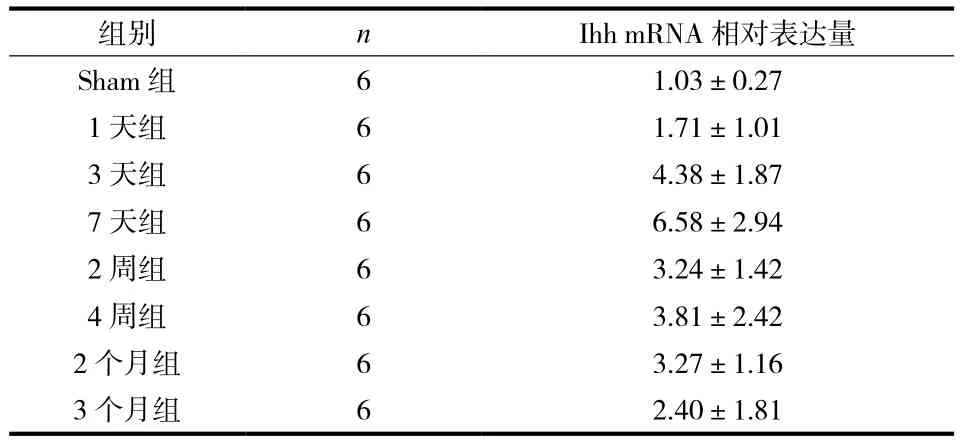
表2 各组 Ihh 的 mRNA 相对表达量Tab.2 The relative mRNA expressions of Ihh in each group
三、关节软骨内 Ihh 蛋白在 3 天组、7 天组含量升高

图2 各组大鼠关节软骨 Ihh、Smo、Gli1 的 mRNA 相对表达量 ( aP < 0.01,bP < 0.05;n = 6 )Fig.2 The relative mRNA expressions of Ihh, Smo, Gli1 of rat cartilage in each group ( aP < 0.01, bP < 0.05; n = 6 )
免疫组化可见 3 天组和 7 天组胞内棕色颗粒明显增多,超过细胞总数的 50%,且颜色加深呈深褐色;3 个月组时软骨表面破损明显,软骨细胞减少,软骨陷窝增大,正是软骨退化的典型表现,但胞内棕色颗粒数目减少,低于细胞总数的 20%,且颜色较浅。可见关节软骨内 Ihh 蛋白含量在 3 天组、7 天组表达量升高,3 个月组又出现下降 ( 图 3 )。

图3 关节软骨中 Ihh 蛋白表达量 ( 免疫组化 × 40 ),蓝紫色为细胞核,棕黄色颗粒即 Ihh 蛋白Fig.3 Ihh expression in cartilage immunohistochemical figure ( × 40 ), the nuclei were purple; The brown-yellow particles were Indian hedgehog proteins
四、血清中的 Ihh 蛋白浓度的在 3 天组、7 天组显著升高
血清中 Ihh 蛋白浓度在进展早期 ( 3 天组、7 天组、2 周组、4 周组 ) 显著升高,在晚期 ( 3 个月组 )下降 ( 表 3、图 4 )。组间多重比较:3 天组与 3 个月组、7 天组与 Sham 组、7 天组与 3 个月组间差异有统计学意义 ( P<0.05 )。

表3 各组血清中的 Ihh 浓度Tab.3 Concentrations of Ihh in surum in each group
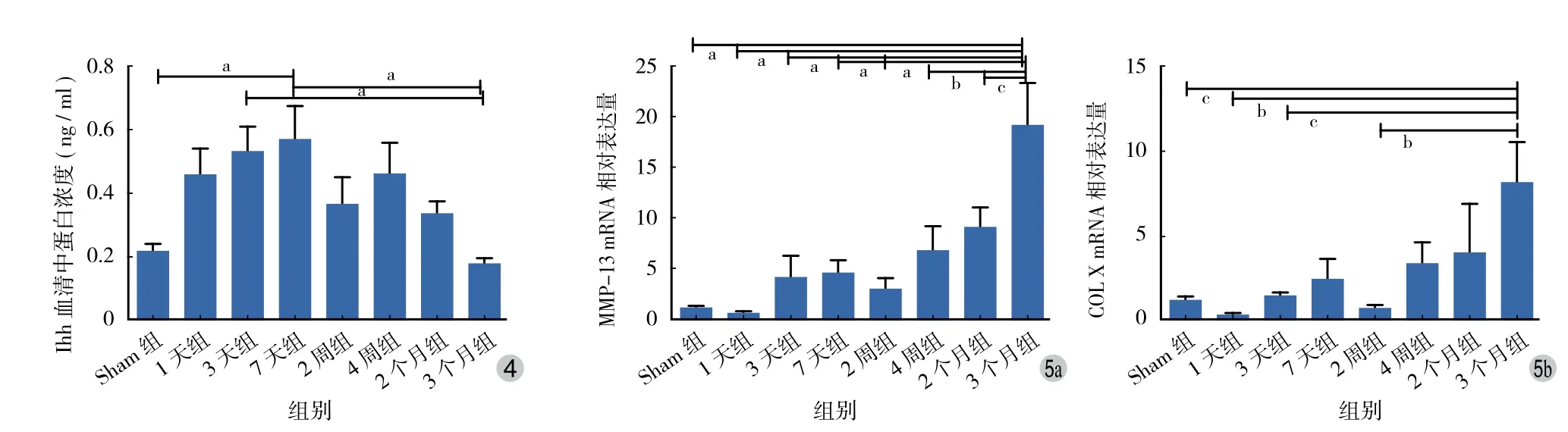
图4 ELISA 检测血清中 Ihh 蛋白含量 ( aP < 0.05;n = 10 )图5 各组大鼠关节软骨的 MMP-13、COL X 的 mRNA 相对表达量 ( aP < 0.001,bP < 0.01,cP < 0.05;n = 6 )Fig.4 Ihh concentration in surum measured by ELISA ( bP < 0.05; n = 10 )Fig.5 The relative mRNA expressions of MMP-13, COL X in rat cartilage in each group ( aP < 0.001, bP < 0.01, cP < 0.05; n = 6 )
五、MMP-13 和 COL X 的 mRNA 相对表达量在3 个月组升高
关节软骨内 MMP-13 的 mRNA 相对表达量早期变化较为缓慢,2 个月内组间差异无统计学意义;3 个月组 mRNA 相对表达量迅速升高,与各组差异有统计学意义 ( P<0.05 )。COL X 同样早期表达量变化不显著,3 个月组较早期组差异有统计学意义( P<0.05 ) ( 图 5 )。MMP-13、COL X 都是软骨细胞肥大化的标志性产物,在软骨受损时表达水平升高[7],成年人软骨细胞的异常肥大分化是 OA 的表现。
六、印度墨水染色显示 2 个月组、3 个月组着色深重
ACLT 各组相比:在术后 1 个月内各组中软骨表明光滑完整,无明显 ink 着色;4 周组出现较明显的稀疏着色痕迹,随时间进展,3 个月组关节墨汁着色面积超过 50%,且颜色深重,软骨损伤严重,形成了不可逆的改变 ( 图 6 )。
七、番红 O 染色发现手术后 4 周组开始出现软骨损伤,3 个月组损伤严重
ACLT 术后早期关节软骨无明显改变,2 周组( ACLT ) 关节表面开始纤维化,之后关节厚度越来越薄,番红 O 染色变浅说明糖胺多糖含量减少,潮线消失,细胞簇集,排列紊乱,细胞数目减少,软骨细胞陷窝空泡增大。4 周组可见关节软骨表面纤维化,糖胺多糖含量减少,软骨层次不清、细胞排列紊乱;2 个月组关节软骨厚度明显变薄,纤维化和磨损使关节面凹凸不平,软骨细胞数目减少;3 个月组 ( 因间隙狭窄,关节软骨与半月板挤压严重,尚可看到其界线 ) 关节表面纤维化明显,关节软骨极薄,糖胺多糖含量很少,软骨细胞稀疏,软骨陷窝宽大明显,软骨退化严重[15,17-18]( 图 7 )。
讨 论
一、SD 大鼠的 PTOA 模型代表性
创伤是导致 OA 进展的重要诱因,其中前交叉韧带 ( anterior cruciate ligament,ACL ) 和半月板损伤所致最为常见[9]。ACL 主要起稳定关节的作用,受损伤可致关节不稳,软骨负重异常,引起关节退化损伤,促进 OA 的进展。SD 大鼠与人类有类似的软骨发育退变过程,交叉韧带断裂亦可诱发 OA,故本实验用 SD 大鼠行 ACLT 造 PTOA 模型,模拟正常成年人 OA 的进展过程。
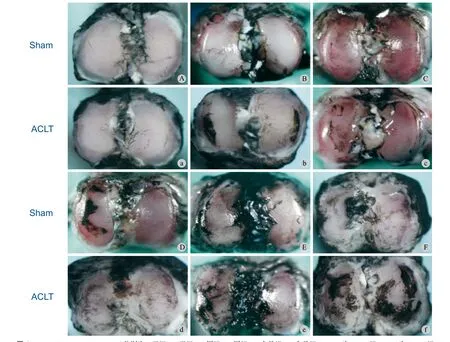
图6 Aa、Bb、Cc、Dd、Ee、Ff 分别为 3 天组、7 天组、2 周组、4 周组、2 个月组、3 个月组,A~F 为 Sham 组,a~f 为 ACLT 组Fig.6 The corresponding time points of Aa, Bb, Cc, Dd, Ee, Ff were 3 d group, 7 d group, 2 w group, 4 w group, 2 m group, 3 m group; The lower case letters corresponded to the Sham group, and the capital letters corresponded to the ACLT group

图7 手术组大鼠右膝关节 ( 番红 O × 10 );番红 O 染色为红色,显示软骨内糖胺多糖的含量 a、b、c、d、e、f、g、h 分别为 ACLT 术后 1 天组、3 天组、7 天组、2 周组、4 周组、2 个月组、3 个月组和 Sham 组 3 个月的关节软骨Fig.7 Safranin-O staining of the right keen joint after surgery ( × 10 ); Safranin-O staining was red, showing the glycosaminoglycan in the cartilage. a, b, c, d, e, f, g, h were the arthtitis cartilage in the group of 1 d group, 3 d group, 7 d group, 2 w group, 4 w group, 2 m group, 3 m group after surgery and Sham
二、随时间推移关节软骨的损伤情况
由于单个实验手段不稳定因素较多,无法确切反映关节软骨的损伤情况,笔者多角度检测了其损伤情况,采用膝关节 X 线、印度墨水染色、番红 O染色、RT-PCR ( 检测 MMP-13 和 COL X mRNA 表达水平 ) 分别从大体水平、形态学、组织学、分子水平多方面反映其受损情况。其中 3 个月组的 X 线、印度墨水染色、番红 O 染色结果均显示关节软骨破损严重,形成纤维瘢痕修复,进入损伤的不可逆阶段,是 OA 的典型表现;MMP-13 和 COL X mRNA表达水平在 3 个月组迅速升高,是软骨肥大化的表现,成年人软骨的异常肥大化就是 OA 的病理基础;因此,3 个月组的关节软骨已经形成不可逆损伤,认为进入 OA 晚期。而术后 4 周组及更早时间组别中,关节软骨各指标之间对比并不明显,因此,认为术后 1 个月内关节软骨尚未出现明显的形态学及分子水平的变化,这一阶段认为是 OA 早期。
三、Ihh 在 OA 早期表达量的升高阶段可能是诊断和治疗 OA 的合适时间点
关节软骨中 Ihh 基因的 mRNA 表达量在早期组出现升高阶段 ( 7 天组最高 ),Hh 信号通路的下游基因 mRNA 相对表达量在这一阶段也有升高,支持了这一现象。而免疫组化结果中 Ihh 蛋白含量的变化在 3 天组和 7 天组最高,这与 Ihh 基因的相对表达量的变化相一致。因此可见,Ihh 的表达水平在OA 早期有阶段性升高,这一阶段不仅早于软骨形态上发生损伤退变,也早于肥大化标志物 MMP-13 和COL X 的表达上升。有体外实验证实上调 Ihh 能促进 MMP-13 和 COL X 的表达,Ihh 可能是激活肥大化途径的因素之一[3]。故 Ihh 的表达升高阶段可能是大鼠软骨细胞肥大化进程激活的起点,可作为早期预测 OA 和早期干预 OA 的最佳时间点。
四、炎症因子的干扰可忽略
本实验 Ihh 在术后短期的升高并促进 OA,笔者并不认为炎症因子发挥主要作用。Clare Thompson离体研究发现在白细胞介素-1 ( IL-1β ) 存在的条件下,软骨基质的分解增加,但加入重组 Ihh( r-Ihh ) 却能减缓软骨基质分解,抑制基质分解酶的表达[19]。因此 Clare Thompson 得出:Ihh 介导的软骨基质分解主要是由 Ihh 相关病理因子所影响,而不是 IL-1β。本实验中可基本排除手术后 IL-1β 的影响,因为:( 1 ) IL-1β 能够介导基质分解酶的合成,而本实验中短期内基质分解酶的合成并没有明显的升高;( 2 ) 伪手术组作对照可以排除这一干扰。
五、血清中 Ihh 蛋白预测 OA 的可能性
大鼠血清中 Ihh 蛋白浓度在早期有明显升高阶段,这与关节软骨中 Ihh 表达变化一致,可能是前肥大软骨细胞分泌的 Ihh 经关节滑液吸收入血所致,现有实验对于滑液中的 Ihh 探究甚多,认为其与软骨损伤具有一定的关联,尚无血液中的数据,因为 OA 患者早期血液较难获得,笔者用大鼠模拟人类 OA,检测到血液与关节软骨的一致表现,因此,血液中的 Ihh 含量可以间接反映关节软骨中 Ihh的表达。而且血样获取方式比关节液的获取对人体损伤小,且取样量足,作为检测手段更加便利,对于 OA 的预测更具有实用性。
但该实验尚不能完全解决这一难题,首先,本实验仅是大鼠模型,血清中 Ihh 真正作为标记物被利用,尚需大量人类的研究的数据。再次,还需进一步探究血样中 Ihh 浓度升高反映 OA 形成的灵敏度和特异性。虽然检测血液中 Ihh 浓度有可能成为早期预测人类 OA 的手段,但仍需要更多研究者的努力探索。
六、Ihh 在 OA 治疗中的价值
Ihh 是促进 OA 的负性因子,抑制其产生,阻遏其作用才能起到延缓 OA 的作用,但它有复杂的分子调控网络,现阶段相关研究很多,尚未发现较好的手段。尝试敲除小鼠 Ihh 基因实验,确实起到了延缓 OA 的作用,但是也抑制了小鼠的骨骼发育;探究针对 Hh 信号通路中的 micro RNA 的实验,想要沉默 Ihh 或其下游基因,通路复杂交互,结果较间接,且有双向性;从药理方面入手,用其下游基因smo 的抑制剂来干扰 Hh 号通路作用,但基于溶剂的强毒性,尚无活体研究。Ihh 作为治疗手段的探究尚为基础,任重而道远。
综上所述,Ihh 作为关节软骨早期促进肥大化进程的因子,可能是预测 OA 进程的早期标志物,同时也可能是治疗 OA 的潜在靶点[9,13]。本实验明确了 Ihh 在大鼠 OA 发病早期有明显升高阶段,且在血液可以检测到这种变化,这为 Ihh 成为新型预防和治疗 OA 的手段提供新的依据。

