玉米低磷胁迫诱导型启动子P1502-ZmPHR1在玉米中的瞬时表达
杨瑞娟 ,卢 甜 ,闫 蕾 ,李 锐 ,康 晨 ,常丽芳 ,张丛卓 ,白建荣
(1.山西省农业科学院作物科学研究所,山西 太原 030031;2.山西大学生物工程学院,山西 太原 030006;3.西北农林科技大学生命科学学院,陕西 杨凌 712100)
瞬时表达分析(Transient expression)是一种可以在短时间内分析基因表达活性的有效方法[1-3]。它基于基因枪和农杆菌介导的转化、聚乙二醇介导的转化或直接转化法,将外源DNA导入受体植物细胞,但是该序列不必整合到植物基因组中,就可以暂时高水平表达。瞬时表达应用广泛,如外源基因表达[4]、启动子功能的分析[5]、蛋白质亚细胞定位[6]等。
磷是主要的营养元素,它不但是植物体内核酸、脂质、蛋白质的组成成分,还参与许多植物的基础生命活动,如能量传递和代谢调控[7]。植物对磷元素吸收主要通过根系吸收磷酸根。虽然土壤总磷含量高,但是土壤中的磷酸根易被各种阳离子和矿物吸附固定或转换成有机磷而不能被吸收[8-9]。因此,利用植物基因工程培育磷高效吸收新品种具有重要的意义。
本试验将P1502-ZmPHR1与GUS报告基因相连的融合基因用农杆菌介导法转入玉米478自交系,通过检测GUS基因的表达情况来分析低磷胁迫诱导启动子P1502-ZmPHR1在玉米中的表达活性,旨在为通过转基因工程培育玉米磷高效利用的品种提供有效的启动子。
1 材料和方法
1.1 材料
玉米478自交系和根癌农杆菌GV3101-1305-P1502-ZmPHR1菌株为山西省农业科学院作物科学研究所分子设计育种课题组保存,质粒为P1502-ZmPHR1∶GUS[11],其结构如图 1 所示。培养基为 LB固体培养基以及M1(农杆菌感染液)、M2(共培养基)、M3(诱导培养基)、M4(筛选培养基)和YEP液体培养基[12]。

1.2 玉米幼胚的转化
1.2.1 农杆菌准备 LB固体培养基(含卡纳霉素)上划线培养待转化农杆菌,28℃下培养2~3 d。用接种环取适量农杆菌单菌落悬浮在M1培养基中,旋涡混匀,使农杆菌稀释液OD600为0.79~0.85[12]。
1.2.2 幼胚准备 选取授粉8~10 d的玉米穗,去掉苞叶,使用20%的NaClO溶液消毒20 min,用解剖刀和匙突除去胚乳,挑选(1.0~1.5 mm)幼胚于M1培养基的离心管。
1.2.3 接种和共培养 吸去离心管中的M1培养基,然后加入1 mL农杆菌感染液,最大速度涡旋30 s,室温静止5 min。将幼胚转到M2共培养基上,并全部平放(盾片朝上)在培养基上,组织培养箱中22℃培养2~3 d。
1.2.4 愈伤组织诱导、选择与低磷胁迫处理 将幼胚转到M3培养基上,28℃暗培养10~12 d之后,将愈伤组织转到M4培养基,28℃暗培养14 d。挑选正常生长的愈伤组织(淡黄色)分别转至低磷MS固体培养基(KH2PO4含量为MS培养基的1/1 000[10])胁迫处理2 d。
1.3 玉米成熟种子的转化
1.3.1 菌液的制备 挑取农杆菌单菌落(含目的基因)接种到装有50 mL的YEP液体培养基(含卡那霉素50 μg/mL)的三角瓶中,28℃,200 r/min恒温摇床培养至对数期。5 000 r/min离心10 mim,弃上清;用MS液体培养基重悬菌体,悬浮液稀释至OD600=0.8左右时,加入乙酰丁香桐(Acetosyringone,AS),使浓度达到 100 μmol/L[13]。
1.3.2 玉米种子预处理 挑选饱满的玉米478种子,无菌水冲洗表面污物之后,用20%的NaClO溶液消毒20 min,用无菌水冲洗5次,置于灭菌的三角瓶,加入适量无菌水,28℃,100 r/min培养24 h。在超净工作台,用解剖刀划伤吸水膨胀种子胚生长点,放入新的广口瓶中[14]。
坡降较陡的区域,入库河道河槽狭窄,岸线蜿蜒曲折,河床坡降较大,河床浅滩和深潭交错。坡降较缓的区域,河槽变宽,岸线曲率较小,河床坡降较小,尤其在入库河口区段,入库河道多出现沙洲岔道,以U形或宽W形断面形态为主。
1.3.3 农杆菌侵染萌动玉米种子 把划过胚的无菌玉米萌动种子浸入准备好的菌液,28℃,90 r/min共培养12 h,无菌纸吸干多余的菌液,玉米种子分别置于MS液体培养基和无菌水(胁迫处理),28℃,90 r/min培养2 d。
1.4 GUS组织的化学染色
参照JEFFERSON等[15]的方法,分别将转基因愈伤组织和发芽种子,转入装有适量GUS染液的离心管中,37℃过夜,75%乙醇脱色3次,在解剖显微镜下观察并拍照。
2 结果与分析
2.1 P1502-ZmPHR1启动子在玉米幼胚愈伤组织的诱导和瞬时表达
将未转化的幼胚及农杆菌转化后的幼胚培养14 d后,未转化的幼胚和转P1502-ZmPHR1启动子玉米478幼胚均诱导长出愈伤组织(图2)。
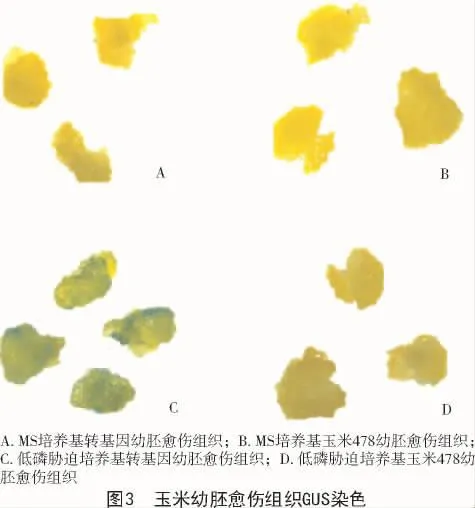
转基因后有169个幼胚产生愈伤组织。将100块转基因产生的每一块愈伤组织分为2块,其中一块进行低磷胁迫诱导,另一块不进行低磷胁迫诱导;同时,将非转基因50个幼胚产生的愈伤组织的每一块也分为2块,其中一块进行低磷胁迫诱导,另一块不进行低磷胁迫诱导。然后将这4部分愈伤组织进行GUS染色。结果表明,未经低磷胁迫培养基诱导的转基因玉米幼胚愈伤组织均未染色(图3-A,B),低磷胁迫培养基诱导2 d后转基因玉米幼胚愈伤组织局部染为蓝色(图3-C),而非转基因幼胚愈伤组织(阴性对照)不论胁迫与否均未染色(图3-B,D)。表1结果显示,GUS染色率为6%。结果表明,P1502-ZmPHR1启动子转入了玉米478幼胚愈伤组织后,低磷条件下P1502-ZmPHR1启动子能驱动GUS报告基因在玉米478幼胚愈伤组织中表达。
表1 P1502-ZmPHR1在玉米478幼胚愈伤组织的表达
2.2 P1502-ZmPHR1启动子在玉米成熟胚中的诱导和瞬时表达
通过农杆菌介导的方法分别对200粒玉米478成熟种子萌动胚进行转化,而100粒种子只划胚不侵染作为阴性对照。并将2种方法处理的种子1/2正常培养,另外1/2进行胁迫处理。结果显示,使用MS培养基正常培养的玉米478萌动种子和转P1502-ZmPHR1启动子的萌动种子均未染色(图4-A,B),经无菌水胁迫2 d的转P1502-ZmPHR1启动子的玉米萌动种子的胚芽、胚根以及胚的边缘都变为蓝色(图4-C),而无菌水胁迫2 d的玉米478萌动种子仍未染色(图4-D),说明P1502-ZmPHR1启动子可以在玉米478萌动种子中诱导驱动GUS基因表达。GUS染色结果表明,仅侵染的种子经胁迫处理后变为蓝色,染色率为20%(表2)。
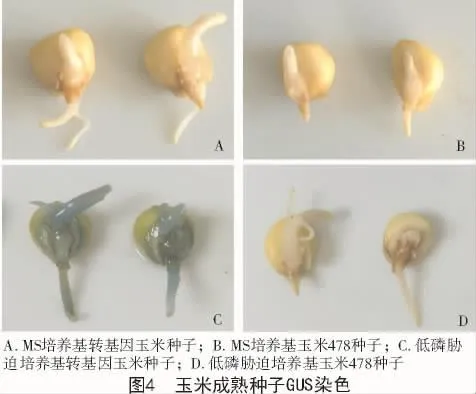

表2 P1502-ZmPHR1在玉米478成熟胚中的表达
3 讨论
传统植物基因工程中使用的启动子为强组成型启动子,在植株的整个生命周期中持续过表达,不但会造成营养和能量的浪费,干扰RNA和蛋白质的合成[16],而且还会导致植物生理活动无法正常进行,尤其是与低磷胁迫相关基因使用组成性启动子,出现了植株磷中毒的现象。诱导型启动子仅在植物受到胁迫时调控基因表达,可以巧妙地避免上述问题。因此,研究与利用诱导型启动子成为植物基因工程的热点。但已报道的研究多集中于诱导型启动子在模式植物中,在作物中研究的比较少[17-18]。
本研究在通过转化模式植物拟南芥验证P1502-ZmPHR1启动子的功能之后,用农杆菌介导法分别对玉米478的幼胚和萌动成熟种子进行转化,进一步分析其在玉米中的表达模式,完善试验结果。2组试验结果均表明,P1502-ZmPHR1启动子是低磷胁迫诱导型启动子,在玉米478中有启动子活性。该结果为利用基因工程手段培育磷高效利用型玉米品种改良奠定了基础。下一步我们将进行P1502-ZmPHR1启动子以及ZmPHR1在转基因玉米植株功能鉴定,使之能够在有效磷缺乏的土壤中正常生长,并且可以在减少磷肥施用量的情况下获得高产,同时避免磷中毒,从而有效地节约磷矿资源,降低生产成本,保护生态环境。

