诱导多能干细胞移植治疗对心肌梗死模型小鼠心功能的影响
熊挺淋 张丽莎 王浩宇 刘 涛
(南充市中心医院心内科 川北医学院第二临床医学院,四川 南充 637000)
心肌细胞(CM)是一种终末分化细胞,心肌梗死或者其他创伤导致CM死亡,其损伤是不可逆的。目前治疗CM损伤性疾病是困扰临床医生的一大难题,主要采取组织或者细胞移植,组织移植包括自体心肌组织移植及异体心脏移植,胚胎干细胞、骨髓间充质干细胞已证实能分化为CM〔1,2〕而用于细胞移植等。但胚胎干细胞用于移植治疗一直存在着道德伦理及免疫排斥反应等需要解决的问题。Takahashi等〔3〕将小鼠胚胎成纤维细胞(MEF)成功重编程为多能性细胞——诱导多能干细胞(iPSCs),iPSCs无论在生长特点、细胞形态、表达的标志物及形成畸胎瘤等方面均与胚胎肝细胞非常相似,且解决了胚胎肝细胞移植治疗时存在的免疫排斥及道德伦理难题。Mauritz等〔4〕研究证实小鼠iPSCs可以在特定的体外培养条件下定向分化为CM,但在体内特定条件下其能否分化为CM,目前未见相关研究报告。本研究观察iPSCs移植治疗对心肌梗死小鼠心脏的保护作用。
1 材料和方法
1.1材料 成年昆明小鼠及受孕13.5 d的昆明小鼠均由川北医学院动物实验中心提供。绿色荧光蛋白(GFP)转基因(Oct-4)小鼠来源的iPSCs株购自中国科学院动物研究所北京干细胞库。 DMEM高糖培养基、胎牛血清、胰蛋白酶均购自Hyclone公司,水合氯醛、非必需氨基酸、二甲亚砜均购自Sigma,β-巯基乙醇购自天津TBD公司,丝裂霉素C购自Roche公司,白血病抑制因子购自上海欣百诺公司,山羊来源的心肌肌钙蛋白(cTn)T一抗、四甲基异硫氰酸罗丹明(TRITC)标记的兔抗羊荧光二抗购自Santa Cruz公司,兔抗鼠缝隙连接蛋白(Cx)-43一抗及辣根过氧化物酶标记的二抗购自北京中杉金桥公司。简易呼吸机由川北医学院生理教研室提供,BL-420多导电生理仪及生物机能实验系统为成都泰盟科技有限公司生产,体式镜XTL-3A Coic由重庆光学仪器有限公司生产。
1.2iPSCs及原代CM的培养及鉴定 iPSCs的复苏、培养、传代和原代CM的提取、培养及两种细胞的鉴定同熊挺淋〔5〕法。
1.3小鼠急性心肌梗死(AMI)模型的建立及判定 水合氯醛腹腔麻醉成年昆明小鼠,然后通过气管切开由简易呼吸机辅助通气。通气成功后,胸骨左缘第4肋间隙剪断肋骨,进入胸腔,钝性分离心包并剪开,体式镜下用结扎线结扎前降支,结扎后成功的标志为结扎血管供应区心肌组织变苍白,体表心电图监测示相关导联ST段抬高大于0.1 mV(图1)。待移植细胞成功后,逐层关闭及缝合胸腔,待小鼠恢复自主呼吸后,撤去简易呼吸机。术后给予手术小鼠肌肉注射青霉素以预防感染〔6〕。
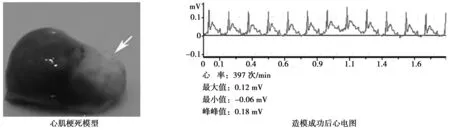
图1 心肌梗死模型及体表心电图
1.4实验分组 心肌梗死造模成功的昆明小鼠共36只,随机分为AMI组、AMI+iPSCs组、AMI+CM组,每组12只;12只正常成年昆明小鼠设为正常对照(NC)组。AMI组:只建立心肌梗死模型,不移植iPSCs及原代CM;AMI+iPSCs组:将iPSCs移植入心肌梗死区;AMI+CM组:将原代CM移植入心肌梗死区;NC组:既不建立心肌梗死模型,也不移植细胞。
1.5细胞移植 分别收集iPSCs及原代CM,制备成细胞悬液,小鼠冠脉前降支结扎后30 min时,用微量注射器吸取移植细胞悬液2.5 μl注射入心肌肌层,每个缺血坏死区域分别注射4次〔6〕。
1.6心电图及血流动力学的监测 正确连接多导电生理仪,采用BL-420多导电生理仪及生物机能实验系统,分别于细胞移植后1 h、1 d、7 d、14 d、21 d时测动脉收缩压及动脉舒张压〔6〕。急性ST段抬高型心肌梗死,其抬高的ST段一般在7 d内回落至基线,因此分别在细胞移植后1 h、1 d、2 d、5 d及7 d时检查体表心电图。
1.7免疫组化检测Cx-43的表达 实验后第21天,开胸切取各组心肌梗死区心肌组织,采用4%多聚甲醛固定,石蜡包埋,然后切片。采用中杉金桥公司SP法免疫组化试剂盒进行染色操作。应用Image Pro Plus图像分析软件对目的蛋白进行分析。选择5个高倍镜视野计算平均光密度值,取平均值作为Cx-43的相对表达量。
1.8统计学方法 使用SPSS17.0统计软件行单因素方差分析、LSD-t检验。
2 结 果
2.1iPSCs和原代CM形态观察及鉴定 小鼠iPSCs在饲养层细胞上呈集落状圆形或者椭圆岛状生长,其内细胞生长紧密,同时iPSCs在荧光显微镜下观察,呈现出与光学显微镜对应的、一致的集落状绿色细胞团。CM呈多边形、三角形或者扁平不规则等形态,培养第3天起,可见小部分收缩的CM,收缩频率在30~50次/min,细胞免疫荧光染色后,胞质内可见发红色荧光的心肌特异性蛋白cTnT(图2)。
2.2iPSCs移植对小鼠心率的影响 造模前各组心率差别无统计学意义(P>0.05),而造模成功后初期(7 d内),各组小鼠心率均有轻度升高趋势,但差异无统计学意义(P>0.05)。实验第14天及21天,AMI+iPSCs组小鼠心率较造模成功后初期明显降低(P<0.05);细胞移植第14天后,AMI+iPSCs组小鼠心率明显低于同时间点的AMI+CM组、AMI组及NC组小鼠心率(P<0.05)。而AMI+CM组、AMI组和NC组小鼠心率,造模前后差异均无统计学意义(P>0.05)。见表1。
2.3iPSCs移植对心电图ST段的影响 iPSCs移植后1 h及第1天时,AMI+iPSCs组体表心电图ST段抬高程度与AMI组比较差异无统计学意义(P>0.05);移植后第2天、第5天及第7天时,AMI+iPSCs组ST段抬高程度较AMI组明显降低(P<0.05)。而相同时间点的AMI+CM组及AMI组的ST段抬高程度差异无统计学意义(P>0.05)。细胞移植后第2天起,AMI+iPSCs组ST段抬高程度较AMI+CM组明显下降(P<0.05)。见表2。
2.4iPSCs移植对血压的影响 与NC组相比,AMI+iPSCs组血压无明显下降(P>0.05),而AMI+CM组及AMI组血压明显下降(P<0.05);与AMI+iPSCs组相比,AMI+CM组及AMI组血压也明显下降(P<0.05)。见表3。
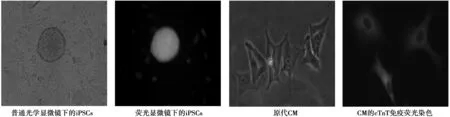
图2 iPSCs及原代CM形态及鉴定(×400)

时间造模前造模后1 h1 d7 d14 d21 dAMI+iPSCs组424.50±42.76430.43±32.671)437.88±43.151)420.12±29.801)375.08±31.84385.64±22.77AMI+CM组418.42±36.71422.45±26.67423.90±33.81418.32±27.91417.03±22.232)420.45±30.462)AMI组426.88±29.02428.22±29.37419.20±38.78410.26±29.68417.28±30.122)412.55±40.002)NC组416.48±29.28420.36±28.70415.19±38.94418.34±35.62416.34±31.562)411.22±28.732)
与第14天及21天比较:1)P<0.05;与AMI+iPSCs组比较:2)P<0.05

表2 移植后不同时间点各组体表心电图ST段抬高程度比较
与AMI组相比:1)P<0.05;与AMI+CM组相比:2)P<0.05
表3 各组血压比较
与NC组相比:1)P<0.05;与AMI+iPSCs组相比:2)P<0.05
2.5免疫组化分析 iPSCs移植后第7天,缺血坏死周围可见iPSCs植入,与正常心肌组织紧密结合,iPSCs稍呈集落状生长。见图3。定量分析显示,移植后第21天,AMI+iPSCs组Cx-43平均吸光度(0.154±0.063)明显高于AMI组(0.022±0.033)(P<0.05);而AMI+CM组Cx-43平均吸光度值(0.019±0.010)与AMI组差异无统计学意义(P>0.05)。

图3 心肌组织中的iPSCs及Cx-43免疫组化染色
3 讨 论
许多体外实验已证实iPSCs能够定向分化为CM,其分化CM不论在细胞形态及表达特异性标志物方面均与原代CM相似〔4,7,8〕。Strauer 等〔9〕研究表明,骨髓单个核细胞移植治疗10 w后,心肌梗死面积由24.6%下降至15.7%,射血分数、心脏指数增加了20%~ 30%,运动时的舒张末期容量下降30%,左室充盈压相对下降,移植治疗后没有出现新的心肌缺血、炎症反应和恶性心律失常等不良反应。此外,该研究团队还首次证明了经冠状动脉内输入自体骨髓单个核细胞治疗AMI是安全可行的〔10,11〕。本实验表明,一定数量的iPSCs移植可在一定程度上改善心肌梗死小鼠心脏功能,并使移植区域Cx-43蛋白表达增加。
既往研究表明,永久性结扎冠状动脉法与冰冻损伤或者暂时阻断冠状动脉的方法相比,这一技术更接近心肌梗死发生的病理生理过程,并且不会发生缺血再灌注时更为严重的恶性心律失常〔12〕。经外周静脉注射移植,只有很少一部分的移植细胞能到达心肌梗死区;而且长时间的血液内循环过程中,有部分移植细胞会发生向脾、肝、肺等脏器归巢的现象〔13〕。采用直接开胸心肌注射法,可以使移植细胞在注射后首先在梗死区及梗死周边区停留,因而能够使细胞移植效果最大化。iPSCs分化来源的心脏血管平滑肌细胞,具有成熟心肌细胞的兴奋性、收缩性、自律性和电位稳定性等特点〔14〕,同时,干细胞移植可增加细胞因子,如血管内皮生长因子(VEGF)等的释放,促进缺血区新生毛细血管的生成,增加心肌灌注、改善心室重构及减少心室扩张,因而有利于细胞的存活和增殖〔15〕。基于以上研究理论,本实验表明心肌梗死后无泵衰竭发生,提示iPSCs移植后可改善心肌梗死小鼠心功能。
由Cx-43构成的缝隙连接通道的主要作用是形成细胞间快速的电冲动,以保证心脏整体电活动的同步性和协调性,心脏正常的电活动取决于Cx-43的正常表达与分布,而一旦其表达与分布发生异常,即Cx-43发生重构,必然会引起CM的电耦联障碍,导致室性心律失常发生。目前iPSCs移植后能否与宿主细胞形成一个有收缩功能的相对电独立体系,尚缺乏系统观察,移植细胞与宿主心肌是否能够产生缝隙连接目前也尚无相关报道。而本实验初步证实了iPSCs移植后可使小鼠心肌梗死区Cx-43的表达增加。
本研究仅从血压、心率、心电图ST段变化及Cx-43的表达方面探讨了iPSCs移植对心肌梗死小鼠的心脏保护作用,并未探讨iPSCs移植的最佳时间窗,细胞移植是否像血运重建一样,越早越好?还是选在心肌梗死后炎症反应剧烈时,有利于干细胞归巢?或是选在心肌梗死后炎症病理反应消退时?并未探讨不同干细胞移植方法对实验结果的影响。所有这些问题有待进一步研究。

