外源海藻糖对低温胁迫下玉米幼苗根系生长及生理特性的影响*
刘 旋,佟昊阳,田礼欣,左师宇,孙 磊,曲丹阳,李丽杰,魏 湜,李 晶
外源海藻糖对低温胁迫下玉米幼苗根系生长及生理特性的影响*
刘 旋1,佟昊阳1,田礼欣1,左师宇1,孙 磊2,曲丹阳1,李丽杰1,魏 湜1,李 晶1
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院,哈尔滨 150086)
以玉米品种“先玉335”为实验材料,采用盆栽培养方法,待幼苗长至三叶一心时进行根系浇注海藻糖处理,海藻糖浓度分别为3、6、9、12、15、18mmol×L−1,以清水为对照,在人工智能培养箱昼/夜温度14℃/5℃的低温条件下培养4d,分析低温胁迫下海藻糖对玉米幼苗根系生长、抗氧化酶活性、细胞膜稳定性及渗透调节物质含量的影响。结果显示:根系浇注海藻糖能促进低温胁迫下玉米幼苗根系生长,诱导细胞抗氧化酶活性增加,维持根系细胞膜结构和功能的稳定。与对照相比,12mmol×L−1海藻糖处理的幼苗根长、根表面积和根鲜干重分别增加32.16%、15.87%、41.14%、58.33%;SOD和POD活性分别增加44.16%和62.17%;MDA含量和相对电导率分别降低50.23%和42.53%;脯氨酸和可溶性蛋白含量分别增加81.32%和87.21%。表明根系浇注适宜浓度海藻糖可有效提高玉米幼苗的抗低温能力,通过增强根系抗氧化酶活性,减轻膜损伤,进而缓解低温胁迫对幼苗生长的抑制,且12mmol×L−1的海藻糖溶液根系处理效果最佳。
玉米;海藻糖;低温胁迫;抗氧化系统;渗透调节物质
温度是作物生长发育过程中非常重要的环境因子,作物在低温胁迫时,生长受到抑制,严重时甚至死亡,造成作物减产[1]。全球每年由于低温冻害造成的农业经济损失可高达数亿元。资料统计,低温冻害每3~4a就会发生一次,造成作物平均减产13%~15%[2]。黑龙江省作为中国重要的玉米主产区,地处东北平原,年有效积温有限,经常出现局部性或全省性低温冷害,影响玉米生长发育,导致其大幅减产。黑龙江省玉米冷害主要发生在苗期和收获前期,其中苗期玉米对低温冷害更为敏感,并影响整个生长发育进程[3]。玉米幼苗受到低温胁迫后,根系生长受到明显抑制,生物量降低[4]。根系生长的限制直接影响后期生育成熟以及产量形成[5]。近年来,对于玉米低温冷害的研究备受关注,玉米低温冷害的时空分布特征、不同品种玉米耐寒性鉴定、玉米低温冷害风险评估及预估[6-11]等各方面研究都较为深入,关于玉米抗冷栽培研究对于提高产量、扩大种植面积具有重要意义。现阶段,农业生产上应用外源物质调控逆境是抗逆栽培的重要手段。
海藻糖是一种安全的非还原性双糖,对生物大分子和生物体均具有非特异性保护作用。逆境条件下,它可以保护细胞活性物质,促进蛋白质的合成,增强质膜流动性以及功能酶的稳定性[12]。海藻糖可作为植物适应环境胁迫的应激代谢产物,协助植物细胞内组分抵御外界不良环境,而广泛存在于耐低温作物中[13]。研究发现,黄瓜在受到低温胁迫时,外源海藻糖可以减少其体内的活性氧积累,同时,植株体内抗氧化酶SOD、POD活性增强,可有效清除活性氧,进而减轻低温对黄瓜幼苗的伤害[14]。谢冬微等[15]研究发现,外源海藻糖也可提高小麦幼苗内可溶性蛋白、可溶性糖含量,提高抗氧化能力,减轻膜脂过氧化伤害程度,增强植株的抗寒性。此外,也有研究指出,外源海藻糖通过提高盐胁迫下小麦幼苗SOD活性,降低对细胞膜的伤害,维持Na+、K−的相对平衡,增强渗透调节能力,进而提高小麦幼苗的耐盐性[16]。目前,关于海藻糖在玉米抗冷性领域的应用及其生理机制的研究尚未见报道,而低温对东北春玉米产区造成的影响亟需解决,鉴于海藻糖对其它作物的抗逆作用,以及海藻糖溶液低施高效抗逆的优点,本实验拟以海藻糖为外源物质,初步探讨根施海藻糖对低温胁迫下玉米幼苗生长、保护酶活性以及渗透调节物质代谢的影响,明确海藻糖缓解低温效应的最适浓度,揭示海藻糖增强玉米幼苗耐低温作用的机制,为海藻糖在作物抗低温冷害中的应用提供理论和实践依据。
1 材料与方法
1.1 实验设计
实验于2016年在东北农业大学盆栽实验场进行,供试玉米品种为先玉335。供试土壤取自东北农业大学盆栽试验基地,其基本理化性质为,有机质21.2g·kg−1,速效钾290.61mg·kg−1,速效磷14.87 mg·kg−1,速效氮9.22mg·kg−1,全钾15.5%,全磷0.03%,全氮0.14 %。海藻糖由国药集团某公司提供。
采用室外盆栽培养,花盆直径20cm,高17cm,装土3kg,供试土壤为黑土。选择籽粒饱满的种子经1%次氯酸钠消毒10min,灭菌蒸馏水冲洗干净后,播种在花盆中,每盆播种8粒,出苗后定苗6株。
待玉米幼苗生长至三叶一心时,根系浇注海藻糖,使用500mL量筒精准称量不同浓度海藻糖溶液350mL,缓慢均匀浇注到花盆中。海藻糖浓度分别为3、6、9、12、15、18mmol×L−1,以清水为对照,每个处理设3次重复。海藻糖诱导24h后,将幼苗移入HPG-280HX型人工智能培养箱中进行低温(昼温/夜=14℃/5℃)处理,4d后,转移至正常生长条件下(昼温/夜=24℃/15℃),24h后取根系进行各项指标测定。除环境温度不同外,幼苗生长每日光照时间均为14h,光强为4000lx,相对湿度为55%。
1.2 测定项目及取样方法
根长、根表面积测定采用加拿大Regent LA-S根系分析系统进行根系数据采集及分析。干鲜重的测定是将幼苗根系冲洗干净后,用滤纸吸干根表面水分,称取鲜重,在105℃下杀青20min,80℃下烘干至恒重后称取干重。
取幼苗根系根尖0.1g,采用雷磁DDS-307A电导率仪测定根尖相对电导率;取玉米幼苗根系去除根尖后全长的2/3,称取0.5g,采用氮蓝四唑(NBT)法测定SOD活性[17];愈创木酚法测定POD活性;分光光度计法测定MDA含量;茚三酮比色法测定Pro含量[18];考马斯亮蓝G-250染色法测定可溶性蛋白含量[19]。
1.3 数据统计
采用Excel和DPS7.05进行数据分析,LSD法进行方差分析。
2 结果与分析
2.1 外源海藻糖对低温胁迫下幼苗根系特征的影响
由表1可见,在低温胁迫下,浇注清水处理(海藻糖浓度为0)中玉米幼苗根长、表面积及鲜干重均低于其它处理,随着浇注海藻糖浓度的增加,低温处理中根长、根表面积及鲜干重大小总体呈现先升高后降低的趋势,其中海藻糖浓度为12mmol×L−1的处理根系各项指标的数值最大,分别比清水对照处理增加32.16%(根长)、15.87%(根表面积)、41.14%(鲜重)和58.33%(干重),且与其它海藻糖处理间差异达显著水平(P<0.05)。这表明根系土壤中浇注海藻糖可有效刺激低温胁迫下玉米幼苗根系的生长,而且海藻糖的注入存在一定的浓度效应,12mmol×L−1的海藻糖处理表现效果最好。
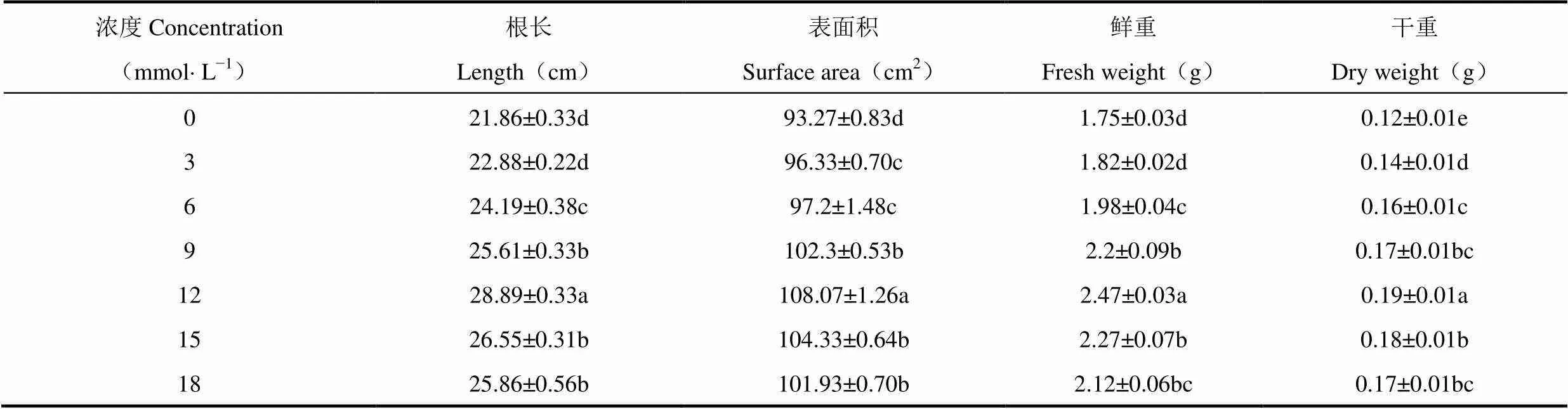
表1 不同海藻糖浓度处理后低温胁迫下玉米幼苗根长、表面积及鲜干重的比较(平均值±标准误)
注:小写字母表示处理间在0.05水平上的差异显著性。下同。
Note:Lowercase indicates the difference significance among treatments at 0.05 level. The same as below.
2.2 外源海藻糖对低温胁迫下玉米幼苗根系抗氧化酶活性的影响
SOD是生物防御活性氧伤害的重要保护酶之一,在作物适应逆境的过程中起着重要作用。由图1可知,各浓度海藻糖处理后SOD活性均显著高于清水处理(P<0.05),说明海藻糖有效提高了低温胁迫下玉米幼苗根系内SOD的活性,且随着海藻糖浓度的增加,SOD活性呈现先升高后降低的趋势。在浓度为12mmol×L−1时SOD酶活性最高,与对照相比,增加了44.16%,且与其它处理差异均达显著水平(P<0.05)。根系SOD活性的增加表明植株抗低温能力的增强,且海藻糖的诱导效应表现出浓度差异。
POD是植物体内活性较高的抗氧化酶,通过清除体内自由基,可有效防御组织细胞发生膜脂过氧化,在逆境胁迫下起到保护作用[20]。由图2可知,低温胁迫下各浓度海藻糖处理POD活性变化与SOD酶活性变化规律相似,均呈现低促高抑的趋势,且在海藻糖浓度为12mmol×L−1时酶活性最高,较清水对照增加了62.17%,与其它处理差异达到显著水平(P<0.05),海藻糖浓度进一步提高后,POD活性出现下降趋势,但POD酶活性仍显著高于对照,表明应用海藻糖可有效提高玉米幼苗根系的抗氧化活性,显著增强玉米幼苗清除体内自由基的能力,进而减轻低温胁迫造成的伤害。
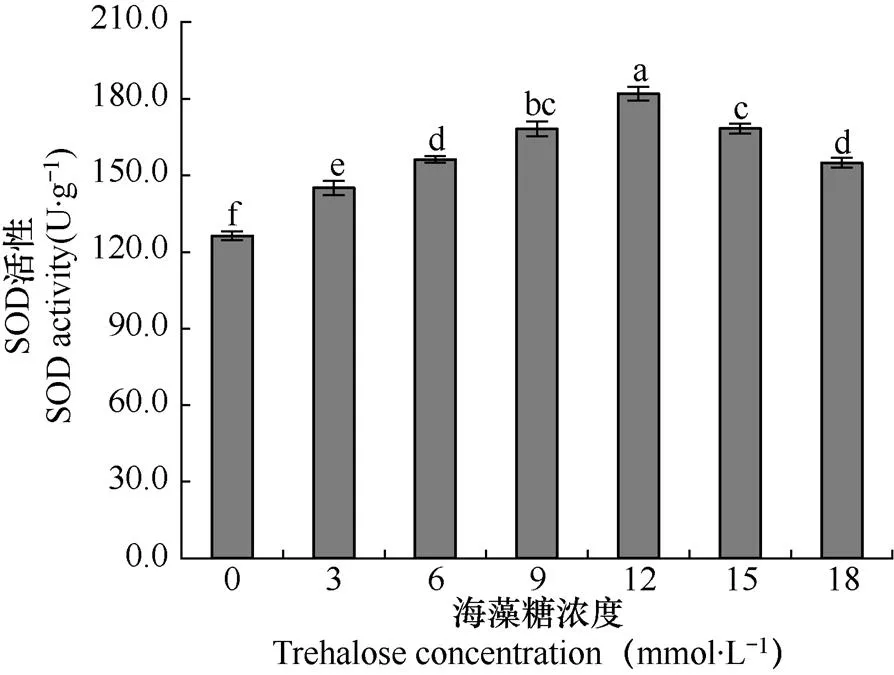
图1 不同海藻糖浓度处理后低温胁迫下玉米幼苗根系SOD活性的比较(短线为标准误,下同)

图2 不同海藻糖浓度处理后低温胁迫下玉米幼苗根系POD活性的比较
2.3 外源海藻糖对低温胁迫下玉米幼苗根系细胞膜稳定性的影响
丙二醛(MDA)是植物在受到逆境胁迫时产生的膜脂过氧化产物,是反映植物受到逆境伤害程度的重要指标。由图3可知,随着海藻糖浓度的增加,玉米幼苗根系MDA含量呈现先下降后上升的趋势,在浓度为12mmol×L−1时,MDA含量显著低于其它处理(P<0.05)。不同浓度海藻糖处理植株根系,MDA含量与清水对照相比均显著降低(P<0.05),降低范围在11.85%~50.23%。说明海藻糖的应用可以减少植物细胞MDA的生成,增强玉米抗低温能力。
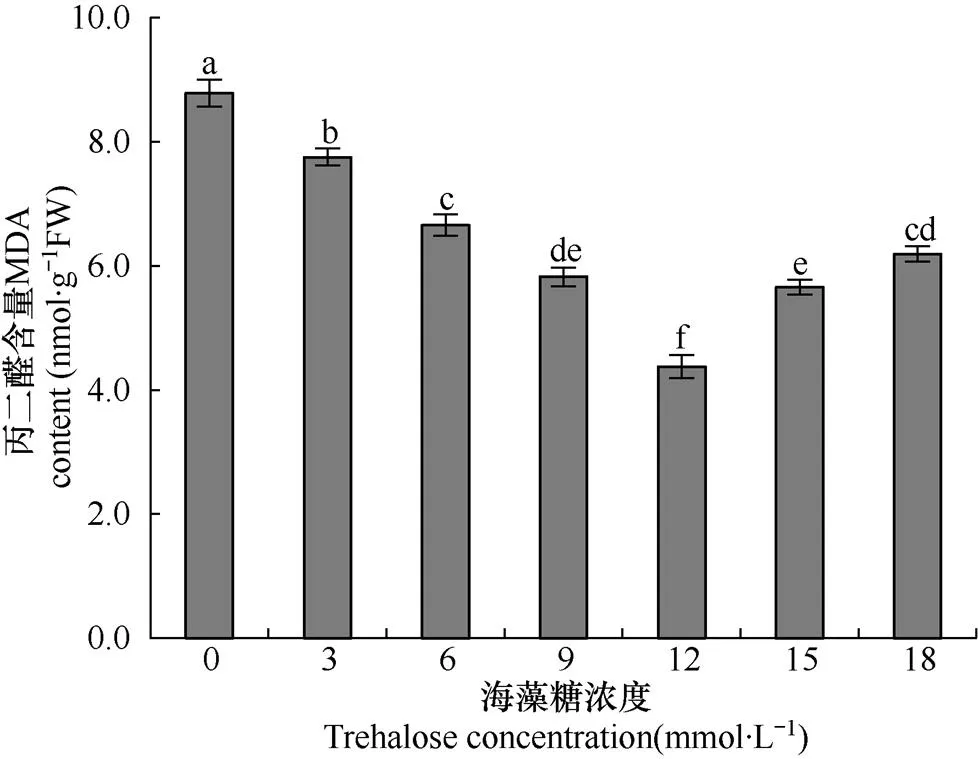
图3 不同海藻糖浓度处理后低温胁迫下玉米幼苗根系丙二醛活性的比较
相对电导率是衡量细胞膜透性大小的指标,相对电导率越大,细胞膜受损伤的程度也就越大。从图4可知,经过3~18mmol×L−1海藻糖处理后玉米幼苗根系相对电导率均显著下降,分别比清水对照减少12.48%、24.65%、29.89%、42.53%、34.98%和29.28%,在海藻糖浓度为12mmol×L−1时幼苗根系相对电导率降幅最大,且与其它处理差异显著(P<0.05)。由此可知,海藻糖可减轻低温胁迫下细胞膜的损伤程度,且在浓度为12mmol×L−1时效果最为明显。

图4 不同海藻糖浓度处理后低温胁迫下玉米幼苗根系相对电导率的比较
2.4 外源海藻糖对低温胁迫下玉米幼苗根系渗透调节物质的影响
玉米幼苗在低温胁迫下,通过渗透调节作用,产生可溶性蛋白以维持细胞膨压,保证细胞代谢正常进行[21]。由图5可以看出,经海藻糖处理后,玉米幼苗根系可溶性蛋白含量均与对照存在显著差异(P<0.05)。说明海藻糖可以调控产生更多的可溶性蛋白以增强幼苗的抗低温能力,在海藻糖浓度为12mmol×L−1时可溶性蛋白含量最高,较清水对照增加了87.21%,且与其它处理差异均达到显著水平。随着海藻糖浓度的增加,可溶性蛋白含量变化呈现出先增后降的规律,因此,适宜的海藻糖浓度对于提高根系内可溶性蛋白含量效果更明显。
脯氨酸是植物体内最为重要的渗透调节保护物质,低温胁迫时脯氨酸含量会大幅度提高[22-23]。由图6可知,经海藻糖处理后的玉米幼苗根系脯氨酸含量明显升高,均与清水对照处理存在显著差异,且随着海藻糖浓度的增加,脯氨酸含量变化呈现先升高后降低的趋势。在浓度为12mmol×L−1时,脯氨酸含量最高,较清水对照增加了81.32%,且与其它处理相比,差异均达到显著水平(P<0.05)。

图5 不同海藻糖浓度处理后低温胁迫下玉米幼苗根系可溶性蛋白含量的比较

图6 不同海藻糖浓度处理后低温胁迫下玉米幼苗根系脯氨酸含量的比较
3 结论与讨论
3.1 讨论
(1)海藻糖处理对低温胁迫下玉米幼苗根系生理特征的影响。根系是植物吸收水分和养分的重要营养器官,与植株抗低温能力具有十分密切的关系。研究指出,根系在土壤中的生长及分布状况决定玉米植株对土壤中水分与营养物质的吸收以及抗低温能力[24-25],低温条件下,玉米幼苗根系生长受到抑制,生物量明显降低[26]。本研究中,在低温胁迫条件下,对玉米幼苗根系浇注海藻糖处理后,受低温胁迫的玉米幼苗根长、根表面积以及鲜干重均明显增加,说明外源海藻糖可明显促进植株生长,减缓低温对植株的伤害。这与丁顺华等[16]在盐胁迫下外源海藻糖对小麦幼苗耐盐性的研究规律相似。本研究还发现,不同浓度海藻糖处理间,玉米幼苗抗低温能力存在显著差异,在海藻糖浓度为12mmol×L−1时,刺激根系生长的作用效果最为明显,但在海藻糖浓度增加至15mmol×L−1时,玉米幼苗根系生物量明显下降,导致这一结果的原因可能是高浓度外源海藻糖抑制了幼苗体内其它糖类物质的转化,影响了细胞正常生理代谢功能,具体原因有待深入探究。
(2)海藻糖处理对低温胁迫下玉米幼苗根系抗氧化酶活性的影响。低温胁迫下活性氧会在植物体内大量生成,这不仅会造成作物细胞膜损伤,还可透过生物膜快速扩散至植物各组织中[27]。SOD和POD的协同作用可以有效抵御活性氧自由基对细胞膜的伤害,抑制膜脂过氧化作用,缓解逆境胁迫对植物造成的伤害。在逆境胁迫下,植物自身的抗氧化系统中抗氧化酶活性会有所增强[28-29],徐田军等[30]在对玉米幼苗的研究中进一步证实了这一结论。赵莹等[31]研究认为,外源蔗糖和葡萄糖可以有效提高盐胁迫下玉米幼苗叶片中SOD含量,减轻活性氧自由基对细胞的伤害,增强盐胁迫下细胞膜的稳定性。本实验结果显示,经过海藻糖处理后,受到低温损害的玉米幼苗根系内SOD、POD活性增强,且呈现低浓度促进高浓度抑制的规律,这说明适宜浓度的海藻糖可有效激活低温胁迫下玉米幼苗的酶促防御系统,增强抗氧化酶活性,进而快速清除体内大量的活性氧,减轻膜损伤,最终达到提高作物抗低温能力的目的。而当海藻糖浓度超过一定值时,根系内SOD、POD含量显著下降,导致这种低促高抑现象的原因可能是由于较高浓度海藻糖对植株根系内的防御系统产生一定的限制,抑制了SOD、POD等对活性氧的清除。徐婷等[32]对薄皮甜瓜的研究也表明,叶面喷施不同浓度海藻糖可通过增强SOD和POD活性来缓解盐胁迫对其造成的损伤,且浓度为4%时效果最显著。前人研究表明,外源蔗糖能够诱导拟南芥超氧化物歧化酶基因的表达,说明外源糖有效诱导保护酶系统也是其缓解逆境胁迫的重要机制之一[33]。至于海藻糖缓解玉米幼苗抗低温能力是否与诱导超氧化物歧化酶基因表达有关,还需进一步展开研究。
(3)海藻糖处理对低温胁迫下玉米幼苗根系渗透调节物质的影响。渗透调节能力的强弱是植物适应低温强度的重要反映。植物在逆境胁迫下,渗透调节物质可以维持细胞膨压,稳定细胞器结构,调控某些生理功能,缓解逆境胁迫对植物的伤害[34-35]。可溶性蛋白和脯氨酸是植物体内重要的渗透调节物质,有研究表明,海藻糖可通过提高盐胁迫下番茄幼苗叶片中可溶性蛋白和脯氨酸的含量,提高渗透调节能力,增强幼苗的耐盐性[36]。本实验结果也表明,低温胁迫下,经不同浓度的海藻糖处理后,玉米幼苗根系可溶性糖、可溶性蛋白和脯氨酸的含量均显著增加,这与马光恕等[37]在对盐胁迫下甜瓜幼苗生长的影响中结果相似。海藻糖可通过增强渗透调节物质的积累,维持细胞结构稳定和调节渗透压,从而有效提高玉米幼苗的耐低温能力。在海藻糖浓度超过12mmol·L−1后,植株根系内渗透调节物质会有所下降,出现这种情况可能是由于海藻糖浓度过高,造成植株体内代谢酶紊乱,或是对细胞膜造成机械损伤。此外,根据以上结果推测,海藻糖浇注玉米幼苗根系可以促进可溶性蛋白合成途径中重要酶的合成或提高酶活性,使其含量在植株根系内维持较高的水平,以增强幼苗的抗寒能力。
(4)海藻糖处理对低温胁迫下玉米幼苗根系细胞膜稳定性的影响。植物细胞膜是对低温最为敏感的细胞器,MDA是植物在逆境胁迫下膜脂过氧化的分解产物,MDA含量和相对电导率的高低可以有效反映细胞受伤害程度大小。谭孟祥等[38]研究结果表明,由于低温的影响,水稻叶片内MDA含量明显降低。有研究指出,葡萄糖处理香雪兰花朵可以缓解由于低温伤害导致其体内MDA含量升高的状况[39]。本实验结果表明,在低温条件下,不同浓度海藻糖处理均可以降低玉米幼苗根系内相对电导率和MDA含量,表明海藻糖可以减轻低温胁迫对细胞膜系统造成的伤害,进而增强其耐低温能力。这与前人对黄瓜[14]、小麦[15]等作物的研究结果一致,且均表现为较低浓度的海藻糖处理效果最好,这可能是由于高浓度的海藻糖处理会抑制植株体内碳水化合物的合成,抑制碳物质积累,其具体机理还有待研究。
当前,在大田中为提高玉米抗低温能力而被广泛推广的外源物质有水杨酸和脱落酸,生产上成本较低,而海藻糖在较低浓度时也可获得较好的抗低温效果,且作为糖类物质对土壤无任何副作用,也是作物抗低温外源物质的一种选择。此外,本研究是在盆栽基础上进行,与大田生长环境相比,根系生长范围具有局限性、土壤微生物种群也存在一定差异,本实验只是研究体系的一部分。因此,关于海藻糖在大田中的应用还需深入探究。
3.2 结论
海藻糖可以缓解由于低温胁迫而引起的玉米幼苗根系生长受到抑制的现象,增加生物量的积累;提高低温条件下根系抗氧化酶活性,增强细胞清除活性氧的能力;减少MDA含量,降低相对电导率,维持低温后玉米幼苗根系细胞膜的结构与功能稳定;增加渗透调节物质的积累,提高渗透调节能力,从而缓解低温胁迫对植株的伤害,提高对低温的适应能力,其中12mmol×L−1浓度海藻糖表现最佳。
[1]李祎君,王远皓,张雪芬,等.东北地区玉米低温冷害规律研究[J].自然灾害学报,2011,20(6):75-80.
Li Y J,Wang Y H,Zhang X F,el at.Research on chilling damage of maize in northeast China[J].Journal of Natural Disasters, 2011,20(6):75-80.(in Chinese)
[2]杨德光,秦东玲,李钊,等.低温胁迫下外源水杨酸对玉米幼苗生理特性的影响[J].玉米科学,2016,24(4):122-129.
Yang D G,Qin D L,Li Z,el at.Physiological effects of exogenous salicylic acid on maize seedlings under low temperature stress[J]. Journal of Maize Sciences,2016,24(4):122-129.(in Chinese)
[3]陈笑莹,宋凤斌,朱先灿,等.低温胁迫下丛枝菌根真菌对玉米幼苗形态、生长和光合的影响[J].华北农学报,2014,29(S1): 155-161.
Chen X Y,Song F B,Zhu X C,el at.Effect of arbuscular mycorrhizal fungus on morphology,growth and photosynthetic characteristics in maize seedlings under low temperature stress[J].Acta Agriculturae Boreali-Sinica,2014,29(S1):155-161. (in Chinese)
[4]晋鹏宇,赵鑫,赵丽晓,等.芽苗期低温对玉米生长的影响及抗逆栽培措施[J].华北农学报,2012,27(S1):139-143.
Jin P Y,Zhao X,Zhao L X,et al.Effects of low temperature at germination and seedling stage on maize growth and cultivation technique for alleviation[J].Acta Agriculturae Boreali-Sinica, 2012,27(S1):139-143.(in Chinese)
[5]罗宁,魏湜,李晶,等.低温冷害对玉米苗期根系特征及电导率的影响[J].生态学杂志,2014,33(10):2694-2699.
Luo N,Wei S,Li J,et al.Effects of low-temperature stress on root system characteristics and electric conductivity of maize seedlings[J].Chinese Journal of Ecology,2014,33(10):2694-2699. (in Chinese)
[6]吉春容,刘海蓉,罗继,等.低温冻害过程中枣树枝条相关生理指标的变化[J].中国农业气象,2016,37(5):545-554.
Ji C R,Liu H R,Luo J,et al.Changes of physiological indices of jujube branches under process of low temperature and freeze injury[J].Chinese Journal of Agrometeorology,2016,37(5):545- 554. (in Chinese)
[7]杨若子,周广胜.1961-2013年东北三省玉米低温冷害强度的时空分布特征[J].生态学报,2016,36(14):4386-4394.
Yang R Z,Zhou G S.Spatio-temporal distribution of maize chilling damage intensity in the three provinces of Northeast China during 1961 to 2013[J].Acta Ecologica Sinica,2016,36 (14):4386-4394.(in Chinese)
[8]陈鹏狮,张玉书,纪瑞鹏,等.1961-2010年辽宁省玉米低温冷害时空分布特征[J].自然灾害学报,2017,26(4):411-418.
Chen P S,Zhang Y S,Ji R P,et al.Spatio-temporal distribution characteristics of maize chilling damage in Liaoning province during 1961-2010[J].Journal of Natural Disasters,2017,26(4): 411-418.(in Chinese)
[9]王腾飞,裴玉贺,郭新梅,等. 3个玉米品种苗期耐寒性鉴定[J]. 核农学报,2017,31(4):803-808.
Wang P F,Pei Y H,Guo X H,et al.3 Identification of the cold tolerance of three maize varieties in the seedling stage[J]. Journal of Nuclear Agricultural Sciences,2017,31(4): 803-808. (in Chinese)
[10]陈凯奇,米娜.辽宁省玉米低温冷害和霜冻灾害风险评估[J].气象与环境学报,2016,32(1):89-94.
Chen K Q,Mi N.Risk evaluation on maize cold damage and frost damage in Liaoning province[J].Journal of Meteorology and Environment,2016,32(1):89-94.(in Chinese)
[11]朱红蕊,刘赫男,张洪玲,等.黑龙江省玉米低温冷害风险评估及预估[J].气候变化研究进展,2015,11(3):173-178.
Zhu H R,Liu H N,Zhang H L,et al.Evaluation and projection of maize cold damage in Heilongjiang[J].Progressus Inquisiones de Mutatione Climatis,2015,11(3):173-178.(in Chinese)
[12]杨巧玲,杨晓梅,闫道良,等. 外源海藻糖对盐胁迫下海滨锦葵种子萌发的影响[J].江西林业科技,2014,42(42):1-4.
Yang Q L,Yang X M,Yan D L,el at.Effect of exogenous trehalose on the germination of(L.)Ledeb.seeds under salt stress[J].Jiangxi Forestry Science and Technology,2014,42(42):1-4.(in Chinese)
[13]Williams B,Njaci I,Moghaddam L,el at.Trehalose accumul- ation triggers autophagy during plant desiccation[J]. PLoS Genet,2015,11(12):e1005705.
[14]胡慧芳.外源海藻糖对黄瓜幼苗抗冷性的影响[J].北方园艺,2008,(2):11-13.
Hu H F.The effect of exogenous trehalose on cold resistance of cucumber seedlings[J].Northern Horticulture, 2008,(2):11-13. (in Chinese)
[15]谢冬微,王晓楠,付连双,等.外源海藻糖对冬小麦低温下胚芽长及幼苗抗寒性的影响[J].麦类作物学报,2015,35(2): 215-223.
Xie D W,Wang X N,Fu L S,et al.Effect of exogenous trehalose on germ length and seedling freeze resistance of winter wheat under cold stress[J].Journal of Triticeac Crops, 2015, 35(2):215-223.(in Chinese)
[16]丁顺华,李艳艳,王宝山.外源海藻糖对小麦幼苗耐盐性的影响[J].西北植物学报,2005,25(3):513-518.
Ding S H,Li Y Y,Wang B S.Effect of exogenous trehalose on salt tolerance of wheat seedlings[J].Acta Botanica Boreali- occident. sin,2005,25(3):513-518.(in Chinese)
[17]郝再彬. 植物生理实验[M]. 哈尔滨:哈尔滨工业大学出版社,2004.
Hao Z B.Plant physiology experiment[M].Harbin:Harbin Institute of Technology Press,2004.(in Chinese)
[18]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
Zou Q.Experimental guidance on plant physiology[M]. Beijing:China Agricultural Press,2000.(in Chinese)
[19]李合生.植物生理生化实验指导[M].北京:高等教育出版社,2000
Li H S.Plant physiological and biochemical test guidance[M]. Beijing:Higher Education Publishing House,2000.(in Chinese)
[20]史红梅,张海燕,杨彬,等.低温胁迫对高粱幼苗MDA含量SOD和POD活性的影响[J].中国农学通报,2015,31(18):74-79.
Shi H M,Zhang H Y,Yang B,et al.Effects of low temperature stress on the content of MDA,SOD and POD activity in sorghum seedlings[J].Chinese Agricultural Science Bulletin, 2015,31(18):74-79.(in Chinese)
[21]孙阳,王燚,曲丹阳,等.5-氨基乙酰丙酸提高玉米幼苗抗低温性及其生理机制[J].生态学杂志,2016,35(7):1737-1743.
Sun Y,Wang Y,Qu D Y,et al.Enhanced low-temperature resistance and physiological mechanism of maize seedlings by exogenous application of 5-aminolevulinic acid[J].Chinese Journal of Ecology,2016,35(7):1737-1743.(in Chinese)
[22]Habibi F,Normahamadi G H,Heidary S A H,et al.Effect of cold stress on cell membrane stability, chlorophyll a and b contain and proline accumulation in wheat (L.)variety[J].African J Agri Res,2011,6:5854-5859.
[23]Azymi S,Sofalian O,Jahanbakhsh G S,et al.Effect of chilling stress on soluble protein,sugar and proline accumulation in cotton (L.)genotypes[J].Intl J Agri Crop Sci,2011,4:825-830.
[24]Hund A,Fracheboud Y,SoldatiA Stamp P.Cold tolerance of maize seedlings as determined by root morphology and photosynthetic traits[J].European Joumal Agronomy,2008,28: 178-175.
[25]Jordan-Meille L,Pellerin S.Shoot and root growth of hydroponic maize (L.)as infiuenced by K deficiency [J].Plant and Soil,2008,304:157-168
[26]Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiol Bioch,2010,48(12):909-930.
[27]Almeselmani M,Deshmukh P S,Chinnusamy V.Effects of prolonged high temperature stress on respiration, photosyn- thesis and gene expression in wheat(L.)varieties differing in their thermotolerance[J].Plant Stress, 2012,6:25-32.
[28]Farooq M,Wahid A,Kobayashi N,et al.Plant drought stress: effects mechanisms and management[J].Agronomy for Sustai- nable Development,2009,29:185-212.
[29]Back K H,Skinner D Z.Alteration of antioxidant enzyme gene expression during cold ac climation of near-isogonics wheat lines[J].Plant Sci,2003,165:1221-1227.
[30]徐田军,董志强,兰宏亮,等.低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报,2012, 38(2):352-359.
Xu T J,Dong Z Q,Lan H L,et al.Effects of PASP-KT-NAA on photosynthesis and antioxidant enzyme activities of maize seedlings under low temperature stress[J].Acta Agronomica Sinica,2012,38(2):352-359.(in Chinese)
[31]赵莹,杨克军,赵长江,等.外源糖调控玉米光合系统和活性氧代谢缓解盐胁迫[J].中国农业科学,2014,47(20):3962-3972.
Zhao Y,Yang K J,Zhao C J,et al.Alleviation of the adverse effects of salt stress by regulating photosynthetic system and active oxygen metabolism in maize seedlings[J].Scientia Agricultura Sinica,2014,47(20):3962-3972.(in Chinese)
[32]徐婷,周传余,周超,等.海藻糖对盐胁迫下薄皮甜瓜幼苗抗氧化系统的影响[J].北方园艺,2014,(19):28-30.
Xu T,Zhou C Y,Zhou C,et al.Effect of trehalose on antioxidant system of melon seedling under salt stress[J].Northern Hortic- ulture, 2014,(19):28-30.(in Chinese)
[33]Sulmon C,Gouesbet C,Amrani A E,et al.Sugar-induced tolerance to the herbicide atrazine in Arabidopsis seedlings involves activation of oxidative and xenobiotic stress responses [J].Plant Cell Reports,2006,25:489-498.
[34]张保青,杨丽涛,李杨瑞.自然条件下甘蔗品种抗寒生理生化特性的比较[J].作物学报,2011,37(3):496-505.
Zhang B Q,Yang L T,Li Y R.Comparison of physiological and biochemical characteristics related to cold resistance in sugarcane under field conditions[J].Acta Agronomica Sinica, 2011,37(3):496-505.(in Chinese)
[35]康云艳,杨暹,郭世荣,等.24-表油菜素内酯对低氧胁迫下黄瓜幼苗碳水化合物代谢的影响[J].中国农业科学,2011,44(12): 2495-2503.
Kang Y Y,Yang X,Guo S R,et al.Effects of 24-epibrassinolide on carbohydrate metabolism and enhancement of tolerance to root-zone hypoxia in cucumber[J].Scientia Agricultura Sinica,2011,44(12):2495-2503.(in Chinese)
[36]刘岩.外源海藻糖对番茄幼苗生化指标的影响[J].中国园艺文摘,2016,(12):59,95.
Liu Y.Effects of exogenous trehalose on the biochemical indexes of tomato seedling[J].Chinese Horticulture Abstracts, 2016,(12):59,95.(in Chinese)
[37]马光恕,廉华,靳亚忠,等.海藻糖对NaCl胁迫下甜瓜幼苗生长的影响[J].广东农业科学,2013,(16):40-43.
Ma G S,Lian H,Jin Y Z,et al.Effect of trehalose on the growth of muskmelon seedlings under NaCl stress[J].Guangdong Agricultural Sciences,2013,(16):40-43.(in Chinese)
[38]谭孟祥,景元书,薛杨,等.水层深度对早稻幼穗分化期遭遇低温过程时叶片生理特性的影响[J].中国农业气象,2015, 36(5):553-560
Tan M X,Jing Y S,Xue Y,et al.Effects of different water depth on leaf physiological characteristics of early rice during panicle primordium suffered to low temperature[J].ChineseJournal of Agrometeorology,2015,36(5):553-560.(in Chinese)
[39]刘亚杰,常苹,唐东芹.外源糖对香雪兰切花活性氧平衡的影响[J].北方园艺,2014,(9):140-147.
Liu Y J,Chang P,Tang D Q.Effect of exogenous sugars on active oxygen balance of cut freesia flowers[J].Northern Horticulture,2014,(9):140-147.(in Chinese)
Effects of Exogenous Trehalose on Growth and Physiological Characteristics of Maize Seedling Roots under Chilling Stress
LIU Xuan1, TONG Hao-yang1, TIAN Li-xin1, ZUO Shi-yu1, SUN Lei2, QU Dan-yang1, LI Li-jie1, WEI Shi1, LI Jing1
(1.College of Agriculture, Northeast Agricultural University, Harbin 150030,China; 2.Heilongjiang Academy of Agricultural Sciences, Harbin 150086)
In order to investigate the trehalose on root growth, antioxidant enzyme activity, cell membrane stability and osmotic adjustment of maize seedlings,"Xianyu335"was chosen as the experimental materials by pot culture method. When the seedlings grow to three leaves, the roots were treated with trehalose at the concentration of 3, 6, 9, 12, 15, 18mmol×L−1, with the treatment of spraying clear water as CK. Afterwards, the seedling are placed in artificial intelligence incubator (day/night temperature of 14℃/5℃ low temperature condition) for 4 days. The results showed that the application of trehalose effectively promoted the root growth of maize seedlings under low temperature stress, enhanced the antioxidant enzyme activities, and maintained the stability of cell membrane structure and function of root system. Compared with the control, with the application of 12mmol×L−1trehalose, the root length, root surface area and root dry weight of the seedlings increased by 32.16%, 15.87%, 41.14% and 58.33%, the activities of SOD and POD increased by 44.16% and 62.17%, the content of MDA and the relative conductivity were reduced by 50.23% and 42.53%, and the contents of proline and soluble protein were increased by 81.32% and 87.21%, respectively. The results showed that the optimum concentration of trehalose could significantly improved the low temperature resistance of maize seedlings, alleviated the inhibition of low temperature stress on seedling growth, enhanced the activity of antioxidant enzymes and reduced the membrane damage, and 12mmol×L−1trehalose solution has the best treatment effect.
Maize; Trehalose; Low temperature; Antioxidant system; Osmotic adjustment substance
2018−01−19
。E-mail:jingli1027@163.com
国家重点研发项目“东北春玉米减灾保产调控关键技术研究”(2017YFD0300405)
刘旋(1992−),女,硕士,主要从事玉米高产栽培及抗冷性研究。E-mail:18345033400@163.com
10.3969/j.issn.1000−6362.2018.08.006
刘旋,佟昊阳,田礼欣,等.外源海藻糖对低温胁迫下玉米幼苗根系生长及生理特性的影响[J].中国农业气象,2018,39(8):538−547

