胃癌合并腹膜转移患者中S-1联合紫杉醇(腹腔灌注)与S-1联合顺铂(静脉)治疗的对比
——PHOENIX-GC研究的解读
本期分享2018年5月发表在JCO上的PHOENIX-GC研究[1],旨在对比胃癌合并腹膜转移患者中S-1联合紫杉醇(腹腔灌注)与S-1联合顺铂(静脉)治疗的优劣。
1 背景
胃癌腹膜转移是指胃癌原发灶癌细胞经血行、淋巴或腹膜这3种途径直接种植生长在腹膜。由于间皮细胞的不连续性,普遍认为肿瘤细胞可以通过“种子-土壤”学说在腹膜上种植。腹膜转移是胃癌最常见的转移形式,它具有以下几个特点:
其一,胃癌腹膜转移的发生率高。在中国,腹膜转移占胃癌转移的53%~60%,即使可进行手术治疗,进展期胃癌中有超过50%的患者术后首发且唯一复发灶是腹膜转移。
其二,预后较差。腹膜转移是导致20%~40%胃癌患者死亡的直接原因,居胃癌患者致死原因的首位。
其三,腹膜转移的评估十分复杂。CT作为最主要的影像学检查手段,虽然特异度可达95%~99%,但是灵敏度仅为33%~51%,极易漏诊误诊。腹腔游离癌细胞检查(腹水或腹腔灌洗液细胞学检查)是目前诊断腹腔内游离癌细胞的金标准,虽然其灵敏度较低,但有助于发现肉眼无法识别的微转移。诊断性腹腔镜检查应同时进行腹腔游离癌细胞检查。血清标志物CA125只能作为辅助手段,而不作为腹膜转移的诊断依据。
其四,腹膜转移的治疗方法单一。NCCN指南未对腹膜转移的胃癌患者作出单独的规范(图1)。指南中对它与不可切除的晚期患者采用共同的治疗原则。然而,对于有其独特转移特点的腹膜转移来说,这样单一的治疗方法似乎并不能满足治疗的需要。

图 1 晚期不可切除胃癌治疗的NCCN指南规范Fig. 1 NCCN guidelines for the treatment of unresectable locally advanced gastric cancer patients
胃癌腹膜转移的以上问题,对治疗提出了更多的要求,而腹腔灌注化疗就是有希望对这一部分患者带来更多临床获益的治疗方案。
该研究的日本治疗团队一直致力于胃癌腹膜转移的研究,并发表过一系列成果。在此前进行的Ⅱ期临床研究中,发现腹腔灌注化疗的获益趋势,即在其基础上开展了此项Ⅲ期、日本多中心、优效性、开放标签的随机对照研究(图2)。
2 研究设计
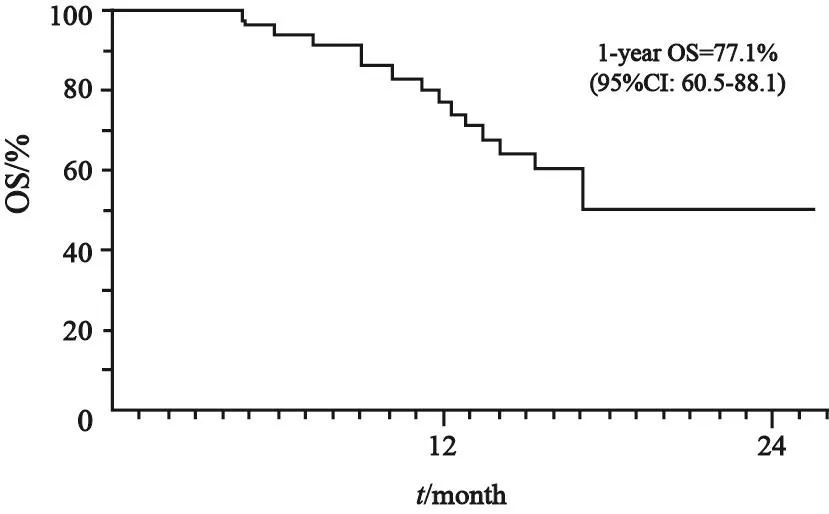
图 2 Ⅱ期单臂临床研究中的OS Kaplan-Meier曲线结果(n=35)Fig. 2 Kaplan-Meier curve of OS in single-arm Phase Ⅱ Trial(n=35)
入组要求为病理证实的原发性胃腺癌伴腹膜转移,未接受化疗或短期内(<2个月)化疗没有疾病进展,年龄20~74岁,ECOG评分为0或1,具有良好的营养状况和器官功能。排除因素为腹膜转移外的远处转移;既往姑息性胃切除术;大量腹水需要频繁的排水。腹膜转移的程度按照日本标准进行划分,即P1是指转移结节限于邻近的腹膜,P2是指腹腔内有数个散在的转移性结节,P3是指在整个腹膜腔内有许多转移性结节。该研究采用FAS数据集的OS作为主要研究终点,在第1例入组2年后进行评价。由于到2年时还没完全完成入组,所以中间修改了1次方案,加入了3-year OS作为次要研究终点,同时,次要研究终点还包括反应率(response rate,RR)和安全性指标。
3 治疗方案
2011年10月—2013年11月完成该研究的患者入组并按2∶1的比例随机分配到IP组和SP组。IP组采用的是3周的治疗方案:第1、8天腹腔注射紫杉醇20 mg/m2+静脉注射紫杉醇50 mg/m2,第1~14天进行S-180 mg/m2口服。SP组进行5周静脉化疗方案:第8天注射顺铂60 mg/m2,第1~21天进行S-180 mg/m2口服。直到患者出现疾病进展或者不可耐受的毒性。疗效评估采用腹水量和腹腔细胞学检查,腹水通过影像学检查评估,细胞学检查则在IP组每次腹腔化疗前以及SP组是第1/2次腹腔镜手术时进行[1]。
4 数据集
研究共筛选了239例患者,排除不符合入组标准的患者后,共183例按2∶1的比例进行随机,这部分属于ITT数据集(122例∶61例)。安全集定义:排除因撤销知情同意、吞咽功能不佳及远处转移而没有接受所分配治疗的患者。主要分析FAS集的定义是在安全集的基础上排除缺知情同意和不符合入组标准;PP集则是在FAS集基础上排除方案违背的患者(图3)。
主要分析数据集为何采用FAS?ITT原则的理想情况在临床试验的实践中不易完全达到,FAS则是指按ITT原则尽可能地接近理想状态,通过对所有随机化受试者的数据进行最少和公正的剔除之后所得到的数据集。但最少和公正的剔除并无严格标准,目前达成的共识中可以从FAS中排除的情况:① 不符合入选标准的受试者;② 在入组后没有任何随访记录的受试者(图4)。
随机采用最小化的方法,分层因素包括中心、之前是否化疗(present vs absent);腹膜转移程度 (P1 vs P2/P3)。在以上分层因素中遗漏了对预后产生重要影响的腹水因素。
在分层因素选择时要注意各水平间的比例,当某水平的比例极小时,会影响分层因素组间均衡性(无效的分层因素)。比如,腹膜转移程度这个分层因素,183例患者中P1仅有6例。因此,腹膜转移因素可以视为无效的分层因素(图5)。
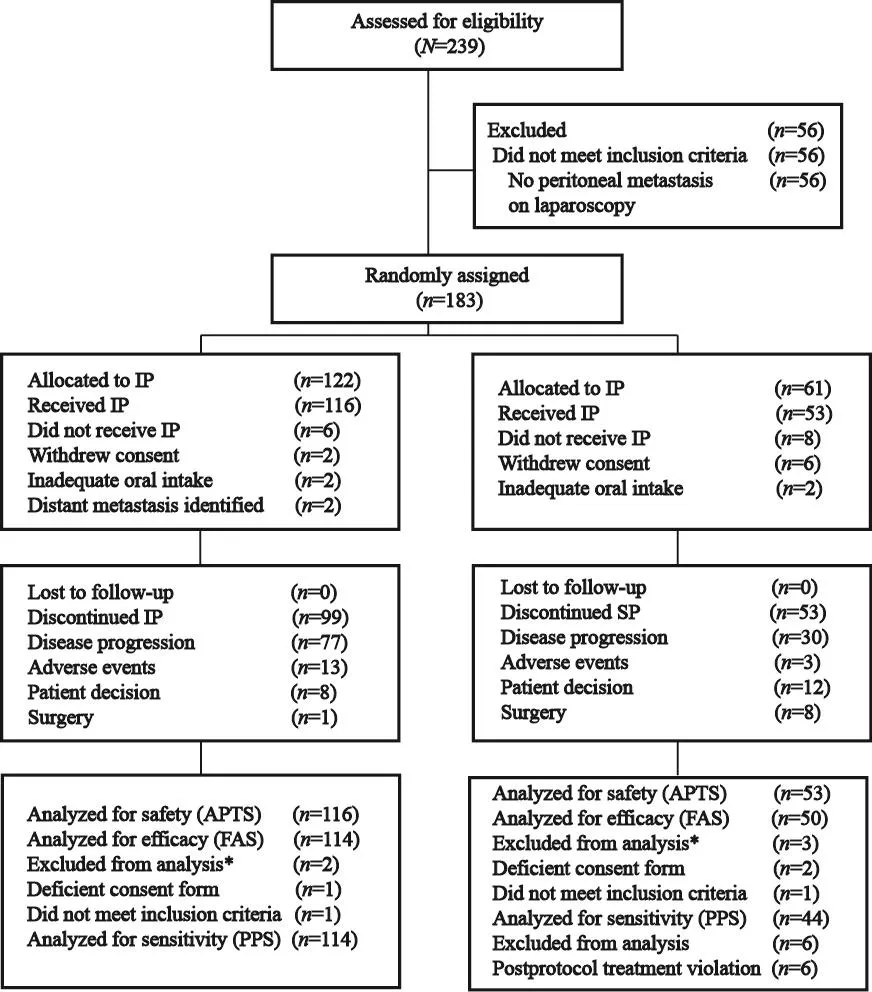
图 3 试验随机分析情况Fig. 3 Trial pro fi le at the primary analysis cutoff date

图 4 不同数据集示意图Fig. 4 Diagram of different data sets

图 5 腹膜转移分层情况Fig. 5 Strati fi cation of peritoneal metastasis
5 样本量计算
该研究设立了2次期中分析,分别在入组达到90和160时进行。最后1次分析仍保证Alpha有0.04976,检验水准并未消耗,是由于使用O’Brien-Fleming方法进行Alpha拆分,前面两次中期分析共占用Alpha 0.00024。预先设置IP组的中位生存时间是22个月(结果仅有16个月)对比SP组的11个月,按照Power=0.9,Alpha=0.05(双侧)计算出的样本量为180,由于研究者对于疗效的估计过于乐观,所以这里计算的样本量实际上应该是不够的(图6)。

图 6 样本量计算Fig. 6 Sample size calculation
6 关于O’Brien-Fleming方法
O’Brien-Fleming方法在期中分析过程中均采用严格的标准(很低的P)。如果研究继续进行达到计划的样本量,那么最终的分析如同没有期中分析一样。这样的方法不仅保证了α水平,也保存了把握度。对显著性水平的处理方法是递进式的,在试验开始阶段,对不稳定的结果都不确定时,它采用的P更保守,随着试验的进行,结果变得可靠与稳定时,它的标准也随之放宽。只有当治疗方法被证明有很强的优势时可以提早终止试验。因此,只要付出一点额外的努力,研究者便可以满足伦理学的要求,在研究过程中监测治疗的效果。
7 研究结果
该该研究最初预计的随访时间是2年,中位随访30.1个月。治疗的中位持续时间IP组39周,SP组15周。延长随访时间至3年后,中位随访时间为41.7个月[1]。
在基线情况的分析中,预设分层组际之间各项因素分布均衡;然而对于没有预设的腹水因素,两组出现了明显的差异:IP组中度腹水33%,SP组中度腹水7%(P=0.015)。而评估腹腔转移情况的PCI指数在IP组中也更高[1](表1)。
主要研究终点为中位生存时间,IP组为17.7个月(95%CI:14.7~21.5个月),SP组为15.2个月(95%CI:12.8~21.8个月),HR=0.72,95%CI:0.49~1.04,P=0.080。两组之间差异并无统计学意义。IP组的3-year OS为21.9%(95%CI:14.9%~29.9%),SP组为6.0%(95%CI:1.6%~14.9%)。在K-M曲线上前期两条线较为紧密,后期逐渐分开似有获益,但差异无统计学意义[1](图7)。

表 1 两全分析集基线特征Tab. 1 Baseline demographic and clinical characteristics of the full analysis set

图 7 OS Kaplan-Meier曲线图Fig. 7 Kaplan-Meier curves of OS
在亚组分析中,由森林图可得,治疗效果与腹水量之间有明显的关系(P=0.01)。在中等腹水组中,IP组存在获益(图8)。对腹水量的分析显示,IP组中39%的患者在接受治疗后腹水消失,IP组患者的反应更好(P=0.001)。但是,由于事先未预设分层且样本量不大,该研究也只能得出初步结论[1](表2)。
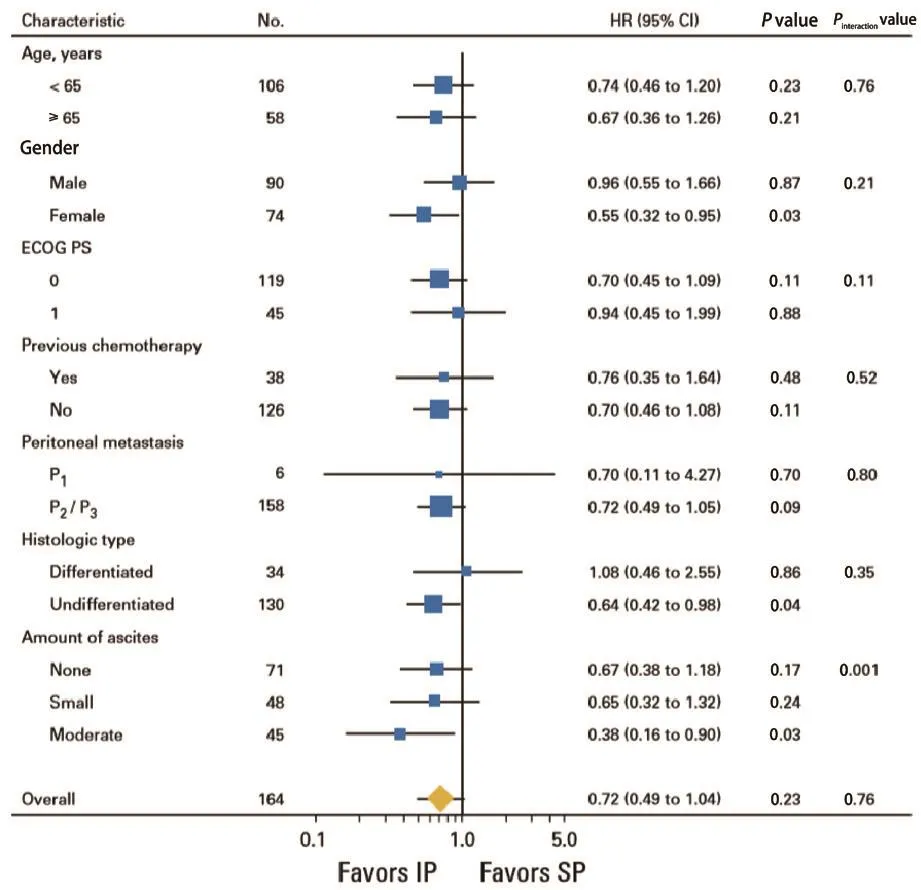
图 8 亚组分析图Fig. 8 Subgroup analyses of OS in the full analysis set
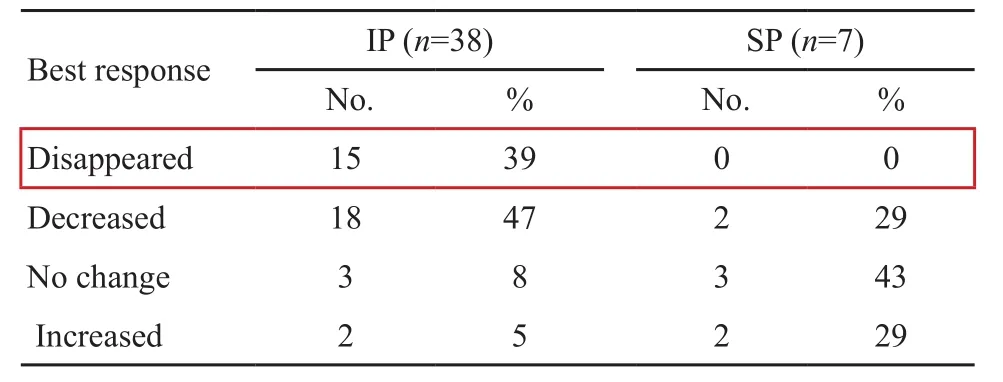
表 2 通过CT对腹水量的分析Tab. 2 Evaluation of ascites by CT
在安全性分析中,IP组3或4级白细胞减少(25% vs 9%,P=0.023)和中性粒细胞减少(50% vs 30%,P=0.028)更常见。非血液学毒性可耐受,两组之间差异无统计学意义。两组耐受性均可接受(表3)。
该研究的结论是未能显示腹膜内紫杉醇加全身化疗的统计学优势,探索性分析提示腹腔内紫杉醇可能对胃癌有临床获益。
8 讨论
该研究是第一个胃癌腹腔化疗对比传统化疗的Ⅲ期临床研究,但得到了令人惋惜的阴性结果[1]。
首先,该研究虽是阴性结果,但却有学者认为IP组还是有潜在获益趋势的。例如:① IP组的曲线始终在SP组上方,并且HR值的上限也是刚过1,P值也在临界范围,延长1年的随访后,3年的MST相差巨大,21.9%对比6%(图7)。② 安全集分析中的P值临界值仍是临界状态(P=0.067)。③ 基线水平不平衡,IP组对比SP组,腹膜转移的情况IP组更差,P2和P3人群占97%,SP组94%;IP组组织学未分化人群占82%,而SP组只有72%;IP组腹水63%,SP组42%(表1)。④ Crossover也会稀释两组差异。实际上Protocol中是不允许crossover的,但出于伦理考虑无法完全禁止。这里注意,当有转组事件发生时,理应质疑治疗方案组间是否存在差异。SP组中仍有6例在后续治疗中接受IP(12%)。把Crossover的人群去掉之后,P值则缩小至0.022,达到了显著水准,HR值同时从0.72降到了0.64。亚组分析中中等腹水人群也获得了显著性阳性结果。⑤ 调整性的post hoc分析,把腹水因素矫正后也得到阳性的结果。综上所述,认为该研究存在一些潜在获益趋势不无道理,因为IP组的疗效果真被低估了。

表 3 安全性分析Tab. 3 Adverse events in the all-patients-treated set
该研究的显著性检验无足够的统计学效能(图9)。在计算样本量时过于乐观地估计了疗效,按实际的疗效去计算,显然power过低,仅15%左右。但是反过来,样本量不够的问题也同样会导致出现的效应值高估的情况。尤其在前期小样本的Ⅱ期研究中都呈现比Ⅲ期结果要高估的情况下。(前期3个Ⅱ期研究数据分别为:Ⅱ期,29例,ORR为48%;Ⅱ期,40例,1-year OS为78.0%;Ⅱ期,35例,1-year OS为77.1%)。

图 9 统计学效能的计算Fig. 9 Calculation of statistical effectiveness
小样本会将疗效高估的情况在BMJ的一项Meta分析中进行过探索,该研究纳入93个随机对照研究,结果显示,按样本量的划分,100-199的研究对比1000的研究RR=0.7效应要夸大30%。对于小于50的样本量来说,效应要夸大50%左右。所以该研究也可能存在效应值被高估的情况(图10)。
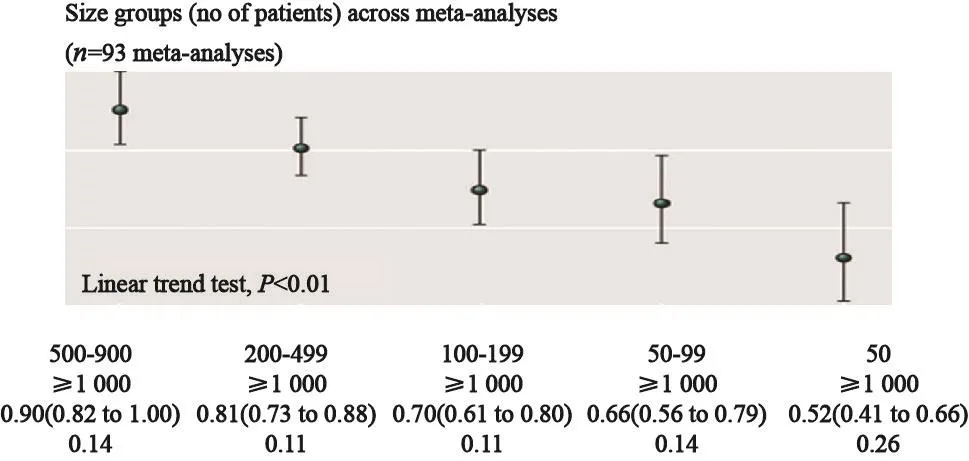
图 10 小样本高估疗效示意图Fig. 10 Diagram of small samples overestimate the effect
该研究入组人群不精准也可能是导致阴性结果的必然原因。该研究纳入的是所有腹膜转移的患者,广泛腹膜转移与单纯脱落细胞学阳性但未见腹膜结节是不同的,在临床实践中预后和治疗模式并不相同。因此,把这两个群体放在一起研究作治疗选择似乎并不合适。该研究细胞学阳性IP组占93/114(82%),SP组占31/40(78%)。同样,2016年ASCO两组的手术转化率IP组为40%,SP组为20%,如此高的手术转化率,可以推断该人群腹膜局限转移占比较高;且IP组有高达78%患者出现腹膜细胞学阴性转归,再次推断局限转移占比较高;但是局限腹膜转移患者能否真的从IP组治疗模式中获益,实现转化治疗—该研究并无法给出答案,还需针对局限转移人群设计临床研究证实。
实际IP组后续进展的比例较高,达到78%。如此高比例的进展,又如何转化为OS的获益呢(表4)?
最后,有观点认为,该研究中腹水量大的患者能够从IP治疗获益,并且亚组分析结果确实如此。如何看待亚组分析结果?首先,腹水并不是预设的分层因素,中等腹水人群只有45例,并且这45例中有38例在IP组,7例在SP组(图8)。在样本量较小且分配非常不均衡的情况下,得到阳性结果的偶然性较大。另外,同样关于校正腹水得到的阳性结果,采用的是事后调整分析。调整分析本身会使结果远离原假设,靠近备择假设,尤其在P值临界状态时,RCT研究应慎用多因素调整分析。因此得到阳性结果的偶然性很大,参考意义有限。

表 4 两组未完成治疗患者情况Tab. 4 The discontinued patients in two groups
综上,该研究虽然被认定是一个阴性的结果,但对今后探索胃癌腹膜的转移最佳治疗策略仍有借鉴作用。

