18F-FDG PET/CT在阿帕替尼治疗肺多发转移性碘难治性分化型甲状腺癌评估中的价值
张迎强,张 鑫,王 宸,李 慧,刘延晴,管文敏,王 雷,林岩松
1.中国医学科学院北京协和医学院北京协和医院核医学科,北京 100730;2.核医学分子靶向诊疗北京市重点实验室,北京 100730;3.中国医学科学院北京协和医学院北京协和医院放射科,北京 100730
甲状腺癌作为最常见的内分泌肿瘤,近年来发病率逐渐上升[1-2]。其中,碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)因其治疗手段有限、死亡率高,成为甲状腺癌研究领域的重点和难点[3-4]。阿帕替尼作为我国自主知识产权的小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),主要针对的靶点为血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)[5]。之前的研究已经证明阿帕替尼在RAIR-DTC中的快速疗效[6-7]。目前国内外对于使用TKI治疗的疗效主要使用实体瘤疗效评价标准1.1(Response Evaluation Criteria in Solid Tumors 1.1,RECIST 1.1)[8]。有1%~23%的DTC会发生远处转移,而许多RAIR-DTC的患者也表现为多发的肺转移,因此许多情况下需要选取肺内病变作为靶病灶,用以评价疗效[6-7]。因肿瘤细胞的异质性,不同病灶的生长速度及治疗疗效不尽相同。传统的RECIST 1.1往往基于CT显像,不能对不同病变的异质性进行区分。18F-FDG PET/CT作为一种分子成像手段,可以测量不同病灶的标准化摄取值(standard uptake value,SUV)从而对每个病灶进行分子水平的测量和评估。目前,在使用TKI治疗RAIR-DTC前后,尚无针对肺部多发转移灶,不同SUV摄取与其增长、缩小速度的讨论。本研究就这一方面进行探讨。
1 资料和方法
1.1 患者
分析2016—2018年于中国医学科学院北京协和医学院北京协和医院行阿帕替尼治疗的RAIRDTC患者,纳入标准如下:
① 年龄≥18岁,性别不限。② 乳头状、滤泡状、Hurthle细胞及低分化癌局部晚期或转移性分化型甲状腺癌,有可测量病灶,CT扫描长径 ≥10 mm,符合RECIST 1.1的要求。③ 在入组之前14个月内出现疾病进展(progression disease,PD),使用RECIST 1.1作为PD的评估依据。④ 放射性碘难治(满足下述条件之一):靶病灶在放射性碘治疗中完全丧失摄碘能力;患者12个月内接受单次放射碘治疗(≥3.7 GBq)且靶病灶PD;患者每2次放射性碘治疗时间间隔<12个月,剂量≥3.7 GBq,至少有1次碘治疗后超过12个月出现PD;累计接受放射性碘治疗剂量≥22.2 GBq。⑤ 使用阿帕替尼进行治疗。⑥ 靶病灶选取为肺部转移灶。⑦ 肺部多发转移灶(符合RECIST 1.1标准的转移灶≥3个)。
1.2 CT的病灶评估
由两名有经验的医师分别对病灶最长径进行测量,取其平均值作为病灶最大径,用于后续评估。总体的病情评估使用RECIST 1.1进行评价:完全缓解(complete response,CR)为原发及转移肿瘤完全消失;部分缓解(partial response,PR)为原发肿瘤最大直径下降30%以上;PD为肿瘤最大直径增加20%以上或出现新病灶;疾病稳定(stable disease,SD)为肿瘤未达到PR、CR及PD标准。对于肺部多发转移灶,选取所有RECIST 1.1规定的可测量病灶。
1.3 18F-FDG PET/CT评估及测量
患者在注射前至少24 h避免剧烈工作或运动,并禁食超过4 h。注射18F-F D G(0.15 mCi/ kg)后,患者在温暖、黑暗的房间里休息40~60 min。使用Siemens Biograph 64 TruepointTrueV PET/CT扫描仪从颅底到大腿中部进行采集(5~6个床位,每床2 min)。由两名有经验的核医学医师分别对病灶的SUVmax进行测量,取平均值用于评估病灶中18F-FDG的摄取。
1.4 统计学处理
采用SPSS 19.0和Prism 6软件进行统计分析。根据数据的不同,正态分布数值数据使用t检验,二项分布数据使用χ2检验和多层有序数据使用Mann-Whitney秩和检验分别比较两组的不同。通过线性回归分析两个变量之间的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 患者基线资料
共7例患者,49个肺转移灶纳入分析。平均年龄(59.3±12.0)岁(38~78岁),男性4例,女性3例,其中有3例患者经过之前的TKI治疗失败,具体特征见表1。基线时49个病灶平均直径为(21.1±7.8)mm(11.2~46.4 mm),经过4周的阿帕替尼治疗,病灶直径缩小为(15.5±6.6)mm(5.5~37.3 mm);经过8周治疗,病灶缩小为(13.3±6.3)mm(3.9~34.9 mm)。平均SUVmax在基线时为6.9±5.6(0.8~23.2),经过4周的治疗,SUVmax下降为2.1±1.2(0.3~5.8),8周时为1.8±1.1(0.3~4.5)。

表 1 入组患者基本信息Tab. 1 The baseline characteristics of patients
2.2 基线时糖代谢水平与治疗后的关系
共49个病灶纳入分析,基线时病灶的SUVmax水平与治疗后4周及8周的SUVmax变化(SUVmax-4w/SUVmax-baseline,SUVmax-8w/SUVmax-baseline)显著相关(回归方程Y=-0.06209×X+1.0080,R2=0.2919,P<0.0001;Y=-0.05126×X+0.8503,R2=0.3097,P<0.0001,图1)。病灶的基线SUVmax水平越高,其经过治疗后变化越明显。
2.3 糖代谢水平与病灶直径的关系
患者基线SUVmax水平(SUVmax-baseline)与基线病灶大小无明显相关(P=0.7205)。进一步使用4或8周的病灶直径除以基线的病灶直径,计算病灶直径变化率(CT4w/b,CT8w/b)。CT4w/b、CT8w/b与SUVmax-baseline无明显线性相关(P=0.6664,P=0.4787)。SUVmax-4w/SUVmax-baseline与CT4w/b及CT8w/b显著相关(Y=0.04929×X+0.6960,R2=0.0928,P=0.0333;Y=0.08096×X+0.5747,R2=0.1571,P=0.0048,图2)。
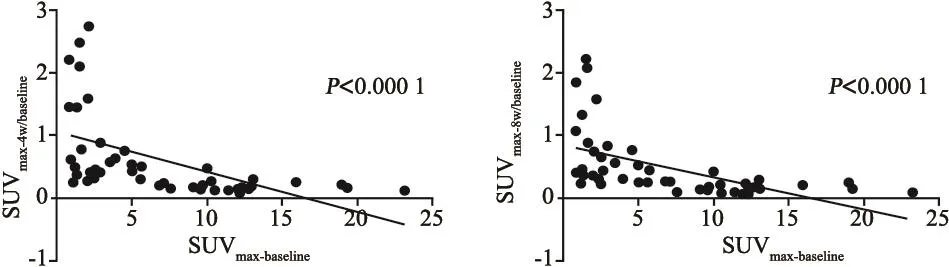
图 1 SUVmax-baseline和SUVmax变化率的线性相关关系Fig. 1 Linear regression between SUVmax-baseline and change rate of SUVmax
2.4 高代谢病灶亚组分析
我们进一步分析了基线水平SUVmax大于5的病灶,发现SUVmax-baseline与CT4w/b、CT8w/b均具有线性关系(Y=-0.009800×X+0.8499,R2=0.267,P=0.0082;Y=-0.012640×X+0.7782,R2=0.224,P=0.0169,图3)。
2.5 BRAFV600E突变与糖代谢水平及病灶直径的关系
共40个病灶纳入分析。其中原发灶BRAFV600E突变阳性的转移灶为22个,阴性为18个。阴性组中,基线的SUVmax为5.25±3.95,阳性组为11.48±5.50,差异有统计学意义(t=-4.169,P<0.001)。而BRAFV600E突变与治疗后病灶缩小程度无关(P=0.745,P=0.730)。

图 2 SUVmax-4w/baseline和直径变化率的线性相关关系Fig. 2 Linear regression between SUVmax-4w/baseline and diameter change rate

图 3 SUVmax-baseline和直径变化率的线性相关关系Fig. 3 Linear regression between SUVmax-baseline and diameter change rate
3 讨 论
甲状腺癌作为最常见的内分泌肿瘤,近年来发病率逐年上升。根据2015年中国癌症数据,其新发病例约为90000例。据文献报道,最高有23%的患者会发生远处转移,而这其中约1/3的患者会出现转移灶的不摄碘,称为RAIR-DTC[9-10]。RAIR-DTC因其有限的治疗手段及较高的死亡率成为甲状腺癌领域内研究的重点和难点。阿帕替尼作为我国自主研发小分子TKI,之前的研究已经证明了其在RAIR-DTC中的价值[6]。
Wang等[7]的研究表明,PET可以用于评估RAIR-DTC经阿帕替尼治疗后的治疗反应,与患者的PR率及无进展生存期相关,提示可以使用PET/CT对病灶和治疗反应进行早期的预测和评估。但是,由于肿瘤的异质性,对于同一个患者的不同转移灶,尽管他们的转移器官相同,但仍然有不同的增长速度及治疗反应。传统的影像学评价手段如CT等仅能对组织结构进行评估,无法对每个病灶代谢状态进行单独的评估,造成靶病灶选取不当。肿瘤细胞代谢旺盛,18F-FDG作为应用最为广泛的代谢显像剂,可以定量分析肿瘤的糖代谢情况。本研究发现,病灶基线水平的SUVmax与治疗后其SUVmax的变化呈线性相关(P<0.0001),病灶的SUVmax越高,其经过治疗后的下降越明显。之前的研究已经证明,肿瘤FDG的摄取程度与新生血管,特别是血管内皮生长因子(vascular endothelial growth factor,VEGF)的水平相关[11-12]。而本研究中的结果可能是由于SUVmax可以反映病灶的糖酵解程度,糖酵解活跃的病灶代谢旺盛,需要有更多的血管来促进自己的生长,因而对于抗新生血管药物的反应也较好。
研究表明,肿瘤糖代谢水平的改变往往比形态学更为早期和敏感[13]。而在甲状腺癌领域,刘敏等[14]的研究显示,治疗前后18FDG-PET/CT的代谢学评价标准在疗效评价与预后评估方面比形态学评价标准更及时、准确。本研究也发现,在SUVmax>5的病灶中,基线SUVmax-baseline与肿瘤直径的变化明显相关(P=0.0082,P=0.0169)。这为患者的早期评价提供了一种新的手段,即可以使用基线的18F-FDG PET/CT来对患者的远期预后及治疗反应进行预测。因此,我们可以根据患者基线的18F-FDG PET/CT水平来预测患者的远期疗效,有目的地选择评估病灶,有利于更全面准确地对患者的治疗效果进行判断。
BRAFV600E是分化型甲状腺癌,特别是甲状腺乳头状癌最常见的分子事件。有研究表明,BRAFV600E突变的患者其预后更差,死亡率更高[15]。许多研究表明,BRAFV600E突变的分化型甲状腺癌,特别是甲状腺乳头状癌,其18F-FDG PET/CT的SUVmax水平增高[16-18],与本研究结果类似,提示对于难治性的肺转移灶,也具有相同的特征。而BRAFV600E突变与否与患者经过TKI治疗后的治疗反应无关,这也与之前索拉非尼、阿帕替尼的相关研究结果类似[6-7,19]。
该研究仍有不足,如患者例数较少,尚需大样本研究。由于促甲状腺激素(thyroidstimulating hormone,TSH)水平能促进肿瘤对FDG的摄取、提高阳性率[20],本研究中的患者TSH控制水平均小于0.1,避免了TSH水平差异造成的结果偏差,但其SUV存在低估可能。此外由于随访时间限制,部分患者仍未出现终点事件等,无法进行病灶与预后分析。
18F-FDG PET/CT在RAIR-DTC多发肺转移患者靶向药物治疗中具有广阔的应用前景,可以辅助选取靶病灶,并通过病灶的SUVmax预测靶向药物的治疗效果。

