HPLC测定维生素ADE注射液中三种维生素的含量
吴春燕,张金宝,刘海艳,李文财,冯 岩,王 莉,任建军,张玉彦*
(1.宁夏兽药饲料监察所,银川 750011;2. 西北农林科技大学动物科技学院,杨凌 712100;3. 宁夏智弘生物科技有限公司,银川 750021)
维生素ADE注射液是以维生素A、维生素D和维生素E为主药,辅以其他溶剂,制备成的营养补充类物质,用于预防和治疗动物维生素A、维生素D和维生素E缺乏症[1-3],该制剂正在申报5.1类新兽药。目前,测定脂溶性维生素A、维生素D3和维生素E的方法主要包含分光光度法和HPLC法[4-5],其中分光光度法是通过测定吸收度而确定样品含量,因样品中的辅料会对吸收度造成干扰而影响含量检测,须经过皂化和提取等预处理过程后进行检测;HPLC法具有灵敏度高、操作简单和重现性好等特点,但是样品同样须经过繁琐的预处理过程后,方能进行含量检测。根据维生素A、维生素D3和维生素E均溶于乙醇的物理特性,结合相似相溶原理,采用无水乙醇直接提取的方法,并建立了以甲醇为流动相A、乙腈-乙醇-水(60∶25∶5)为流动相B的反相HPLC法,能有效分离维生素A、维生素D3和维生素E,来满足实际生产过程中对检验时间及结果的需求。结果表明该方法操作简单、结果准确,可用于成品及中间体的检测。
1 材 料
1.1 仪器 上海梅特勒托利多仪器有限公司AB265-S电子天平;日本岛津LC-2010C高效液相色谱仪。
1.2 试药与试剂 维生素A棕榈酸酯对照品,购自德国J&K Scientific Ltd,批号为LJ10P49,含量1790,000 U/g;维生素D3对照品,购自中国食品药品检定研究院,批号为100061-201208,含量99.8%;维生素E对照品,购自中国食品药品检定研究院,批号为100062-201110,含量97.7%;维生素ADE注射液,宁夏智弘生物科技有限公司生产,批号为20121001,规格 10 mL:维生素A 1,000,000 U+维生素D3 100,000 U+维生素E 3,000 U;所有试剂均为色谱级。
2 方法与结果
2.1 色谱条件 Agilent ZORBAX SB-C18色谱柱(150 mm×4.6 mm,5 μm);甲醇为流动相A,乙腈-乙醇-水(60:25:5)为流动相B,按表1进行梯度洗脱;检测波长为265 nm;流速为1.5 mL/min;柱温为室温;进样量为20 μL。

表1 梯度洗脱
2.2 溶液的配制
2.2.1 对照品溶液 精密称取维生素A棕榈酸酯对照品、维生素D3对照品和维生素E对照品各适量,用无水乙醇制成每1 mL中约含维生素A棕榈酸酯1000 U、维生素D3 100 U、维生素E 3 U的溶液,滤过,即得。
2.2.2 供试品溶液 精密量取本品1 mL,置100 mL量瓶中,加无水乙醇稀释至刻度,摇匀,滤过,即得。
2.3 方法学考察
2.3.1 专属性 精密吸取20 μL空白溶剂、阴性溶液(不含主药)、对照品溶液和供试品溶液,按上述色谱条件,注入色谱仪,记录色谱图,结果如图1所示,空白溶剂及阴性溶液对三种组分含量测定无干扰。
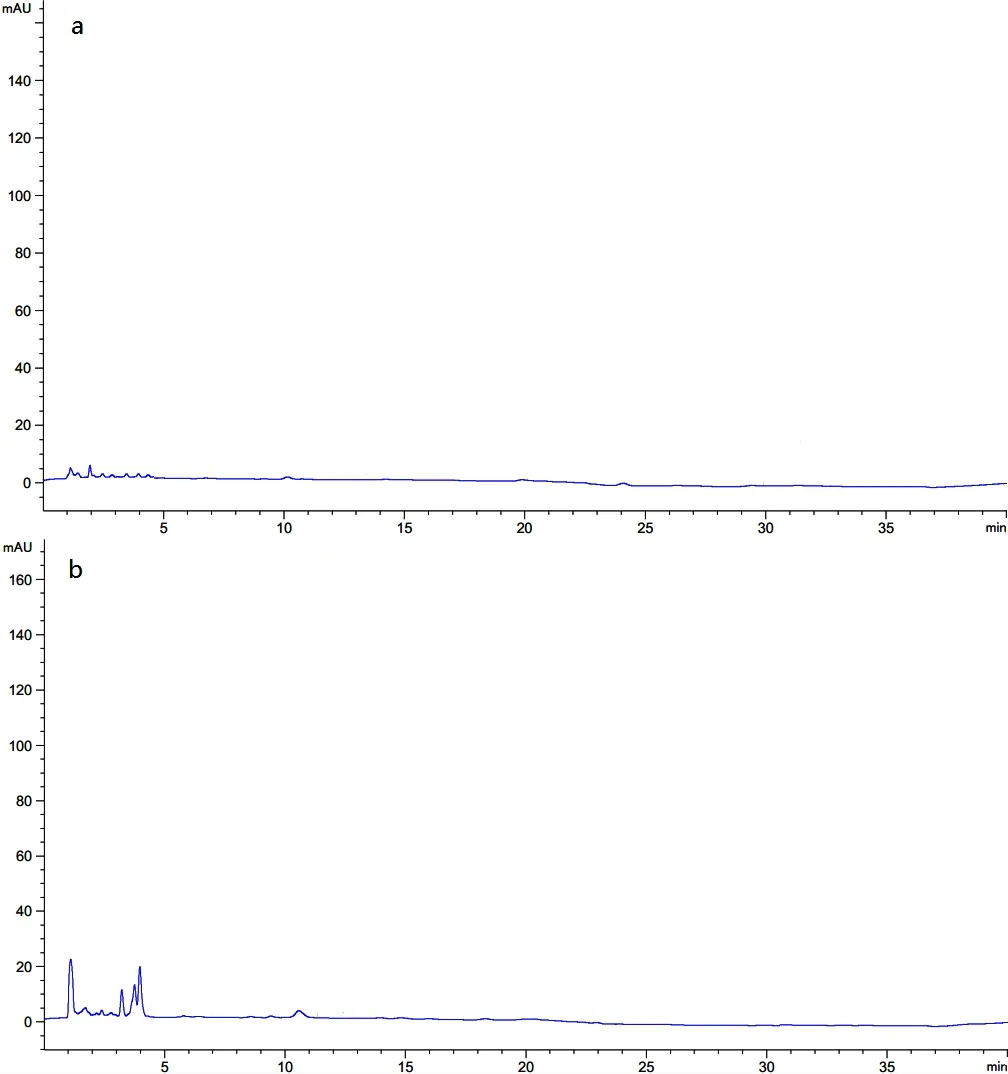
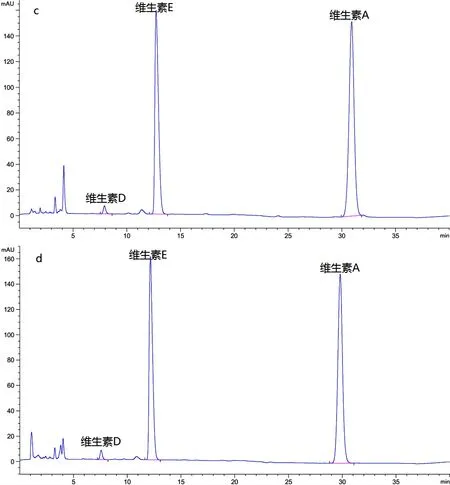
(a:空白溶剂图谱;b:阴性溶液图谱;c:对照品图谱;d:供试品图谱)
2.3.2 线性 精密称定维生素A棕榈酸酯、维生素D3、维生素E对照品适量,加无水乙醇制成每1 mL中含维生素A棕榈酸酯6096 μg、维生素D3 256 μg、维生素E 30023 μg的混合液,精密量取上述对照品混合液0.1、0.2、0.6、1.0、1.5、2.0 mL,分别置于10 mL量瓶中,加无水乙醇稀释至刻度,摇匀,滤过。按上述色谱条件,精密量取20 μL,注入色谱仪,记录色谱图。以样品浓度为x(μg/mL),平均峰面积为y,进行线性回归。结果回归方程(n=7)和相关系数分别为维生素Ay=7.3235x+24.297,r2=1;维生素D3y=4.5714x+0.77738,r2=0.99995;维生素Ey=1.2036x+33.179,r2=0.9999。实验结果表明,维生素A、维生素D3和维生素E分别在60.96~1219.20 μg/mL、2.56~51.20 μg/mL和300.23~6004.60 μg/mL范围内线性关系良好。
2.3.3 准确度 精密量取对照品溶液40 mL、50 mL和60 mL各3份分别置100 mL量瓶中,再分别精密量取0.50 mL供试品加入至上述各100 mL量瓶中,加无水乙醇至刻度,摇匀,滤过,即得样品溶液。供试品溶液作为本底溶液。按上述色谱条件,精密量取20 μL,注入色谱仪,记录色谱图,结果如表2,平均回收率大于99%,说明检测方法的准确度良好。
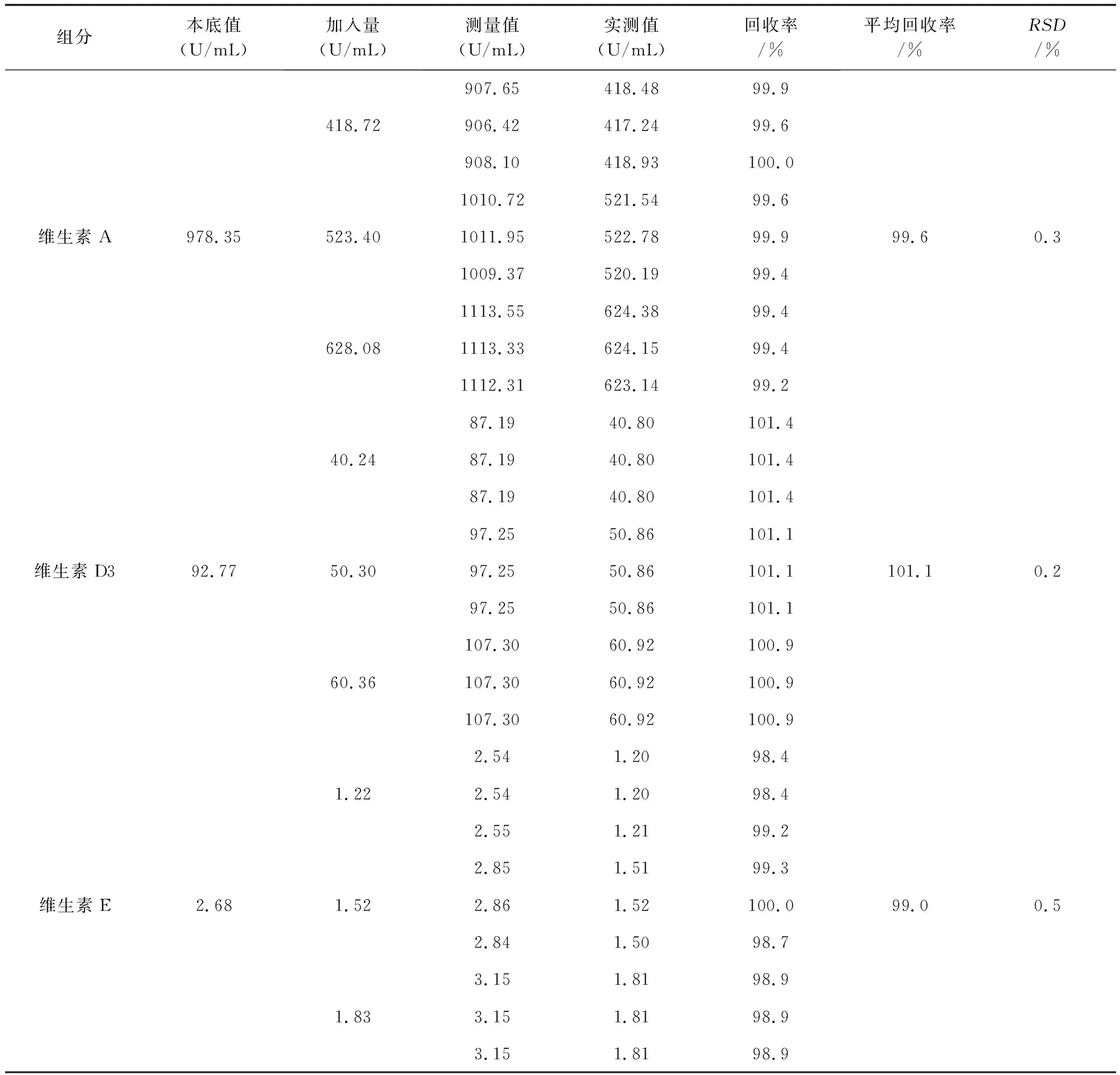
表2 准确度结果
2.3.4 精密度
2.3.4.1 重复性试验 取6份供试品,照2.2.2项下方法制备供试品溶液,测定供试品溶液中三种维生素的含量,结果如表3,RSD均小于1.0%,说明重复性良好。

表3 重复性结果
2.3.4.2 中间精密度 由A、B、C三人,分别取2份供试品,照2.2.2项下方法制备供试品溶液,测定供试品溶液中三种维生素的含量,结果如表4,RSD均小于0.5%,说明精密度良好。
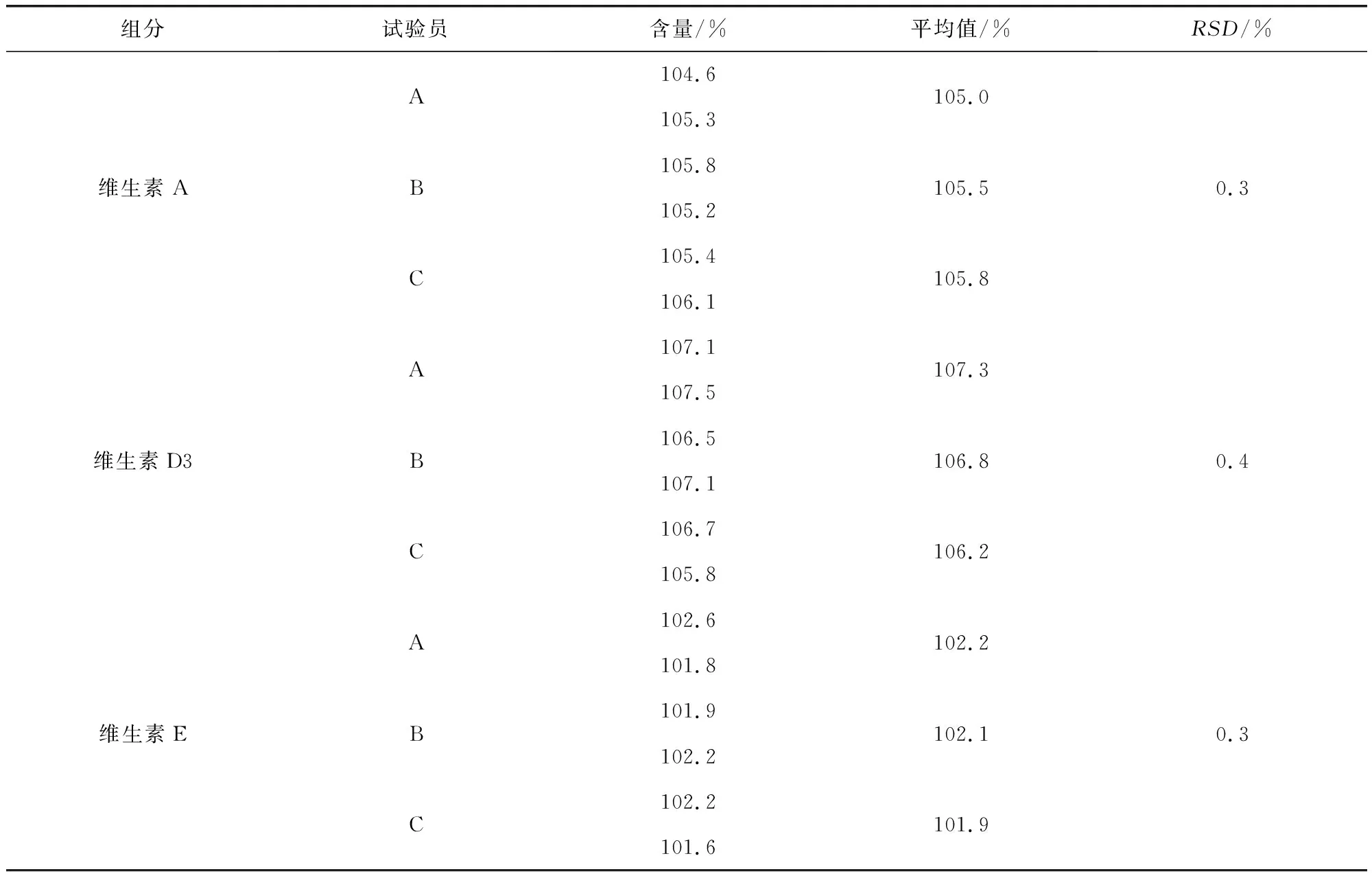
表4 中间精密度结果
2.3.5 稳定性 取1份供试品,照2.2.2项下方法制备供试品溶液,分别在0、3、6、9、12 h进样20 μL,测定供试品溶液中三种维生素的含量, 结果如表5,RSD均小于1.0%,说明制备后12小时内测定基本稳定。
2.3.6 耐用性 考察不同的流动相、柱温和流速对含量测定的影响,按上述色谱条件,精密量取20 μL,注入色谱仪,记录色谱图,结果如表6,在流动相、柱温和流速出现小的变动时,含量测定基本不受影响。
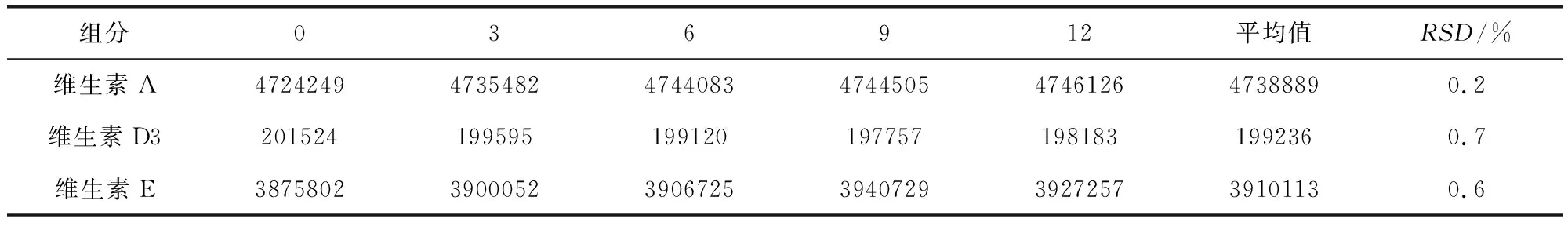
表5 稳定性结果(n=4)
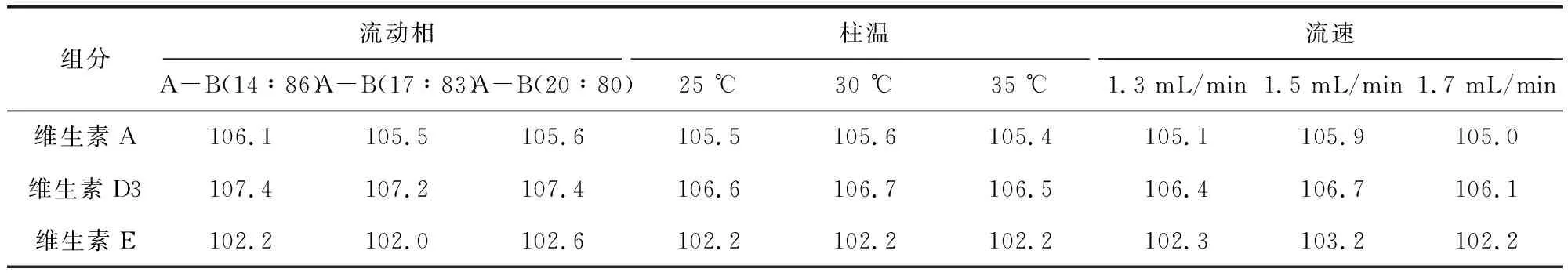
表6 耐用性-流动相、柱温、流速结果
3 讨 论
3.1 检测方法的选择 截止到目前,维生素的分析方法主要包含微生物法、生物鉴定法、化学法和仪器法四大类[6],其中微生物法仅用于测定水溶性维生素的含量,生物鉴定法用于分析样品生物利用率,化学法用于特定维生素的检测,仪器法用途较为广泛。随着科技的不断发展,高效液相色谱法已逐步成为常规的含量检测手段,该方法具有快速、灵敏等特点[7]。本文研究的HPLC法能够在40 min内,有效分离维生素A、维生素D3和维生素E,满足了实际生产过程中对检验时间及结果的需求。
3.2 提取方式的选择 目前,脂溶性维生素的提取方式主要以皂化法为主,通过皂化法处理样品,水洗去除类脂物后,用有机溶剂提取脂溶性维生素,浓缩后将样品溶于适当的溶剂中进行测定[8]。在整个提取过程中,为了避免维生素的氧化降解,通常采用加入抗氧剂、充氮气和避光等方法进行操作。由此可见,采用皂化法进行脂溶性维生素的预处理,是较为繁琐的过程,同时整个过程中容易出现提取不完全的现象,并且过程的复杂性对含量结果的准确度具有很大影响,因此选择更简单、快速的提取方式,是进行脂溶性维生素检测所需要关注的重点方向。根据维生素A、维生素D3和维生素E均溶于乙醇的物理特性,结合相似相溶原理,采用无水乙醇直接提取的方法进行含量测定,通过方法学验证结果说明该提取方法是可行的。
3.3 检测波长的选择 根据文献报道,结合实际紫外可见全波段扫描发现,维生素A、维生素D3、维生素E的最大吸收波长分别为325 nm、265 nm和290 nm[9],样品中维生素D3的占比较小,而且在265 nm波长处维生素A和维生素E具有较好吸收。因此,选择265 nm吸收波长作为检测波长[10-11],既降低了对检测器的要求,扩大了方法的适用性,又满足了三种维生素的检测灵敏度要求,最终达到了简化检测方法的目的。
3.4 流动相的选择 采用HPLC法检测脂溶性维生素常用的流动相有甲醇、乙醇、乙腈、乙酸乙酯、异丙醇和水等组成[12-14]。本研究先后采用甲醇-水、乙腈-乙醇-水和梯度洗脱等方式,发现以甲醇为流动相A,乙腈-乙醇-水(60∶25∶5)为流动相B,进行梯度洗脱时,维生素A、维生素D3和维生素E能有效分离、峰型对称、无干扰,并且通过方法学验证结果说明该流动相是合适的。
4 结 论
HPLC法测定维生素ADE注射液中维生素A、维生素D3和维生素E含量方法可行,供试品溶液三个主峰的保留时间与对照品相应三个主峰的保留时间一致,样品分离效果较好,有很好的专属性、准确度、重复性、中间精密度、稳定性和耐用性。

