广东省鹅细小病毒的分离及序列分析
黄冠雄,许丹宁,杨舒展,郭斯璇,曾依翎,黄运茂,田允波,曹 楠
(1.仲恺农业工程学院动物科技学院/广东省水禽健康养殖重点实验室,广东 广州 510225;2.广东省出入境检验检疫局技术中心,广东 广州 510623)
鹅细小病毒(goose parvovirus,GPV)是鹅和番鸭的主要病原体,对雏鹅和雏番鸭有高发病率和高死亡率[1]。 GPV属于单链线性DNA病毒,具有约5 100个核苷酸,含两个主要开放阅读框(ORF)和末端重复序列(ITR),左侧的ORF编码主要参与病毒复制和转录调节的非结构蛋白,另一个ORF编码包含VP1、VP2和VP3的衣壳蛋白,3种蛋白具有相同的C端。VP蛋白是GPV的主要免疫保护性抗原,可诱导水禽产生中和抗体[2-3]。正常情况下,由于GPV的VP基因保守性高,预防和控制GPV的主要途径是接种疫苗[4-5]。日本[6]、英国[7]、匈牙利[8]、瑞典[9]、法国[10]和美国[11]等国家相继报道了鹅细小病毒的发生。我国主要的水禽养殖地区,如福建[12]、江苏[13]、四川[14]和山东[15]等也有越来越多鹅细小病毒暴发的报道。
近年来,随着水禽养殖行业的不断发展,GPV在广东省的病例也越来越多。然而,广东省已有10年没有针对GPV进行系统的流行病学调查,无法掌握广东省GPV流行毒株是否发生变异,也不清楚现有的GPV疫苗是否能诱导鹅和番鸭产生中和目前存在的GPV的抗体。鉴于此,我们从广东省鹅和番鸭养殖场中收集病料并分离病毒,分析了GPV的VP基因,以研究广东地区2016—2017年GPV的流行和变异情况。
1 材料与方法
1.1 样品采集
在广东省鹅主要养殖区收集被GPV感染的鹅的肝脏。通过琼脂扩散法进行病毒抗原检测。
1.2 病毒分离
使用Hanks缓冲液制备混合的肝脏匀浆,冻结3次,然后以10 000 r/min离心10 min。使用注射器通过0.22 μm过滤器过滤后,将每个胚胎的0.2 mL悬浮液接种到9日龄GPV阴性鹅胚尿囊腔中。每天检查接种鹅胚存活,如果胚胎存活,则在接种后第6天收集尿囊液并汇集一起,用于接种无GPV的鹅胚胎以进一步传代;如果胚胎死亡,则通过琼脂扩散法测试尿囊液和内脏器官的鹅细小病毒抗原。
1.3 PCR检测及VP基因扩增
按照病毒DNA提取试剂盒(Omega)说明书提取细小病毒DNA,应用特异鉴别引物鉴别GPV后扩增VP基因,引物如表1所示。PCR反应条件如下:95℃预变性5 min;95℃ 30 s、54℃30 s、72℃ 30 s,30个循环;72℃ 10 min。扩增后的DNA片段经1%琼脂糖凝胶电泳后,使用PCR纯化试剂盒(Omega)纯化PCR产物,然后送至英潍捷基公司进行测序。
1.4 氨基酸差异分析
为了确定2个分离的GPV与其他水禽细小病毒之间的序列关系,将获得的序列与GenBank核苷酸序列数据库中的条目进行比较。使用MEGA v5.05程序通过Clustal W方法比对核苷酸序列。
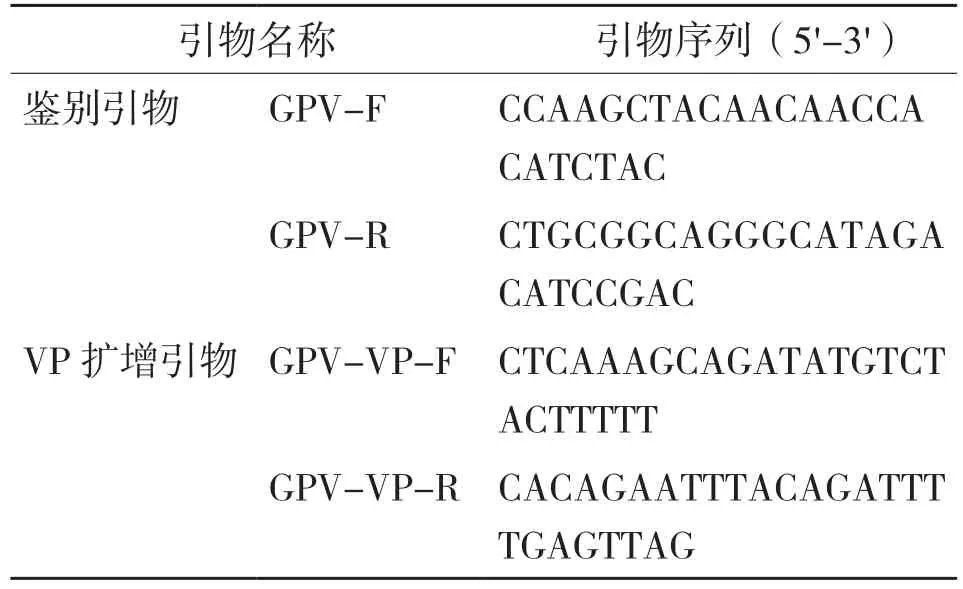
表1 GPV鉴别引物和VP基因扩增引物
1.5 系统发育分析
为了比对和分析序列,从GenBank数据库下载了多个具有代表性的GPV序列。使用Lasergene 7.1(DNASTAR,Madison,Wisconsin,USA)编辑和分析全基因序列。采用遗传分析软件MEGA 5.05用ML方法绘制VP基因发育进化树。
1.6 正负选择地点的估计和选择压力
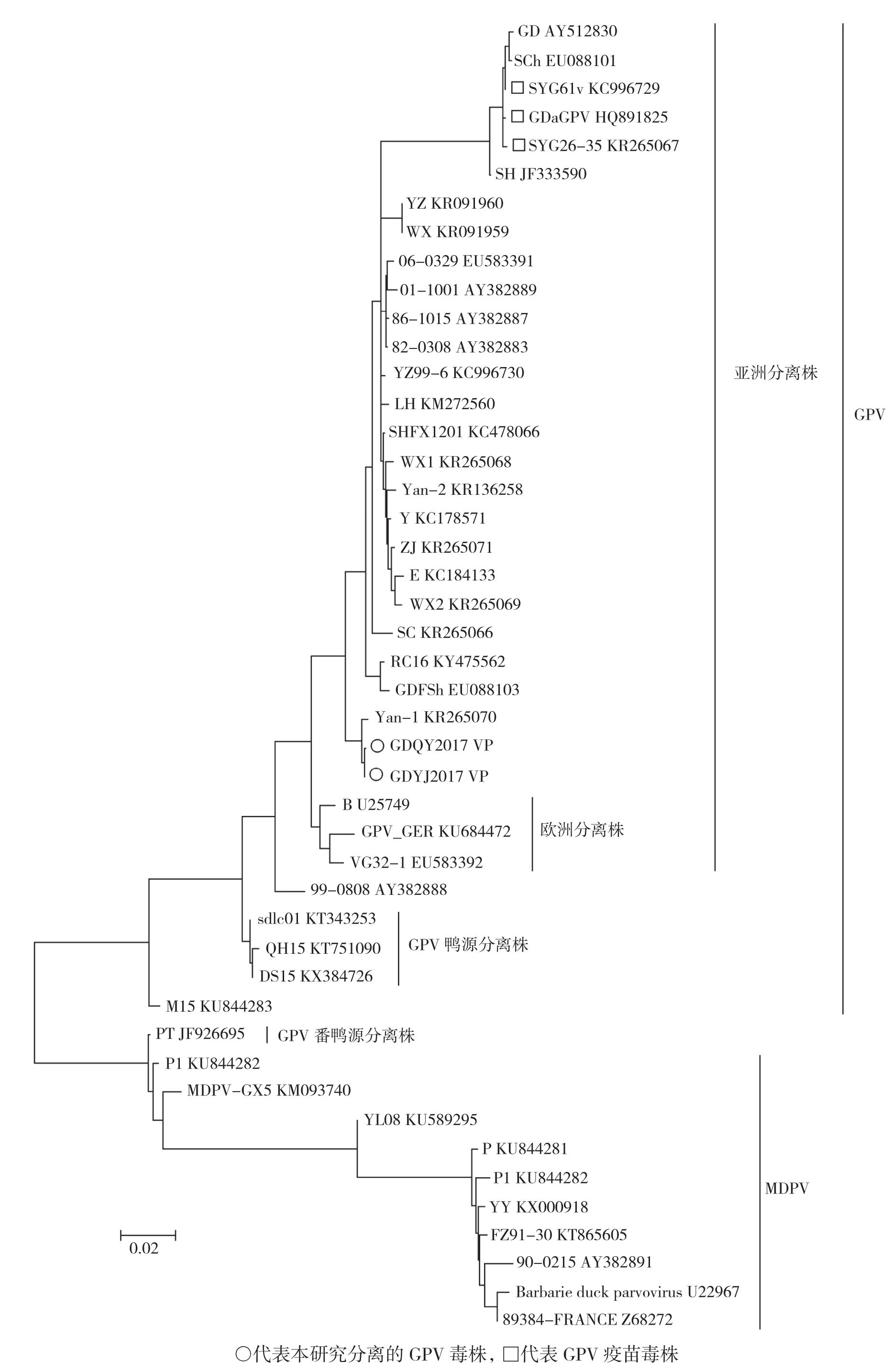
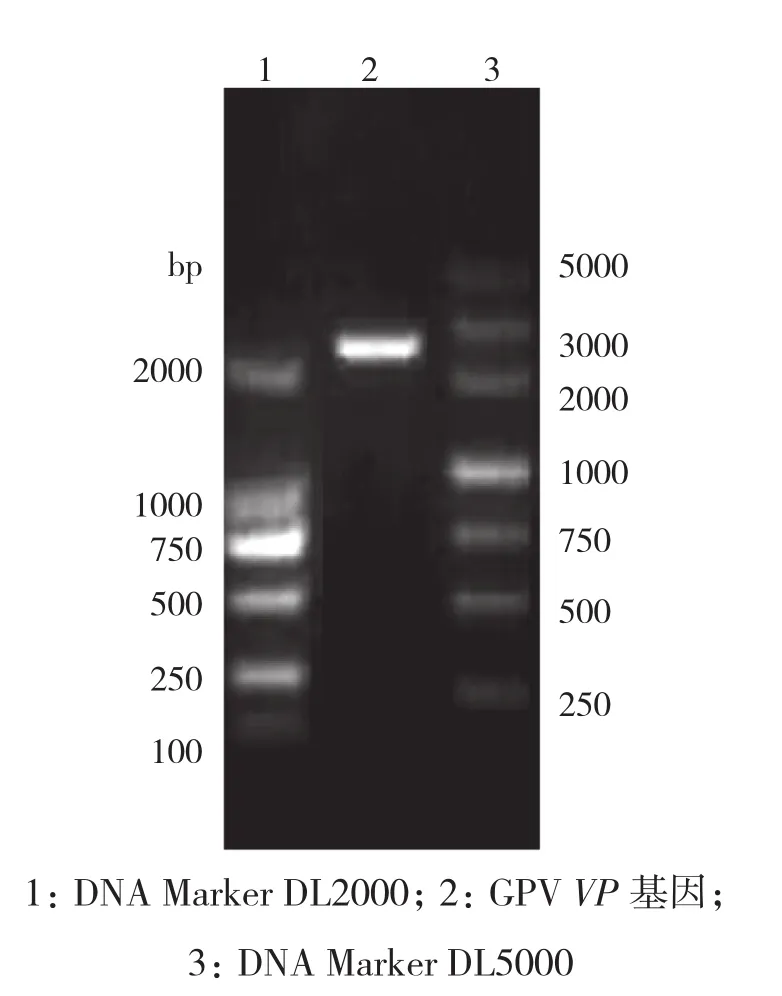
为了全面估计GPV VP基因的选择压力,通过Datamonkey数据分析网站,使用SLAC、FEL和IFEL方法计算每个密码子的非同义(dN)和同义(dS)替换率[16],2种或2种以上方法预测氨基酸位点同为阳性或阴性方才有效。如果P值<0.05则判定为阳性(dN> dS),反之则为阴性(dN 将采集的病料处理后接种鹅胚,发现有2份采集的病料3~6 d内有死胚现象,对照生长发育正常。收集鹅胚的尿囊液,提取DNA后进行PCR并电泳。从图1可见,2份致死鹅胚的病料在400 bp左右出现条带,而阴性对照没有条带。将2株GPV分离株分别命名为GDQY2017和GDYJ2017。 利用VP基因扩增引物扩增得到PCR产物,经电泳后,在2 000 bp左右出现与预期大小相符的片段(图2)。 图1 GPV鉴别PCR结果 图2 GPV VP基因PCR扩增结果 从GenBank中下载中国大陆和其他国家及地区报道的水禽细小病毒的完整VP基因,与本研究分离的2株GPV进行序列分析并绘制VP基因的系统进化树。结果(图3)显示,水禽细小病毒明显分为两个遗传谱系,一个是从鹅和鸭中分离的鹅细小病毒(GPV),另一个是番鸭细小病毒(MDPV)。此外,来自不同地区和不同采集时间的GPV呈复杂化,GPV聚集成不同的遗传群体。 鸭源GPV毒株(KT343253和KT751090)和减毒GPV毒株(KX384725)形成不同于经典GPV毒株的进化谱系。欧洲分离株和亚洲分离株也分别形成不同的谱系。目前的GPV疫苗株(GD、GDaGPV和SYG61v)共同形成一个单独的进化分支。值得注意的是,本研究从广东分离到的2株GPV毒株形成一个单独的分支,与广东原始GPV株GDFSh以及GPV疫苗株SYG26-35、GDaGPV和SYG61v不在同一分支上。 预测鹅细小病毒VP基因的dN/dS值,以确定本研究的2株GPV分离株在选择压力下阳性位点的数量和位置,如图4所示,dN/dS比率为0.145474,116位点为阳性选择位点(氨基酸变化:Arg → Gln)。 GPV的毒力和抗原性与VP蛋白的氨基酸序列有关。从表2可以看出,2株分离的GPV毒株只有2个氨基酸存在差异,表明这2株病毒的相似性很高。然而,与3种疫苗株相比,这5种病毒总共有22个氨基酸残基差异,其中15个位于VP3蛋白中。虽然GPV的受体结合位点(Asn-489和Asn-650)没有发生变异,但是位于受体结合位点附近的476、637氨基酸位点处的变化可能影响现有的GPV疫苗对流行毒株的防控效果。此外,值得注意的是,本研究分离的2株GPV毒株在116位点的氨基酸与3株GPV疫苗株均不同。考虑Arg116Gln是阳性选择位点,这可能是现有的GPV疫苗不能完全保护水禽的原因。本研究中分离的2株GPV与疫苗株相比没有发生糖基化位点数量和位置的改变。 鹅细小病毒病是引起雏鹅和雏番鸭高致病率和高致死率的重要疾病,预防和控制鹅细小病毒的主要方式是对种鹅接种灭活疫苗。然而,接种了疫苗的鹅和番鸭体内产生的抗体滴度不足以传递给雏鹅或雏番鸭,这可能是鹅细小病毒广泛流行的原因[9,12,17]。广东省 GPV 疫情逐年增加,造成巨大的经济损失。这一现象表明,广东省的鹅细小病毒疫苗可能并不足以保护水禽。 图3 水禽细小病毒VP基因的系统发育树 图4 鹅细小病毒VP基因点对点选择压力分析结果 表2 2株GPV分离株和3株GPV疫苗株氨基酸差异 VP是鹅细小病毒的结构蛋白,VP3是鹅细小病毒衣壳蛋白的主要成分,也是主要的保护性抗原,可以刺激水禽产生抗体。本研究中,广东地区分离的2株GPV和3株GPV疫苗株中,大多数氨基酸突变发生在VP3蛋白中。从系统发育分析的结果可知,2株GPV分离株具有高度同源性,形成一个单独的遗传分支,并且与GPV疫苗株(SYG61v、SYG26-35和GDaGPV)和GPV毒力B株进化关系较远。这可能由于广东省内居民具有偏喜欢消费本地鹅种的特殊饮食习惯,导致当地品种鹅在省内广泛交易,从而使得GPV在广东省内广泛流行,并且单独形成了一个遗传演化谱系。 细小病毒衣壳表面上的凹痕或突起负责识别受体[18],而糖脂、聚糖和糖蛋白可作为受体协助细小病毒进入宿主细胞[1],这意味着氨基酸的变化可能导致蛋白质空间结构或理化性质的改变,从而使得病毒不能进入宿主细胞内[19]。AAV-2的VP蛋白中的5种氨基酸(Arg-484,Arg-487,Lys-532,Arg-585和Arg588)是其受体结合位点[20-21],而 GPV 的VP蛋白与AAV-2相似度高,因此GPV在484、487、532、585、588位点的氨基酸变化或这5个位点附近的氨基酸变化可能导致GPV毒力的变化[22]。Fan 等[1]研究表明,鹅细小病毒在 489位的突变可能使鹅细小病毒的宿主从鹅扩展到鸭的原因。 一般而言,由于病毒可能经历强烈的选择压力,使得病毒蛋白质中存在阳性选择位点[23]。本研究分离的2株GPV在Arg116Gln的变化可能是由疫苗接种或其他因素的选择压力导致的,这可能造成疫苗产生的抗体不能识别及中和病毒,甚至在接种疫苗后也导致免疫失败。本研究结果为中国东南部养鹅行业疫苗的广泛失效提供了解释[28]。 综上所述,本研究利用系统发育分析方法分析了2株广东GPV毒株及其他水禽细小病毒毒株的完整VP基因序列,证实广东GPV进化为仅在广东省流行的新遗传群,GPV的进化和突变导致抗原结合位点之间氨基酸残基改变,这可能导致目前市场流通的GPV疫苗无法预防和控制水禽GPV的流行。因此,应适时选择候选GPV毒株进行疫苗生产,特别是在某个地理区域。2 结果与分析
2.1 GPV的分离鉴定及VP基因的扩增

2.2 2株GPV分离株 VP基因的系统发育分析
2.3 选择压力分析
2.4 2株GPV分离株与GPV疫苗株的VP氨基酸序列比较
3 讨论