邻苯二甲酸酯高效降解菌的筛选及表征
杨 捷, 姚炎华, 尹大强, 叶秀云
(1. 福州大学 福建省海洋酶工程重点实验室, 福建 福州 350116; 2. 同济大学 长江水环境教育部重点实验室,上海 200092)
邻苯二甲酸酯类(phthalate esters ,PAEs)作为塑料添加剂和软化剂广泛用于塑料产品、皮革、建筑材料、个人护理产品、洗涤剂、油漆等产品中[1].PAEs的一般结构由一个苯环和两个侧链组成,不同的PAEs的区别在于侧链基团的不同.PAEs的种类繁多,包括具有简单侧链基团的邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP),和具有复杂侧链基团的邻苯二甲酸丁苄酯(benzyl butyl phthalate,BBP)、邻苯二甲酸二(2─乙基己)酯(di-2-ethylhexylPhthalate,DEHP).在塑料制品中,PAEs以氢键或范德华力与塑料连接,这种不牢固的化学键使PAEs较容易从塑料中释放出来,造成了对大气、水体、土壤的污染[2].PAEs已成为全球最普遍的有机污染物之一,多种PAEs在全球主要工业国的生态环境中都达到了普遍检出程度,其中DBP、DEHP、DMP最常被检测出[3],浓度一般在mg·L-1级别.在增塑剂生产过程产生的污水属于高浓度有机污染废水,PAEs浓度高[4].
PAEs是一类具有类似于雌激素作用的内分泌干扰物,且对动物具有致畸性、致突变性、致癌性以及生殖毒性[5],具有低浓度长期危害特征.其污染控制己受到全球性关注,美国环保局(EPA)、中国环境监测总站及欧盟都将DBP、BBP、DEHP、DEP等多种PAEs列为优先控制污染物[6].
PAEs很难降解,在自然环境中通过水解、光解的速率非常缓慢.处理PAEs 污染物的现有技术主要有吸附、光化学氧化、生物降解等.吸附法和光化学氧化法成本高,且容易造成二次污染.微生物降解是自然界中PAEs去除的主要方式,具有清洁经济的特点,得到科研人员的广泛关注[7].DBP作为最常用的PAEs,许多研究人员从环境中筛选DBP的降解菌.已报道的DBP降解菌普遍降解浓度较低,仅在mg·L-1水平,且降解其他(如长链)PAEs的效率不高[8-9],因此有必要筛选出降解能力更强、降解条件和底物范围更广的DBP降解菌,以提高微生物在降解PAEs中的应用价值.
本研究从土壤中筛选到能够高效降解DBP的菌株,通过生理生化以及16S rDNA等将其鉴定为寡养单胞菌(Stenotrophomonassp.),并测试其底物范围及探究降解DBP的条件、降解动力学,可为PAEs的污染治理提供理论支持.
1 材料与方法
1.1 材料
土样采自福建省福州市晋安区新店镇红庙岭垃圾综合处理场.试剂:DBP、DEHP、DMP、BBP、DEP、苯胺、甲苯和邻苯二甲酸、三氯甲烷(均为分析纯)、甲醇(色谱纯/分析纯)均购自国药试剂有限公司 ;用水为超纯水 其余无机盐试剂均为分析纯.
基础无机盐培养基(mineral salt medium,MSM)(成分的单位:g·L-1):K2HP045.8 g,KH2P044.5 g,(NH4)2S042.0 g,MgCl20.16 g,CaCl20.02 g,Na2MoO4·2H2O 0.002 4 g,FeCl30.001 8 g,MnCl2·2H2O 0.001 5 g,pH 7.0.121℃高压灭菌20 min.
底物培养基:液体培养基是在试管中加入甲醇溶解的DBP、DEHP、DMP、BBP、DEP、苯胺、甲苯和邻苯二甲酸母液,水浴加热使甲醇蒸发,待甲醇完全蒸发后再加入MSM配制成所需浓度的各类底物液体培养基.DBP固体培养基是DBP液体培养基加2%的琼脂.121℃高压灭菌20 min.
1.2 降解菌的筛选
称取土样5 g于100 mL 含5%的DBP液体培养液中,采用10%、15%、20%的DBP浓度梯度压力法驯化,30 ℃,150 r·min-1振荡培养7 d,再转接2 mL菌液至下一浓度梯度的DBP液体培养基培养.20%的DBP的菌液进行梯度稀释104倍后涂布于DBP固体平板上,30 ℃有氧恒温培养,通过划线在DBP固体平板上反复纯化,重复多次,直至菌落形态单一.挑取单菌落,在LB(Luria-Bertani)培养基中富集培养.
1.3 降解菌的分子生物学鉴定
用细菌基因组脱氧核糖核酸(DNA)提取试剂盒(OMEGA公司)提取细菌的总DNA,以其为模板,用16S rDNA特异性引物27F与1492R,进行16S rDNA扩增.
聚合酶链式反应(polymerase chain reaction, PCR)产物经1% 琼脂糖凝胶电泳检测后,委托上海英潍捷基生物技术有限公司测序.将测序结果与NCBI数据库中Blastn 程序进行序列同源性检索和比对,并通过MEGA7.0软件,构建系统发育进化树,分析确定该菌的分类地位.
1.4 PAEs的测定
采用高效液相色谱法(HPLC)测定PAEs含量:将菌体与液体培养基8000 r·min-1离心3 min.用三氯甲烷分别对菌和液体进行两次萃取得到PAEs,待三氯甲烷挥发后,加入甲醇定容至5.0 mL.用孔径为0. 22 μm的有机相过滤器过滤后,用高效液相色谱仪(DGC-20A3R型,岛津公司)测定液体中PAEs的含量.
HPLC分析条件:色谱柱Agilent?ZORBAX SB-C18(4.6 mm×150 mm×5 μm),柱温35℃,流动相甲醇与水体积比为90∶10,流速为0.5 mL·min-1,检测器波长为228 nm,进样量为20 μL.利用HPLC测定PAEs的残留量.
1.5 生长量的测定
取菌液1 mL,离心分离,用MSM重悬菌液,紫外分光光度计(T6系列,上海普析通用仪器有限责任公司)测OD600,即为菌株的生长量.
1.6 底物特异性
挑取在DBP固体培养基中生长良好的单菌落,置于LB液体培养基中30 ℃,175 r·min-1培养10 h.离心收集菌体、重悬,配制菌体浓度OD6000.1.无菌条件下,吸取菌液,接种量于4 mL,8种10 g·L-1液体底物(DBP、DEHP、DMP、BBP、DEP、苯胺、甲苯和邻苯二甲酸)培养基中,pH 7、30 ℃、150 r·min-1摇床培养5 d.紫外分光光度计测定生长量,高效液相色谱法分析8种底物的残留量.
1.7 DBP降解条件的优化
分别探究不同的DBP初始浓度、pH、温度、摇床转速及葡萄糖添加量在72 h内对菌生长和降解DBP的影响.所有实验数据均为三次平行实验的平均值,数据采用Excel软件进行分析,图中误差线为三次平行实验的标准差.
1.8 降解动力学
分别探究初始质量浓度为1、5、10、20、50 g·L-1的DBP,在最佳培养条件下,每隔8 h测定72 h内DBP的残留量,每个样品设置三组平行.用软件GraphPad Prism5.0(GraphPad Software, Inc, USA)拟合实验数据,构建降解动力学模型,得出B3降解DBP的半衰期和速率常数.直观体现出时间和PAEs残留量的关系以及降解速率的变化.进一步研究出B3的降解DBP的特性,完善微生物降解PAEs有机污染物的研究.一级动力学模型可用方程表示:Y=(Y0-rPla)·e-Kt+rPla,Y表示DBP的质量浓度,g·L-1;Y0为初始质量浓度,g·L-1;rPla为无限时间后DBP残留质量浓度,g·L-1;K为速率常数,半衰期t1/2= ln 2/K,初始降解速率v0= dY/dt=(Y0-rPla)·K·e-Kt,t→0.v0的单位为g·L-1·h-1.
2 结果与讨论
2.1 降解菌的鉴定
经过富集培养,分离得到一株能够在以DBP为唯一碳源的基础培养基中生长良好的菌,命名为B3.观察菌落形态并通过结晶紫简单染色观察细菌,发现菌落呈黄绿色不透明,中等大小,表面粘稠,边缘平整,规则圆形,表面隆起,细长杆状.
扩增得到B3的16S rDNA序列,并构建系统进化树(图1),B3与寡养单胞菌(Stenotrophomonassp. KX928046.1)聚为一支,相似性为99%,同时结合该菌株的菌落形态特征,判定其为寡养单胞菌(Stenotrophomonassp.).据报道,寡养单胞菌能降解甲基对硫磷[10]、双对氯苯基三氯乙烷(DDT)有机农药[11]和四环素[12]等有机污染物,本研究筛选得到的能降解PAEs的寡养单胞菌为首次发现.

图1 B3的系统发育树分析Fig.1 Phylogenetic analysis of strain B3
2.2 底物特异性
将B3分别接种于如表1所示的8种10 g·L-1底物液体培养基中,培养5 d后检测菌株的生物量(OD600)及底物的残留量,计算降解率.
B3在8种底物培养基中均能生长,其中在短链的PAEs(DBP 、BBP、DMP)以及苯胺中生长较好(OD600>0.8),而在长链PAE(DEHP)中生长较慢,这种差异可能是由于各类PAEs侧链不同所引起的[8-9].B3对8种底物的降解率均在50%及以上,其中对BBP(90.1%)和苯胺(89.0%)的降解率最高,其次是DBP(75.9%)和DMP(73.0%).这表明B3的底物特异性不明显,能够降解多种PAEs及芳香类化合物.与B3类似,许多已报道的DBP降解菌更容易利用短链的PAEs,而对长链PAEs如DEHP的降解效果不佳:如Gordoniasp. strain QH-11[13-14]降解DEP和DBP的效果比长链的DMP、 DIOP、 DEHP的好;Camelimonassp. M11[15]降解DPP、DEP、DBP的效率依次递减.B3降解10 g·L-1的长链DEHP的能力虽不比短链的好,但降解率仍有60%以上.
2.3 降解条件优化
首先探究底物DBP的初始浓度对B3生长和降解率的影响(表2).表中,培养条件:pH为7,30 ℃,175 r·min-1,初始菌浓度OD600为0.05,反应时间为72 h.随着底物浓度增加,B3生长量在增长,当质量浓度大于10 g·L-1,呈缓慢下降趋势,表明B3对DBP具有很强的耐受性.DBP质量浓度为0.05 g·L-1时,降解率为93.4%,DBP浓度提高,降解率缓慢下降,可能是由于底物过剩,或是DBP本身具有毒性,随着其浓度增加对菌的抑制作用增强.当DBP质量浓度小于等于10 g·L-1时,B3降解DBP的效率均大于75%.当DBP质量浓度在20 g·L-1及以上时,降解率仍维持在70%左右.许多报道也研究了不同浓度DBP对菌的降解的影响:He[8]和Jin[13]等分别研究了0.6~1.2 g·L-1和0.1~0.75 g·L-1质量浓度范围的DBP对菌降解的影响.B3降解DBP浓度范围较前人的宽,而且效率高.表2中,生长量以OD600表示(下同).
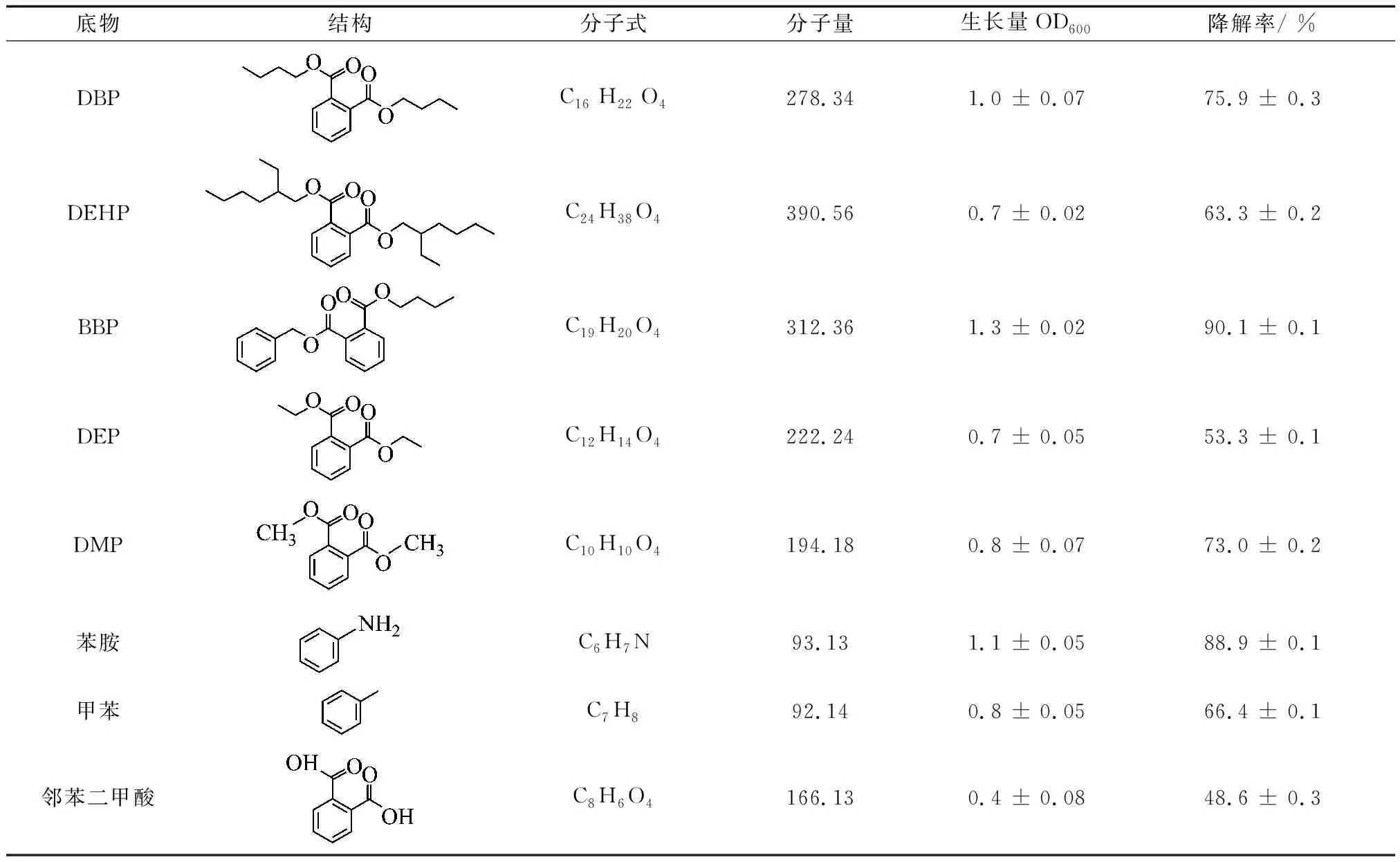
表1 B3的底物特异性Tab.1 Substrate specificity of strainB3
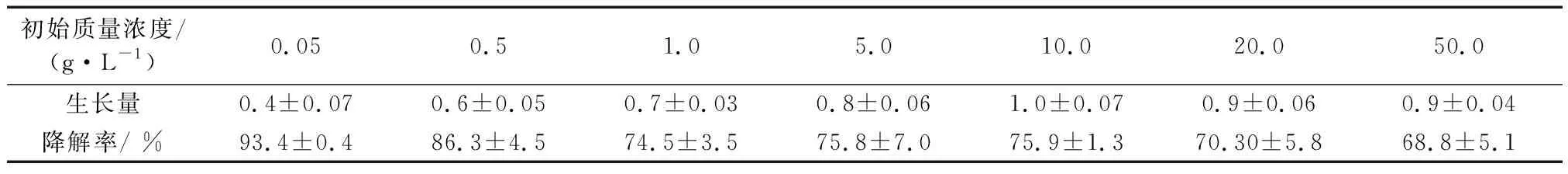
表2 DBP初始浓度对B3菌株降解的影响Tab.2 Effect of initial DBP concentrations on the degradation efficiency by B3
在10 g·L-1DBP初始质量浓度下,探究pH、温度、摇床转速、接菌量和葡萄糖浓度对B3生长和降解DBP的影响(图2、表3).图2显示,B3的生长量和降解率呈现正相关.图2a显示,30 ℃条件下,B3在pH为5~11,B3对10 g·L-1DBP的降解率保持在60%以上,当pH由7上升至8时, B3的降解率由75.9%提高至92.2%,说明弱碱性的环境有利于B3对DBP的降解.Wu等[16]筛选出的Ochrobactrumsp. JDC-41在 pH小于5或pH高于9,DBP降解率骤降至2%~35%.而B3在pH小于6或高于9的条件下,对DBP的降解率都超过60%,表明B3降解DBP受pH影响相对较小.
在pH 8的条件下探究温度对B3降解DBP的影响(图2b).不同温度下菌株的生长量和降解率不同,这可能与菌体内酶的活性有关.20 ℃~45 ℃时,B3降解率均在60%以上,其中在25 ℃~35 ℃降解率大于80%,35 ℃时降解率最高,为94.1%.B3在温度40 ℃及以上时,对10 g·L-1DBP仍具有70%以上的降解率,这与报道的降解DBP的eBrucellaceae、Sinobacteraceae[7]等菌株不同,这些菌降解的最适温度均在30 ℃~35 ℃间,但温度大于40 ℃或低于25 ℃时,降解活力大大降低.
图2c摇床的转速反映了对B3降解DBP过程中的溶解氧的供给量,溶解氧供给量不足或是过量,好氧微生物的生长与代谢均会受影响.转速过低通气量不足,菌株的生长和降解效果不佳;随着转速提升,B3生长和降解速率增加,在转速175 r·min-1时B3菌株的生长量达到最高、降解DBP的效果最佳.转速高于175 r·min-1时,生长量和降解率均有所降低.Wu等[17]发现Gordoniasp.降解DBP的最佳摇床转速为175 r·min-1,而转速大于或小于175 r·min-1时,B3对DBP的降解效果降低,本文与该结果相似.与本文不同的是,Gordoniasp菌在75 r·min-1时,对0.4 g·L-1的DBP降解率只有20%左右,而B3在静置培养时,降解率仍有60%.

a pH

b 温度
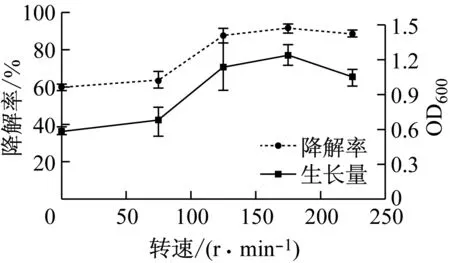
c 转速

d 接菌量

葡萄糖质量浓度/(g·L-1)00.250.50.7511.251.5生长量1.5 ± 0.22.0 ± 0.12.6 ± 0.14.3 ± 0.15.2 ± 0.1 5.5 ± 0.15.9 ± 0.1降解率/%95.8 ± 0.5 62.1 ± 2.465.9 ± 0.994.2 ± 0.295.1 ± 0.195.8 ± 1.795.9 ± 1.8
注:培养条件:pH 8,35 ℃,175 r·min-1,DBP质量浓度为10 g·L-1,接菌量OD6000.05,反应时间为72 h
由图2d可知接菌量OD600小于0.125时,降解率和B3的生长量上升显著,当接菌量OD600大于0.25时,降解率和生长量提高不明显.接菌量OD600为0.05至0.25时,B3菌对10 g·L-1的DBP的降解率超过94.3%.
探究葡萄糖添加量对B3降解的影响(表3),发现葡萄糖添加量≤0. 5 g·L-1时,对B3降解DBP有抑制作用.葡萄糖对于许多微生物而言是良好的碳源,微生物在含葡萄糖的条件下为了优先利用葡萄糖,会抑制其他碳源的代谢[18].Jin 等[19]也探究了葡萄糖添加量对菌株降解DBP的影响,结果显示低浓度的葡萄糖抑制菌株对DBP的降解,这与本文结果相同.上述研究还表明高浓度的葡萄糖对菌降解DBP有促进作用,这与本文不同.因此得到结论,在B3降解DBP过程中没有必要添加葡萄糖.综上,B3降解10 g·L-1DBP的最佳pH为8,温度35 ℃, 培养转速为175 r·min-1,接菌量OD600为0.125,在72 h内降解效率可达95.8%.
2.4 DBP的降解动力学
在最佳培养条件下,设置DBP初始质量浓度为1、5、10、20、50 g·L-1,每隔8 h测定DBP的残留量,以GraphPad Prism5进行数据拟合(图3,表4),探究B3菌对DBP的降解动力学.
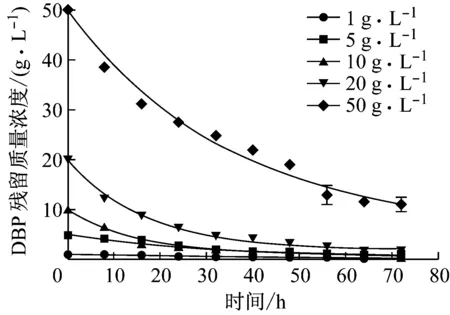
图3 B3降解不同初始质量浓度DBP的降解曲线Fig.3 DBP degradation profiles at different DBP initial concentrations
实验结果表明,B3降解DBP符合一级动力学模型,降解速率与DBP初始浓度密切相关.初始浓度的增加,初始降解速率增大,当初始质量浓度为50 g·L-1时,初始降解速率可达1.25 g·L-1·h-1.DBP质量浓度小于等于10 g·L-1时,随DBP的浓度增大,半衰期缩短,降解速率常数增大;DBP质量浓度为10 g·L-1,降解速率常数达到最大(K=0.064),半衰期最短(t1/2=10.8 h);当DBP质量浓度为50 g·L-1时,半衰期增大,降解速率常数减小.一级动力学常用于有机污染物的降解动力学[20],He等[9]报道的赤红球菌属(Rhodococcusruberstrain),当DBP质量浓度小于等于0.8 g·L-1时,初始浓度的增加,降解速率增大,半衰期缩短;DBP质量浓度高于0.8 g·L-1时,随浓度增大,降解速率降低,半衰期增大,这些结果与本文结果相同.

表4 不同初始浓度DBP的降解动力学方程Tab.4 Degradation kinetics equation of DBP with different initial concentration
近年来,探寻绿色高效经济的降解PAEs的方法已成为研究热点,已有很多报道降解DBP的菌属(表5).许多研究报道的PAEs的降解率虽然可达90%,但降解的浓度通常在mg·L-1级别[21-22].Tang等[22]报道的根瘤菌(Rhizobiumsp.)降解50 mg·L-1的效率大于90%,而当浓度升高时,降解率大大降低,当DBP质量浓度为400 mg·L-1时,降解率仅为50%左右.而在Chen等[15]报道中Camelimonassp.在336h内降解0.03~0.14 g·L-1DBP的效率不高于56%.在有些DBP降解浓度较高的报道中,菌降解时间长、效率不高亦或需要多种菌的共同作用:Kumar等[14]报道的假单胞菌属(Pseudomonassp.)和丛毛单胞菌属(Comamonassp.)在192 h内分别降解2 g·L-1DBP的效率仅为57%、46%.本文筛选到的寡养单胞菌B3不仅在宽的浓度范围内保持着高效降解能力,而且降解的底物范围、温度、pH范围等条件均较宽.

表5 不同的DBP降解菌的降解特性Tab.5 Degradation characteristics of different PAEs by degrading bacteria
3 结论
本文筛选到的PAEs降解菌——寡养单胞菌(Stenotrophomonassp.)B3菌株,其对DBP的作用浓度和条件范围广.在30℃,pH 7条件下,B3在72 h内,对0.05~0.5 g·L-1DBP的降解率在86%以上,降解0.05 g·L-1DBP 的效率为93.4%.在35 ℃、pH 8 条件下,B3对1~50 g·L-1DBP的降解率在72%以上,初始降解速率高,当DBP质量浓度在5 g·L-1及以上时,降解率仍维持在80%左右,降解浓度高且高效降解浓度范围宽.在20 ℃~45 ℃的温度及pH 5~11的范围中,B3菌株对10 g·L-1DBP降解率保持在60%以上.在pH 8,35 ℃,175 r·min-1,接菌量OD600为0.125的条件下,对10 g·L-1DBP的降解在72 h内可达到95.8%.B3降解DBP符合一级动力学模型.B3不仅对DBP具有高效的降解效果,而且对DEHP、BBP、DEP、DMP、苯胺、甲苯和邻苯二甲酸的降解率均在50%及以上,其中对BBP、苯胺的降解效果在88%以上.B3菌宽的降解浓度和底物种类范围预示着该株寡养单胞菌在PAEs的生物修复中具有独特的应用价值.

