气相色谱-串联质谱法测定婴儿奶粉中16种邻苯二甲酸酯类化合物
许兵兵, 李晓敏, 张庆合, 朱维晃
(1. 西安建筑科技大学环境与市政工程学院, 陕西 西安 710055; 2. 中国计量科学研究院化学计量与分析科学研究所, 北京 100029)
邻苯二甲酸酯类化合物(phthalate acid esters, PAEs)是一类有机污染物的总称,常应用在塑料制品中以提高产品韧性[1]。PAEs与基体之间不是以共价键的形式存在[2],所以PAEs很容易迁移入空气[3]、水[4]和土壤[5]等外界环境介质中。研究表明,PAEs是一类内分泌干扰物,产生和雌激素相似的作用,一些PAEs具有致癌特性[6,7]。其中,邻苯二甲酸二(2-乙基)己酯(DEHP)根据其致癌程度被归为2B类[8]。因此,美国环境保护署(US EPA)将PAEs列为优先控制污染物;欧盟食品安全局(EFSA)规定邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁基苄基酯(BBP)和DEHP的每日最大摄入量分别为0.01、0.5和0.05 mg/kg[9-11]。
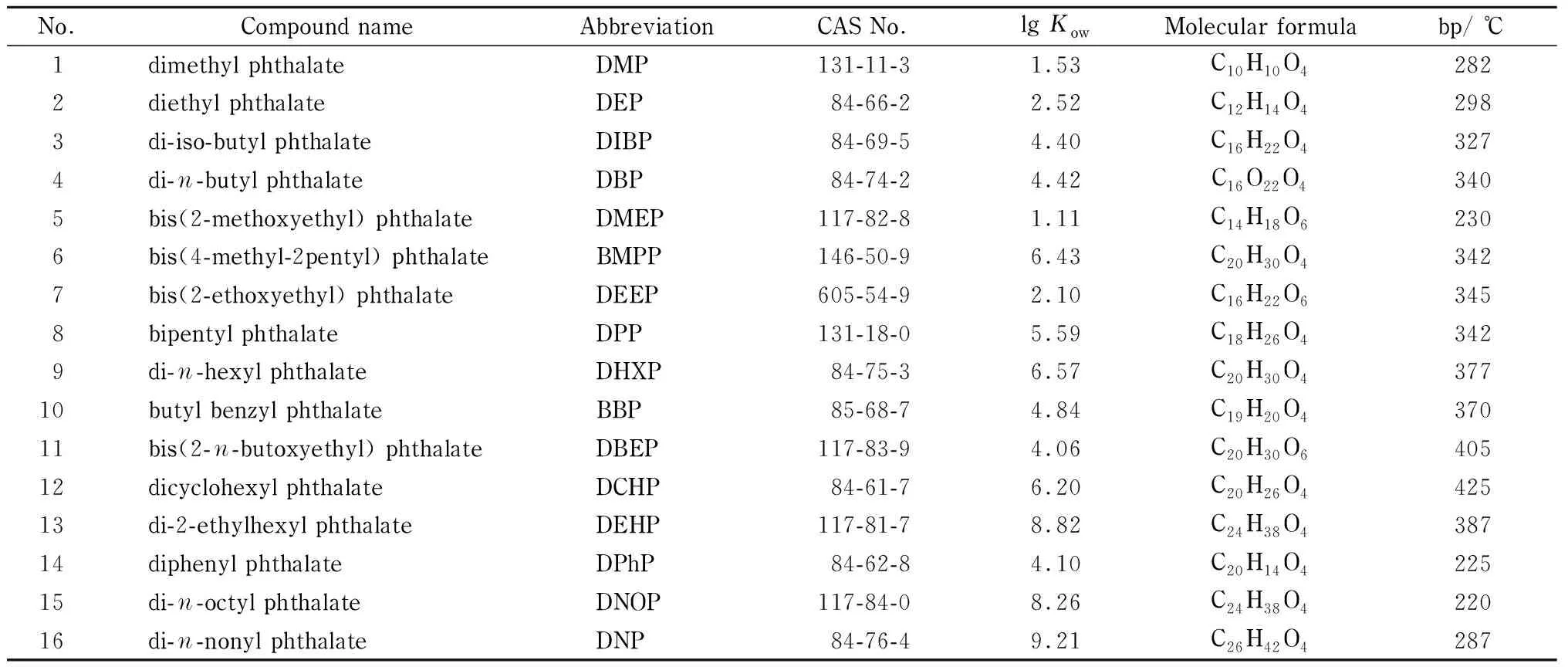
表 1 16种塑化剂的名称和性质Table 1 Compound names and properties of the 16 phthalate acid esters (PAEs)
Kow: octanol/water partition coefficient; bp: boiling point.
欧洲、美国、加拿大和亚洲的婴儿奶粉中均曾检出部分邻苯二甲酸酯类塑化剂成分,其中DEHP和DBP分别为34~281 μg/kg和15~77 μg/kg[12]。Fiernes等[13]在比利时农场中亦发现8种常见PAEs,其中DEHP含量最高,为201.3~499.7 μg/kg。Lin等[14]发现塑料盖包装奶粉塑化剂含量高于金属和玻璃盖包装。婴儿奶粉中的塑化剂引入主要存在于两个环节:其一是水源,土壤以及牧草的塑化剂污染引入到鲜奶原料中[15];其二在奶粉的制作过程,比如采集奶源的聚氯乙烯(PVC)管、储备罐等因为塑化剂的亲油脂特性产生迁移[16]。
婴儿配方奶粉作为婴儿主要能量和营养来源,基体成分复杂,主要含有脂肪、蛋白质和碳水化合物,还具有少量维生素、矿物质和核苷酸等成分[17]。因此,其中塑化剂的检测难度较大。乳品基体中塑化剂的相关检测方法以外标法为主,多采用液液萃取-固相萃取净化结合质谱检测少数成分[18]。Yue等[19]使用反向迁移硅胶富集乳品中的PAEs成分;Farajzade等[20]通过液液微萃取浓缩PAEs,提高检出限;Miclean等[21]将顶空固相微萃取应用于测定盒装奶中6种PAEs,缩减了前处理步骤。但是外标法无法满足更多PAEs组分的检测要求,检测结果的准确度和稳定性较差。近年有文献[22,23]报道以同位素内标法结合液液萃取-固相萃取前处理,采用液相色谱-质谱法或气相色谱-质谱法测定奶粉中17种PAEs成分,与外标法相比,内标法可以克服前处理环节的不足,应用于更多种PAEs的测定,但回收率和精密度仍不理想,主要因为婴儿奶粉基体复杂,影响方法准确性。本研究尝试比较氧化铝/乙二胺-N-丙基硅烷(alumina/PSA)和PSA两种不同玻璃固相萃取柱对16种PAEs(见表1)的净化效果,探求奶粉基体样品前处理中PAEs测定的影响因素,寻求测定婴儿奶粉基体中PAEs的准确可靠的分析方法。
1 实验部分
1.1 仪器与试剂
Agilent 7000B三重四极杆气质联用仪和Agilent DB-5 MS UI气相色谱柱(30 m×0.25 mm×0.25 μm)(美国Agilent公司); N-EVAP 111氮吹仪,配有OASYSS水浴加热装置(美国Organomation公司); ME614S、ME36S天平(德国Sartorius公司); D-7700 Singen Transsonic Digitals超声器(德国Elma公司); CR 21GⅢ高速冷冻离心机(日本日立公司); MX-S涡旋混合器(美国Scilogex公司);玻璃具塞离心管(15 mL),玻璃移液管(10 mL和1 mL), 24管固相萃取装置(美国Supelco公司); 氧化铝/PSA混合玻璃固相萃取柱(3 g/6 mL,天津博纳艾杰尔科技有限公司), PSA玻璃固相萃取柱(1 g/6 mL,北京迪科马科技有限公司)。
氯化钠购自美国Sigma公司;色谱级乙酸乙酯、二氯甲烷和质谱级乙腈购自美国Fisher公司;色谱级正己烷购自德国Merck公司;丙酮购自美国Baker公司;邻苯二甲酸酯二壬酯(DNP)标准品购自美国Chemservice公司,邻苯二甲酸二丁酯溶液标准物质(GBW10134)购于中国计量科学研究院,其余14种标准品购自德国Dr. Ehrenstofer公司,纯度范围98.0% ~99.9% 。16种氘代塑化剂内标(PAEs-D4)的正己烷溶液的质量浓度为100 μg/mL,购自北京迪科马科技有限公司。
1.2 校准溶液的配制
16种PAEs纯品用甲醇配制成100 μg/g标准储备液及50 μg/g工作溶液。
16种氘代内标储备液(100 μg/mL)用乙醇稀释,配制成50 μg/g工作溶液。均于4 ℃保存。
1.3 样品前处理
准确称取奶粉样品0.5 g(精确至0.000 1 g)于15 mL玻璃离心管中,加入3 mL去离子水,涡旋振荡30 s混合均匀,然后加入6 mL乙腈和1.0 g的NaCl后再涡旋振荡2 min。在20 ℃、3 000 r/min条件下离心5 min后取上清液,于40 ℃下用氮气吹干后,加3 mL正己烷复溶,待净化。
PSA玻璃固相萃取柱使用5 mL丙酮和5 mL正己烷活化,将上述待净化液上样,再依次使用5 mL正己烷和5 mL正己烷-丙酮(60∶40, v/v)进行洗脱,流速控制为1 mL/min,收集两次洗脱液于同一离心管中,在40 ℃的水浴中用氮气吹干,加入1 mL二氯甲烷复溶后以GC-MS/MS测定。
1.4 分析条件
1.4.1色谱条件
色谱柱:Agilent DB-5MS UI(30 m×0.25 mm×0.25 μm);升温程序:50 ℃保持1 min,以20 ℃/min升温至230 ℃,保持1 min,再以3 ℃/min升温至240 ℃,保持1 min,然后以5 ℃/min升温至300 ℃并保持10 min;载气:氦气,纯度≥99.999% ;柱流速:1 mL/min,恒流;进样体积:1 μL;进样口温度:300 ℃;进样模式:不分流进样。
1.4.2质谱条件
离子源:电子轰击离子(EI)源;离子源温度:280 ℃;四极杆温度:150 ℃; GC-MS/MS传输线温度:280 ℃;溶剂延迟:5 min;碰撞气(N2)流速:1.5 mL/min,淬灭气(He)流速:2.25 mL/min。采用多反应监测(MRM)模式,每个塑化剂选取2个特征MRM反应,一个定量离子对,一个定性离子对;每种塑化剂内标仅提供定量离子对信息(见表2)。
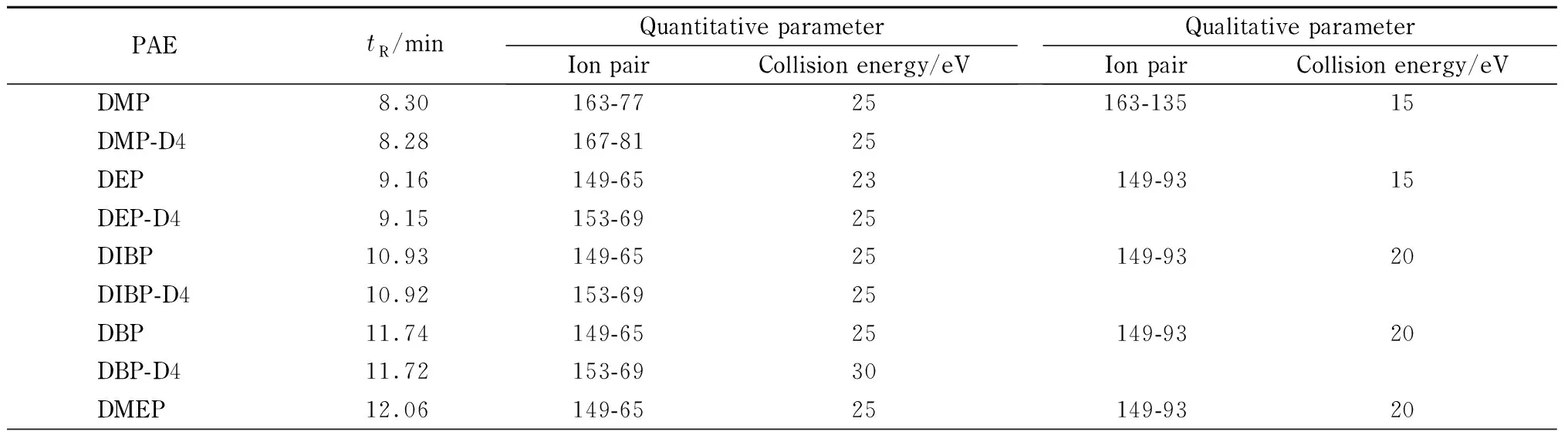
表 2 16种PAEs及PAEs-D4三重四极杆质谱MRM条件参数Table 2 MRM parameters of 16 PAEs and corresponding PAEs-D4
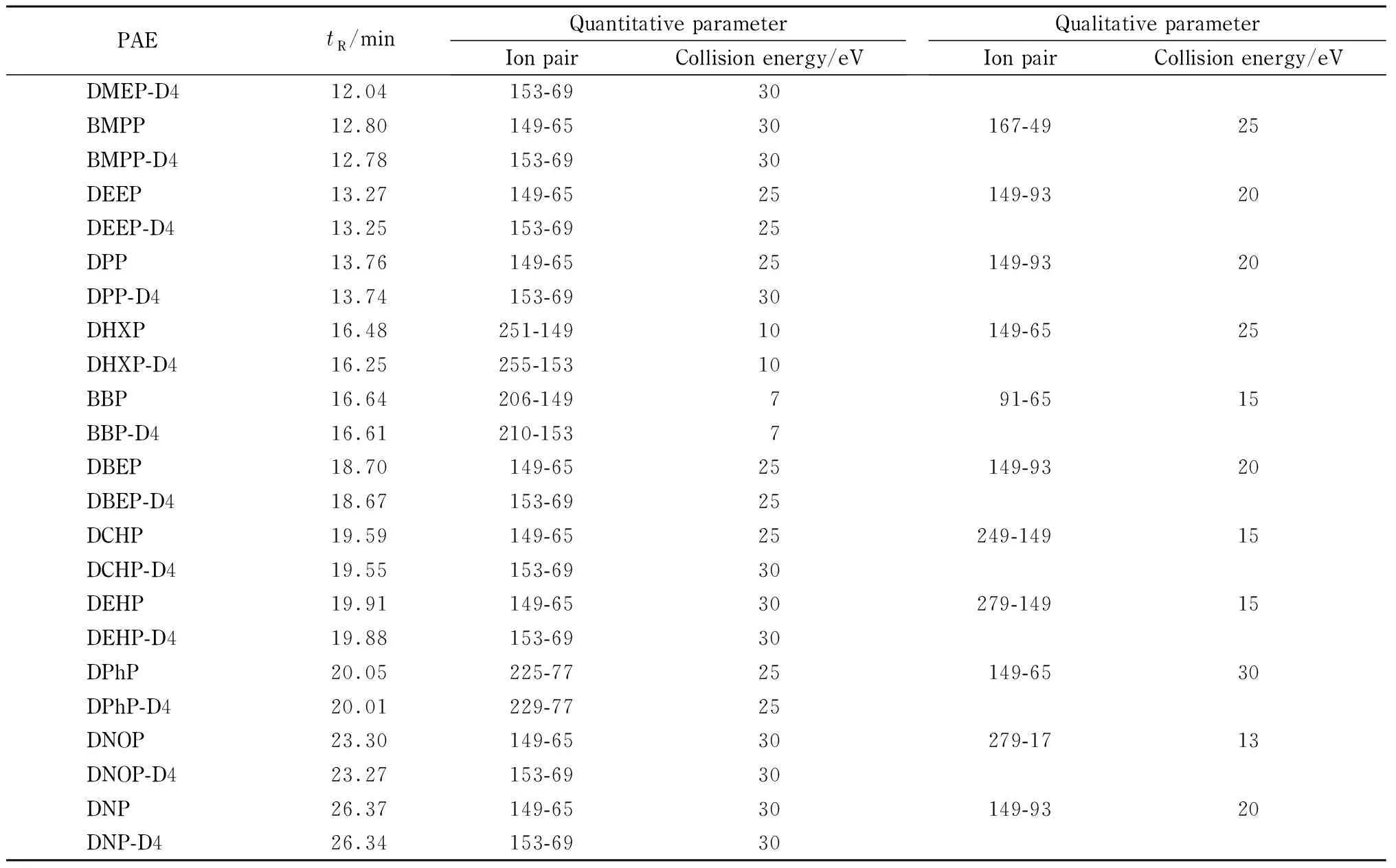
表 2 (续)Table 2 (Continued)
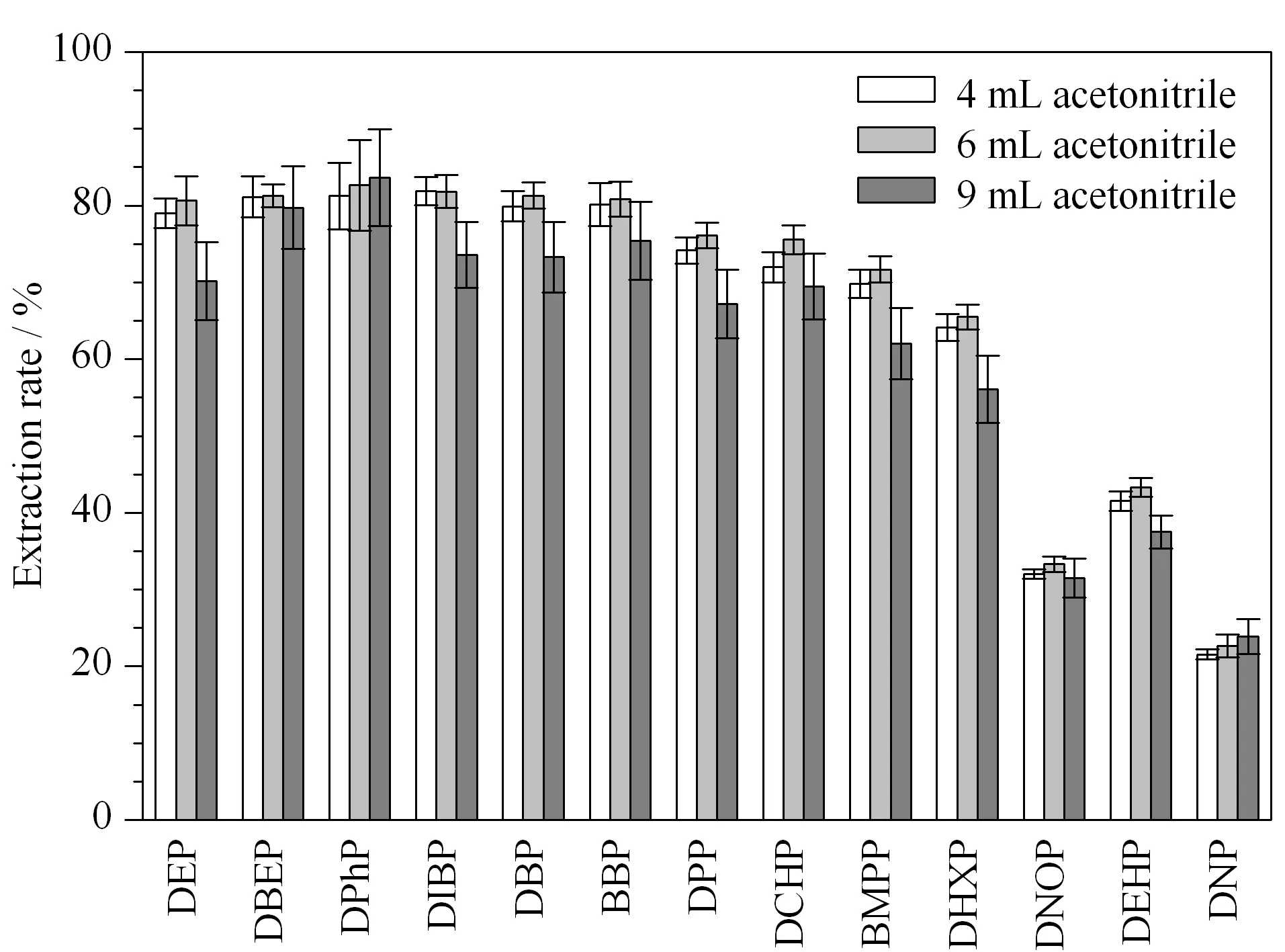
图 1 不同体积乙腈对婴儿奶粉中16种塑化剂提取效率的 影响(n=5)Fig. 1 Effect of extraction volume of acetonitrile on the extraction rates of the 16 PAEs in infant formula (n=5) Extraction conditions: sample mass, 0.5 g; water volume, 3 mL; salt addition, 1.0 g NaCl.
1.5 同位素内标法计算
准确称取一定质量PAEs和PAEs-D4工作溶液加入空白基质溶液中,配制成16种PAEs分别为0.01~2.0 mg/kg的5个系列标准加标溶液。以PAEs的含量为横坐标X(mg/kg),目标物定量离子对峰面积与其对应的氘代内标定量离子对峰面积之比为纵坐标Y,进行线性回归,计算线性方程和相关系数。
2 结果与讨论
2.1 前处理条件的优化
2.1.1提取溶剂用量的选择
食品基体中塑化剂提取常用溶剂有正己烷和乙腈[24],但是正己烷对乳品进行提取会出现乳化现象,而乙腈既可以作为蛋白质沉淀剂亦是提取溶剂,盐析作用下可与水相形成稳定分层,便于提取。因此,选择乙腈作为提取溶剂。对乙腈的提取用量及乙腈提取的效率进行了比较研究(见图1)。
4、6和9 mL乙腈的提取效率随着乙腈体积的增加先增加后降低,6 mL时的提取效率最优。说明小体积的提取溶剂不能充分提取PAEs,但是受离心管容量限制,大体积的乙腈与基体的混合不充分,也会导致提取效率偏低。16种PAEs的提取效率为22.6% ~83.7% , RSD为1.8% ~7.1% 。DEHP、DNOP和DNP的提取效率为22.6% ~43.3% ,其他13种PAEs为65.5% ~82.6% 。由于乙腈极性中等,高lgKow的弱极性PAEs更易于分配到脂肪中,所以提取效率偏低。Li等[25]亦报道了类似的结果,使用乙腈提取原乳中9种PAEs,平均回收率为65.2% ~98.3% ,提取效率随着PAEs极性的减小而降低,说明乳品中脂肪的存在对于乙腈提取低极性PAEs的效率影响很大。若采用弱极性溶剂提高低极性PAEs的提取效率,脂肪共提取情况无法避免。Ren等[23]使用弱极性溶剂正己烷提取3种不同乳品基体,不仅出现乳化现象,而且3种基体中强极性塑化剂DMP和DEP的提取效率仅为17.4% ~51.8% 。为了减小干扰和简化操作,本文使用6 mL乙腈作为提取溶剂。

图 2 氧化铝/PSA固相萃取柱上不同洗脱溶剂对16种塑化剂回收率的影响(n=5)Fig. 2 Effect of different elution solvents on the recoveries of the 16 PAEs on alumina/PSA SPE column (n=5)
2.1.2固相萃取柱的选择和洗脱溶剂的优化
因为塑化剂检测的特殊性,需要避免使用塑料制品固相萃取柱。本试验采用不同洗脱溶剂,考察了两种玻璃固相萃取小柱(氧化铝/PSA柱和PSA柱)对目标物回收率的影响。
考察氧化铝/PSA固相萃取柱,该柱有淋洗过程,通过计算淋洗液穿透率,并未发现大量PAEs淋洗穿透现象(见表3),随后对洗脱溶剂进行了优化。比较了4组不同体积比的正己烷-乙酸乙酯混合液、2组不同体积比的正己烷-丙酮混合液和丙酮作为洗脱液的洗脱效果(见图2), 7种不同洗脱液对DMP和DEP两种强极性PAEs洗脱效果均不理想,DMP和DEP的回收率范围分别为2.8% ~57.6%和35.0% ~87.5% 。造成上述结果的原因可能是氧化铝作为一种强吸附剂,常用来吸附基体中的极性物质[26],强极性PAEs也有较强吸附而难以洗脱,故导致DMP和DEP的回收偏低。夏冰等[27]采用氧化铝类固相萃取对17种塑化剂进行分析,回收率低于20% 。
考察PSA固相萃取柱,该类型固相萃取柱没有淋洗过程,直接对洗脱溶剂进行优化。比较了3组不同体积比的正己烷-丙酮混合液、1组正己烷-乙酸乙酯混合液和乙腈的洗脱效果(见图3)。在正己烷-丙酮(96∶4, v/v)混合液洗脱条件下,16种PAEs的回收率为21.4% ~112.6% ,其中极性较大的DMEP、DEEP和DPhP的回收率分别为23.6% 、42.3%和21.4% 。随着丙酮体积比从4%上升至40% ,强极性塑化剂的回收率明显提升,采用正己烷-丙酮(60∶40, v/v)混合液洗脱时效果最优,16种PAEs的回收率为79.1% ~120.1% ,且绝大多数PAEs回收率近100% 。正己烷-乙酸乙酯(50∶50, v/v)混合液和乙腈洗脱时的回收率分别为16.2% ~118.0%和54.3% ~100.6% 。正己烷-乙酸乙酯(50∶50, v/v)混合液与正己烷-丙酮(60∶40, v/v)混合液相比,极性偏小,所以很难将强极性PAEs洗脱下来,DPhP的回收率只有16.2% 。乙腈的极性偏大,对弱极性PAEs洗脱不完全,绝大多数PAEs的回收率低于80% 。PSA填料小柱可去除极性化合物,如碳水化合物、色素、有机酸类物质,该类型的柱子在塑化剂检测中有较多应用,如植物饮料[27]和食用油[28]基体PAEs的净化,同种类的PSA固相萃取柱的回收率范围是78.9% ~98.7%[27]。
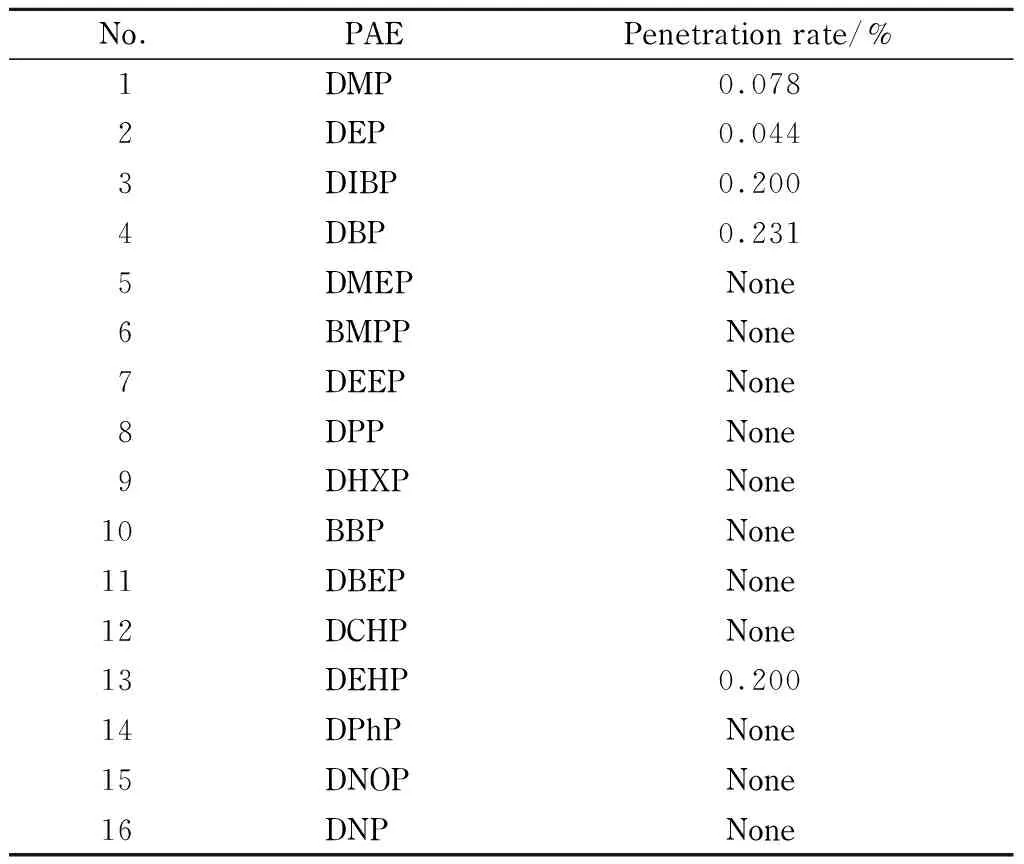
表 3 氧化铝/PSA固相萃取柱对16种塑化剂的淋洗穿透率评估Table 3 Evaluation of the penetration of 16 PAEs onalumina/primary secondary amine (PSA) SPE column
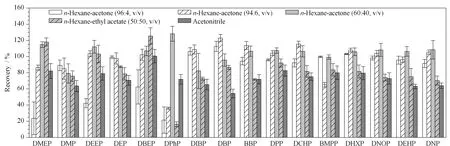
图 3 PSA固相萃取柱上不同洗脱溶剂对16种塑化剂回收率的影响(n=5)Fig. 3 Effect of different elution solvents on the recoveries of the 16 PAEs on PSA SPE column (n=5)
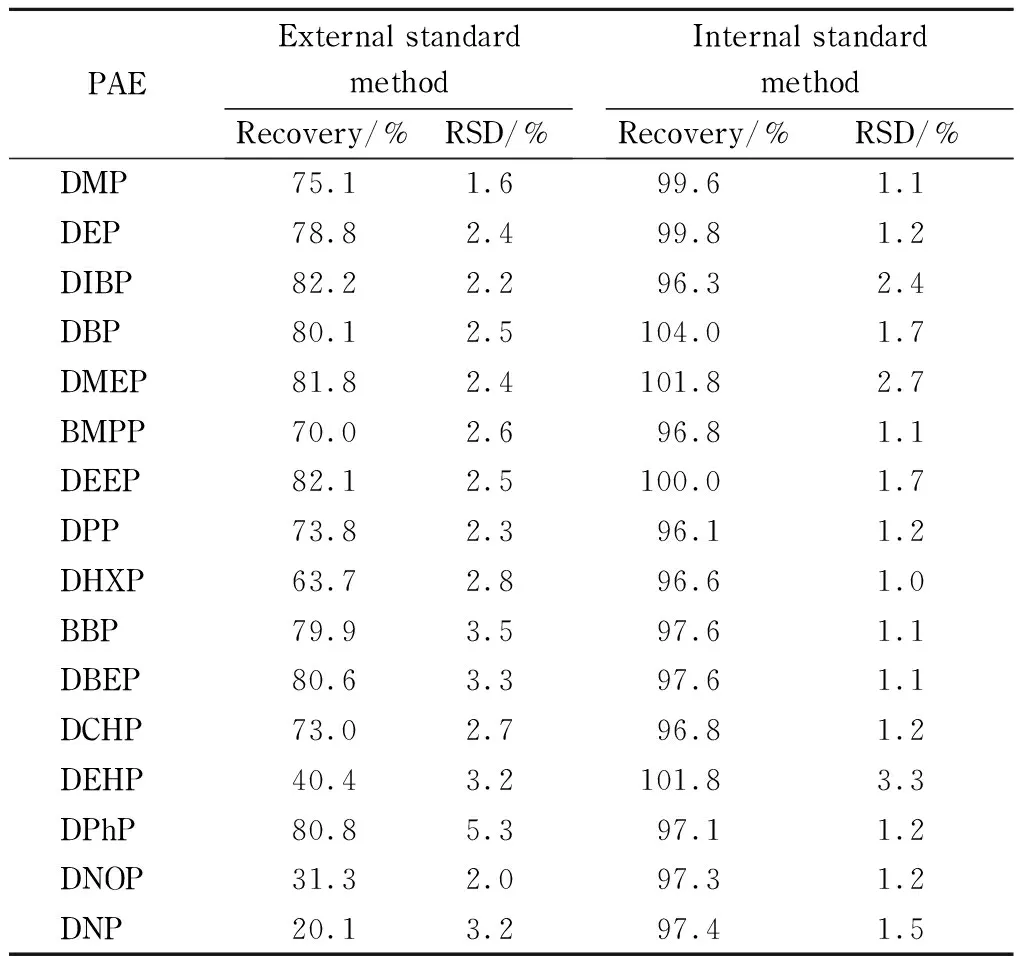
表 4 50 μg/kg水平下外标法和内标法的回收率(n=5)Table 4 Recoveries of external and internal methods at 50 μg/kg spiked level (n=5)
考察了两种不同类型固相萃取柱。氧化铝/PSA混合柱采用7种洗脱液洗脱,除强极性的DMP和DEP回收率偏低,大多数PAEs的回收率超过120% ,说明该类型固相萃取柱基质效应强,不适合奶粉基质的PAEs分析。而PSA固相萃取柱以正己烷-丙酮混合液(60∶40, v/v)作为洗脱溶剂,16种PAEs的回收率较优,作为本实验的最终净化条件。
2.2 内标法和外标法定量结果的对比
在50、250、500和1 000 μg/kg 4个水平进行回收率和重复性试验,每个水平重复5次。4个水平上外标法测定的回收率和RSD分别为20.1% ~85.6%和1.1% ~5.3% ,弱极性PAEs回收效果较差。4个加标水平上同位素内标法测定的回收率和RSD分别为96.1% ~104.0%和0.7% ~3.3% 。
以加标水平为50 μg/kg时的两种定量方法进行对比(见表4)。外标法中DEHP、DNOP和DNP的回收率偏低,为20.1% ~40.4% ,其他13种PAEs的平均加标回收率为63.7% ~82.2% , RSD小于5.3% 。而同位素内标法中16种PAEs的回收率则为96.1% ~104.0% , RSD小于3.3% 。相比于外标法,内标法的方法回收率和精密度明显提高。
本课题组[29]曾比较白酒中16种PAEs的定量方法,外标法回收率80.8% ~128.6% , RSD<12.9% ;内标法回收率94.3% ~105.3% , RSD<6.5% 。内标法回收率和精密度均有提高,与本文内容一致。对于复杂基体而言,外标法会因为前处理过程或基质效应而出现定值不准的情况,而同位素内标与目标物性质相似,可以最大程度消除前处理过程和基质效应引入的误差,提高定量的准确性。
2.3 线性范围、检出限和定量限
本研究采用同位素内标法定量,以空白婴儿奶粉基体匹配液配制5个不同水平的校准溶液。结果如表5所示,0.01~2.0 mg/kg范围内线性良好,相关系数(R2)均大于0.999。以信噪比(S/N)分别为3和10确定检出限和定量限分别是0.15~2.50 μg/kg和0.50~8.33 μg/kg。相比于文献[30]检测奶粉样品的检出限12.91~126.05 μg/kg,提升15~25倍。Ren等[23]同样以同位素内标定量婴儿奶粉中PAEs, 16种PAEs的定量限为15~30 μg/kg,与之相比本方法提高了7倍以上,食品中严格限量的DBP的定量限提升了20倍。
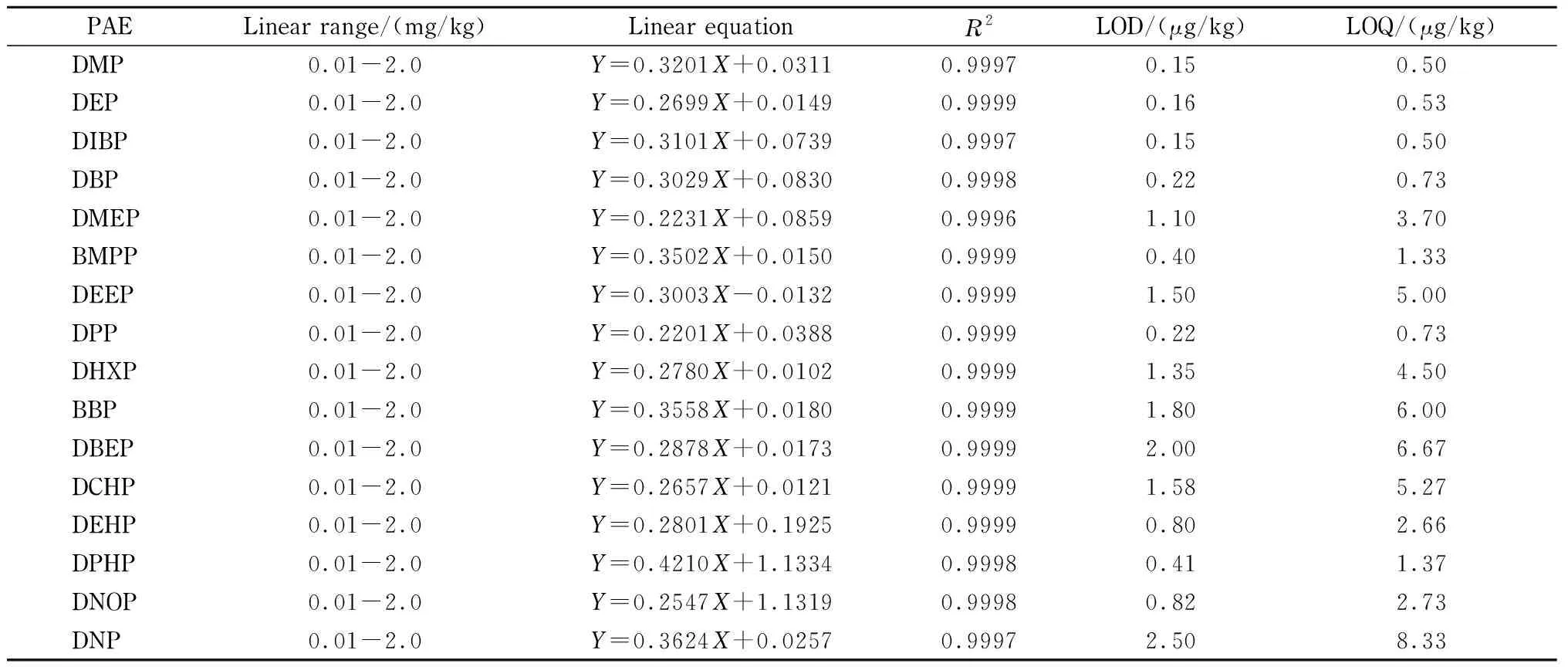
表 5 16种PAEs的线性范围、线性方程、相关系数、检出限和定量限Table 5 Linear ranges, linear equations, correlation coefficients (R2), the limits of detection (LODs) and the limits of quantification (LOQs) of the 16 PAEs
Y: peak area ratio of PAE to PAE-D4;X: content, mg/kg.
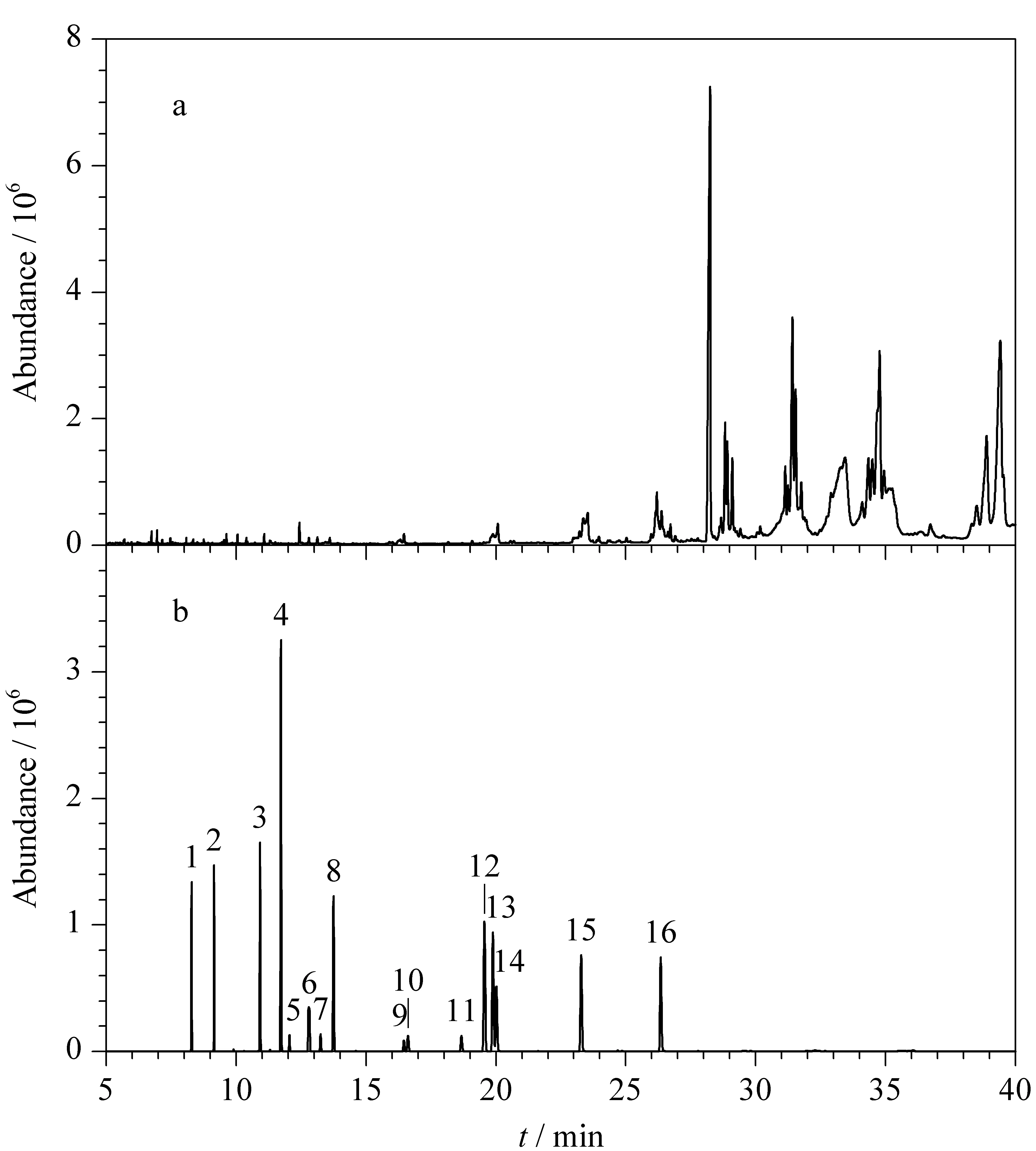
图 4 (a)空白婴儿奶粉样品经PSA柱净化后的全扫模式 色谱图和(b)16种塑化剂空白奶粉基质匹配校准液(200 μg/L)的多反应监测模式色谱图 Fig. 4 Chromatograms of (a) the blank infant formula sample purified by PSA column under scan mode and (b) 16 PAEs of the blank matrix-matched standard (200 mg/L) under MRM mode Peak Nos. are the same as those in Table 1.
2.4 固相萃取柱净化效果分析
婴儿奶粉基体成分复杂,不可避免在液液萃取环节出现干扰物共提取的情况,同时固相萃取柱也很难将不同特性干扰物一同去除。在样品GC-MS/MS检测过程中发现,新衬管进样150次左右会出现峰形拖尾和响应降低的现象,说明样品因成分复杂未被充分净化,存在杂质污染色谱柱柱头。使用全扫描模式对空白奶粉样品进行检测,发现25 min后有大量低极性和高沸点的杂质出峰(见图4a)。说明PSA固相萃取柱可以去除一定极性的脂肪酸和色素,但是对极性较弱的共提取物的去除效果并不理想。虽然这些干扰物出峰时间晚于16种PAEs,通过三重四极杆质谱的多反应监测模式可以很好地去除干扰,对目标物的检测并没有太大影响(见图4b)。但是大量未被净化的高沸点和弱极性杂质进入进样口和色谱柱,除了会对进样口和色谱柱头造成污染,长期积累也会危害质谱系统,这就需要定期更换进样口衬管,清洗离子源。若想从根本上解决干扰物污染的问题,需要能够特异性吸附目标物且有效去除干扰物的固相萃取柱,这就对固相萃取柱填料的要求较高。分子印迹技术可作为一种选择,该技术可以很好地吸附目标物达到基体净化的目的[31,32],但是因为技术的限制,一般对于单一物质的吸附有良好效果,尚未有文献将分子印迹技术应用于多组分的PAEs。另一种则是石墨化炭黑(GCB),该类型的填料在农药残留测定中应用较多,根据文献[33],该类型的固相萃取柱可以吸收具有平面苯环结构的分析物,因此应该可以应用在婴儿奶粉复杂基体中特异性吸附含苯环结构的PAEs而达到净化目的。但是商品化的GCB填料固相萃取柱没有玻璃柱类型,自行装填难度较大,本文暂未验证其净化效果。
3 总结
本文建立了一种液液萃取-固相萃取净化测定婴儿奶粉中16种邻苯二甲酸酯类塑化剂残留的方法。采用乙腈作为提取溶剂,其中低极性塑化剂提取效率偏低,但是同位素内标法可以弥补低极性塑化剂提取效率偏低的不足。与外标法相比,精密度和稳定性更好,可以达到更准确的定量要求。以PSA填料固相萃取柱净化,可以较好地去除其中有极性的脂肪酸、有机酸、糖类和色素,但是对于一起被提取出来的低极性、高沸点杂质的去除效果并不理想。虽然三重四极杆质谱的MRM模式可以很好地去除干扰,但进样口、色谱柱和质谱还是会受到污染,影响塑化剂的响应。这也反映了婴儿奶粉基体复杂,需要更加理想的固相萃取柱将其中所有的干扰物去除。
- 色谱的其它文章
- 固相萃取-高效液相色谱-串联质谱法同时测定牛奶和羊奶中莫奈太尔及其代谢产物残留
- 3种前处理方法处理婴幼儿配方奶粉中二十二碳六烯酸、花生四烯酸、亚油酸和α-亚麻酸的差异性
- QuEChERS-超高效液相色谱-串联质谱法测定不同植被类型土壤中11种甲氧基丙烯酸酯类杀菌剂
- 离子液体分散液液微萃取-超高效液相色谱-串联质谱法测定食品接触材料中全氟辛酸和全氟辛烷磺酸的迁移量
- 超高效液相色谱-串联质谱法快速测定鸡蛋中氟虫腈及其代谢物残留
- Determination of 11 synthetic musks in imported seafood by solid phase extraction and gas chromatography-mass spectrometry

