重度干旱对3种桑树生物量及其生理生化影响的机理探索
郑俊明,吕志强,孙志鸿*
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江省农科院 蚕桑研究所,浙江 杭州 310021)
人类对自然资源的过度利用,导致全球气象格局改变,极端干旱发生的频率和强度有着逐年增加的趋势[1],这也意味着陆地植物面临极端干旱的风险更高了,由于自身的固定性,植物只能通过改变自身的生理生长状态来适应恶劣环境。大量研究表明,植物已逐步形成了许多抗旱适应机制,依靠光化学和生化代谢调控系统来应对不良的环境胁迫。根据干旱胁迫下植物适应特征的不同和干旱程度上的差异,气孔限制和非气孔限制(光合机构活性降低)是致使水分胁迫下光合作用下降的主要原因[2],并且一些研究认为轻度干旱胁迫下,光合速率下降主要由气孔因素引起,而重度干旱胁迫下,非气孔因素是引起光合速率下降的主要原因[3-4]。但也有人提出气孔和非气孔因素共同限制了净光合速率的下降,而利用胞间二氧化碳浓度(intercellular CO2concentration,Ci)和气孔限制值(stomatal limitation value,Ls)来判断光合限制的气孔和非气孔因素还未被一致认可。当前的研究多关注于植物对短期干旱的应急生理生化响应,对干旱适应机制的讨论还比较少,对重度干旱和极端干旱方面的研究也大多局限于旱生的荒漠植物,如梭梭树,沙棘,柽柳等。而在全球气温日益升高,干旱和半干旱区域有着扩张趋势的背景下,原本水分充裕地区的植物也会遭受极端干旱,所以对非旱生物种在重度干旱下能够稳定存活,其形态和用水策略如何调整,光合产物如何分配,生理响应和生化系统怎样调控等方面的研究具有一定价值。
桑(MorusalbaL.)自古以来就是我国重要的经济树种,其生命力与环境适应能力很强,从高海拔的青藏高原到四川盆地,从新疆和田沙漠到滨海地区,从北部黑龙江省到海南岛均有分布[5]。目前关于桑树在干旱胁迫下的研究多集中在其保护酶含量变化,渗透物质积累等生理生化特性的改变,对桑树在重度干旱环境下生理生态适应机制的研究还比较少。本试验所选用的农桑14号、农桑12号和强桑1号均由浙江省农科院蚕桑所杂交选育而成,3个品种均具有生长势旺、农艺性状优良等特点[6-7],在浙江省多地有推广种植。本试验通过人工控制土壤水分含量模拟重度干旱,使处理组土壤水分保持在20%~30%田间持水量水平30 d,测定光合速率、保护酶含量和生物量积累等参数以研究3种桑树在重度干旱下的形态、生理特征和酶系统响应与适应,为桑树经营种植管理提供技术支持,为抗旱品种选育提供参考。
1 材料与方法
1.1 试验材料
试验于2016春季在浙江农林大学平山智能温室大棚中进行,该地区属于中亚热带季风气候区,年降雨量1 628.6 mm,年均气温16.4℃,年日照时数1 847.3 h。以农桑14号(父母本为:实生桑一号♂×北区一号♀),农桑12号(桐乡青♂×北区一号♀)和强桑1号(桐乡青♂×大种桑♀)为试验材料,1年生的健康枝条采于浙江省农科院蚕桑所。枝条于2月下旬扦插于浙江农林大学平山智能温室大棚基质中,约3个月后,幼苗生长良好,用临安当地表层黄壤土、发酵牛粪和珍珠岩均匀搅拌成混合土(黄壤土∶发酵牛粪∶珍珠岩=32∶16∶5),选出健康长势一致的3种桑树幼苗各50株,农桑14号,农桑12号和强桑1号的平均高度分别为(87.92±2.80)cm、(76.27±2.48)cm和(46.39±1.94)cm。用混合土将它们移入花盆中(花盆内径22 cm,高24 cm),每盆约含干土4.4 kg,土壤最大田间持水量(100% Field Capacity,100% FC)占干土质量的46.11%,土壤pH为7.2。盆栽缓苗2周后开始水分处理。
1.2 试验方法
试验采取双因素完全随机设计:3品种(农桑14号、农桑12号和强桑1号)×2干旱水平(100% FC、30% FC),共6个处理。100% FC为对照组,土壤水分始终保持100% FC;30% FC为处理组。对照组和处理组,除了控水外,其他生长条件一致。试验开始前用室内测定法(环刀法)测定盆栽土壤的最大田间持水量,以便之后对盆栽苗的含水量控制。采用称重补水的方法控制处理组的土壤含水量(桑树苗的质量忽略不计),于每天17:00对盆栽苗进行称重控水。处理组从第1天土壤100% FC开始控制浇水,自然蒸发和植物叶片蒸腾使处理组的土壤含水量逐步下降,用称重法控制处理组的土壤含水量保持一致,待土壤含水量达到30% FC后,并保持30 d,然后进行气体交换和生理指标株高以及生物量的测定,每个处理包括3个重复。
1.3 测定指标与方法
1.3.1 气体交换测量 采用GFS-3000便携式光合-荧光测量系统(德国,WALZ)。30% FC处理30 d的盆栽苗于8:00-12:00在实验室内进行测量。从每个处理的生物学重复中选取3株,并选取各植株上部第3、第4完全展开成熟叶叶中部测量。为了使所有测量的叶片处于正常的状态下进行光合作用,以代表其光合能力,将仪器的叶面温度统一设定为28℃,光照强度设定为800 μmol·m-2·s-1,相对湿度控制在60%,CO2浓度控制为(400±5)μmol·mol-1,选取净光合速率(Net photosynthesis rate,Pn)、气孔导度(Stomatal conductance,Gs)、蒸腾速率(Transpiration rate,Tr)、Ci以反映叶片的气体交换情况,通过计算水分利用效率(water use efficiency,WUE)和Ls以研究水分利用及气孔限制情况,其中,WUE=Pn/Tr[8],Ls=(Ca-Ci)×100%/Ca[9],Ca为空气中CO2浓度。
1.3.2 保护酶和丙二醛含量测定 以植物上部第3~第5片成熟展开叶为测定对象,进行酶与丙二醛的测量。测定超氧化物歧化酶(superoxide dismutase,SOD),过氧化物酶(peroxidase,POD)活性来研究桑叶细胞的自由基清除与抗氧化能力,测定丙二醛(malondialdehyde,MDA)含量以反映膜脂过氧化程度。用试剂盒羟胺法(南京建成)测定SOD活性,用愈创木酚法测定POD活性[10],用硫代巴比妥酸法测定MDA含量[11]。
1.3.3 生物量测定 试验处理开始前对每盆盆栽苗的株高进行测量,处理30 d后再次测量株高,幼苗相对高度生长速率(relative height growth rate,RHG)为处理前后的高度差值除以处理天数(30 d)。待生理生化指标测定完成后,将盆栽苗倒出,去除扦插时的营养体并保留根系部分,将一株盆栽苗分为根、茎、叶放70℃烘箱烘至48 h,称重获得的根干重(root dry mass,RDM)、茎干重(steam dry mass,SDM)、叶干重(leaf dry mass,LDM)及总干物质量(total dry mass,TDM)能反映桑树的生长状况,计算出根冠比(ratio of root dry mass to overground shoot dry mass,RR/S)的数据能得出生物量分配的情况,RR/S=RDM/(LDM+SDM)。
1.4 数据处理
采用 Excel 2013记录并计算试验数据,用SPSS 22对数据进行单因素方差分析(one-way,ANOVA),多重比较使用最小显著差数法(least-significant difference,LSD)。用双因素方差分析(two-way,ANOVA)对品种和干旱的交互作用进行检验。显著性设置P<0.05,利用 SigmaPlot 12.5软件作图。
2 结果与分析
2.1 干旱胁迫对桑树幼苗生长和生物量的影响
桑树幼苗的RHG在干旱胁迫下均显著下降(P<0.001),3个品种之间的RHG无显著差异(P=0.175),干旱处理和品种间的交互作用对RHG无显著差异(P=0.357)(图1)。表1中,与对照相比,农桑14号和农桑12号在干旱胁迫下的TDM,RDM,SDM和LDM均有显著减少(P<0.01),而强桑1号处理组与对照组之间各部分的干物质量均无显著差异。农桑14号的RDM、SDM、LDM和TDM分别减少了47.7%、46.9%、27.2%和41.5%,其中RDM降低尤其明显;农桑12号的RDM、SDM、LDM和TDM分别减少23.7%、40.0%、27.82%和32.76%。图1显示,农桑12号和强桑1号的RR/S都有升高趋势,然而农桑14号的RR/S有下降趋势,但是所有的趋势都不显著(P=0.574)。此外,干旱处理和品种间的交互作用对LDM、SDM和TDM的减少影响显著(P<0.01),对RDM和RR/S不显著(P>0.05)。
2.2 干旱胁迫对桑树幼苗气体交换特征的影响
桑树幼苗的Pn、Gs、Tr和Ci在干旱胁迫下均显著下降(P<0.001),Ls和WUE均显著上升(P<0.001)(图2)。表2中,农桑12号受干旱胁迫的影响最大,Pn、Gs、Tr和Ci分别下降了50.5%、78.85%、73.9%和22.89%;强桑1号的Pn、Gs、Tr和Ci分别下降了44.0%、75.91%、71.88%和22.32%;农桑14号下降的幅度相对较小,分别为34.0%、58.74%、57.0%和14.04%。双因素方差分析显示,不同品种之间的Pn、Gs和Tr存在显著差异(P<0.01),而Ci、Ls和WUE在品种间不显著(P>0.05)。对照组中农桑14号和农桑12号具有较高的Pn、Gs和Tr,强桑1号相对较低;而在处理组中,除了农桑14号和农桑12号的Pn要高于强桑1号,Gs、Tr和Ci在品种间均无显著差异。此外,干旱处理和品种间的交互作用显著降低了Pn和Gs(P=0.022,P=0.025),对Tr、Ci、Ls和WUE均不显著(P>0.05)。
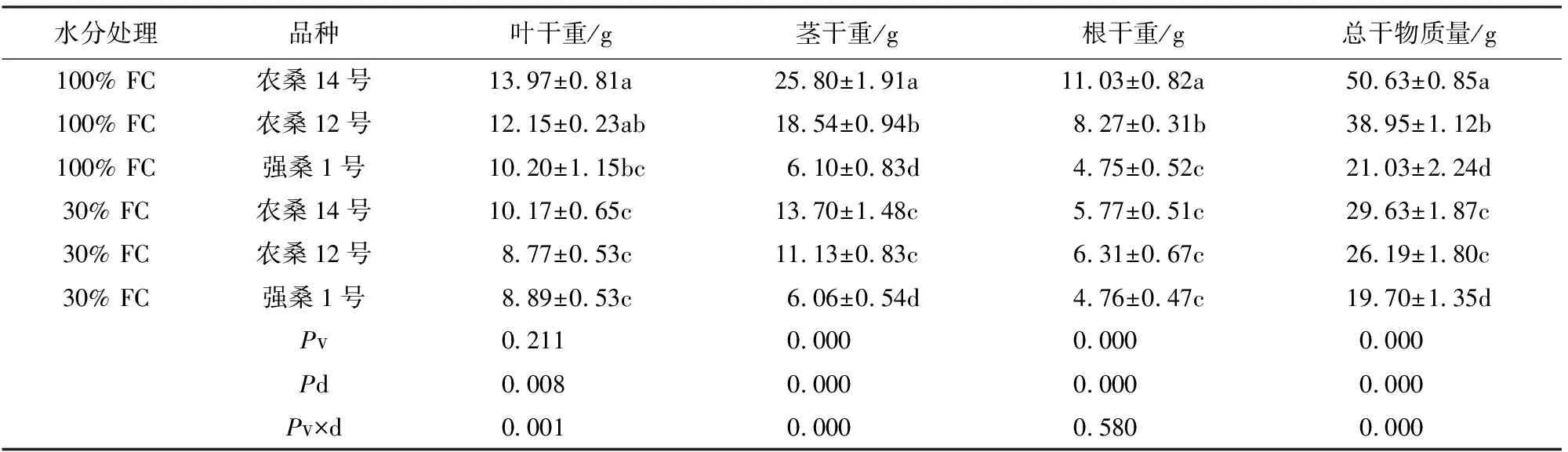
表1 干旱胁迫下桑树盆栽苗生物量的积累与分配(平均值±标准误差)Table 1 The biomass accumulation and allocation of potted Morus L.seedlings under the drought stress (mean±SE)
注:FC,田间持水量,Pv,品种效应;Pd,干旱效应;Pv×d,品种和干旱的交互效应。在每个柱上含有相同的字母代表同一性状的不同处理在P<0.05水平上差异不显著。表2同。
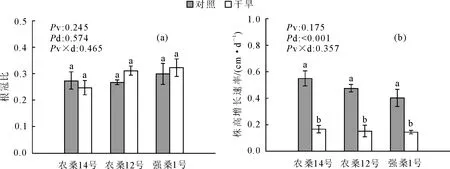
注:Pv,品种效应;Pd,干旱效应;Pv×d,品种和干旱的交互效应。在每个柱上含有相同的字母代表同一性状的不同处理在P<0.05水平上差异不显著。图2,图3同。
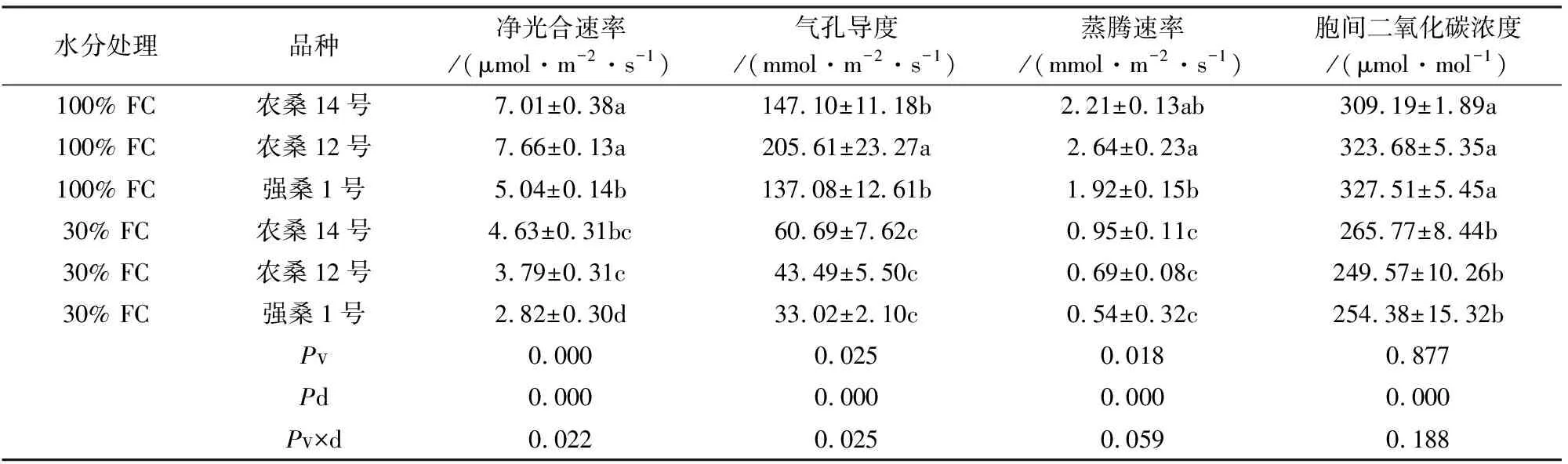
表2 干旱胁迫下桑树盆栽苗气体交换生理指标(平均值±标准误差)Table 2 The gas exchange of potted Morus L.seedlings under the drought stress (mean±SE)
2.3 干旱胁迫对桑树幼苗SOD活性、POD活性和MDA含量的影响
干旱处理显著影响了SOD活性(Pdry=0.022)和MDA的含量(Pdry=0.028),而对POD活性的影响还不显著(Pdry=0.072)(图3)。POD活性和MDA含量的差异与品种有关(Pvariety=0.013,Pvariety<0.001),而SOD活性在品种之间没有显著差异(Pvariety=0.113)。在干旱处理下农桑14号的酶系统产生了响应,表现为SOD活性显著下降,POD活性显著上升,而强桑1号的细胞膜透性增加,表现为MDA含量的显著上升。另外,品种和处理之间的交互作用对叶片中显著降低了SOD活性,提高了MDA含量(P<0.001和P=0.046),而对POD活性无显著影响(P=0.515)。
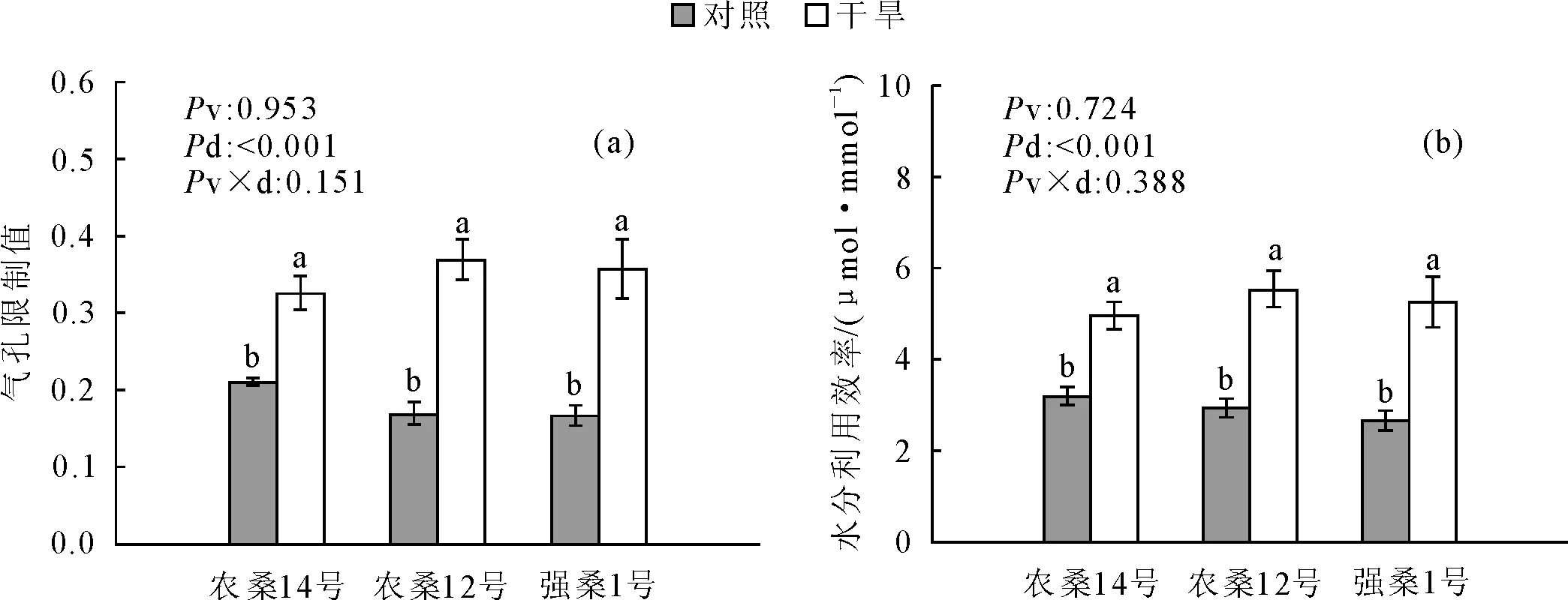
图2 干旱胁迫下桑树盆栽苗气孔限制值(a)和水分利用效率(b)的变化(平均值±标准误差)Fig.2 The LS (a) and WUE (b) of potted Morus L.seedlings under the drought stress (mean±SE)
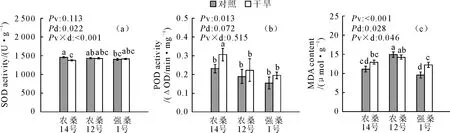
图3 干旱胁迫下盆栽桑树苗超氧化物歧化酶活性(a)、过氧化物酶活性(b)和丙二醛含量(c)的变化(平均值±标准误差)Fig.3 The SOD activity (a),POD activity (b) and MDA content (c) of potted Morus L.seedlings under the drought stress (mean±SE)
3 结论与讨论
干旱所引起的水分胁迫被认为是影响植物生长和生产量的重要因素。在本研究中,对照组的农桑14号和农桑12号有着更高的RDM、SDM、LDM和TDM;干旱胁迫下,农桑14号和农桑12号的RDM、SDM、LDM和TDM有显著的下降,其中水分胁迫限制了根的生长和株高的增长从而降低了RDM和SDM。研究发现LDM的降低主要是由于水分胁迫促使农桑14号和农桑12号的叶基部一些功能较差,叶绿素含量和光合效率较低的叶片脱落,这种在非生长季的落叶正是为了减少蒸腾面积以降低水分的散失。研究发现,柠条在极端干旱下其通过叶片脱落来保持枝条中叶绿体的完整性[12],梭梭树在极端干旱下甚至可以将同化枝脱落以保证存活的同化器官具有光合能力[13]。多项研究表明,这种牺牲部分同化器官以减少水分散失的形态调节是一种重要的干旱响应策略[14]。农桑14号和农桑12号在水分充足的条件下Pn、Gs、Tr和生物量积累均更高,这意味着它们能利用充足的水资源,加速消耗可利用的水分以加快自身的生长,光合作用所固定的同化产物多数用于地上植物组织的构建,这种策略适用于短期干旱的竞争环境[15],但在长期干旱地区,这种用水策略将使植物承受更大的风险。值得注意的是强桑1号的Pn在干旱胁迫下显著下降,但RDM、SDM、LDM和TDM却无显著变化。一方面意味着干旱组中强桑1号的土壤水分有大量盈余,水分不是限制其生长的因素;另一方面能说明在水分条件良好的情况下,强桑1号未将大量光合产物用于植物组织的形成,而是可能将一部分光合产物合成淀粉、果糖、葡萄糖、蔗糖等非结构性碳物质储存起来,干旱来临时,强桑1号将有限的光合产物优先满足于植物组织的构建,非结构性碳物质所占的比例将减少。强桑1号的这种用水方式和光合产物的分配方式由自身的生存策略决定,这与荒漠地区植物水分利用方式相似,即使在短期内水分充足的情况下,植物也不会大量的形成组织,因为地上部分构建更多的植物组织则要求地下部分的根系吸收到更多更稳定的水资源[16]。王翔[17]对青海杨2个不同种群的研究发现,来自湿润地区的杨树种群能快速生长,采用耗水策略从而抗旱性低,而来自干旱地区的杨树生长缓慢,采用节水策略从而抗旱性高,本文中的强桑1号也有与干旱地区杨树相似的节水策略。另外根生物量的结果显示,对照组中强桑1号的根生物量占总生物量的22.6%,而农桑14号和农桑12号分别为21.8%和21.2%,干旱组中强桑1号的根生物量占总生物量的24.2%,农桑14号和农桑12号分别为19.5%和24.1%,从中可以看出强桑1号具有相对更发达的根系,能利用更多土壤中的水。由以上植株生长状况来看,3个品种中强桑1号更适合在干旱地区生长。
干旱条件下,植物体内正常的水分平衡状态会被打破,气孔随之关闭,光合速率下降。随着干旱程度加深,植物细胞内会产生大量活性氧,造成细胞膜过氧化,膜的功能和结构遭到破坏,与此同时叶绿体结构也被破坏,细胞内各细胞器和酶系统无法正常工作,情况严重时还会使植物细胞死亡,最终导致植物的死亡[18-19]。SOD是植物在干旱胁迫下最先响应的保护酶,在干旱处理30 d后,农桑14号的SOD活性明显降低,而农桑12号和强桑1号SOD活性无显著变化,研究表明,在重度干旱胁迫或者干旱胁迫后期,植物体内的SOD活性会降低[20-22],SOD中含有金属辅基,活性氧对其有氧化作用。所以3个品种的桑树在干旱胁迫下SOD活性均无显著上升,推断干旱胁迫所造成的活性氧伤害已经突破SOD这“第一道防线”。农桑14号在干旱胁迫下POD活性显著上升,结合SOD活性的结果分析,认为SOD催化氧自由基产生H2O2和O2,POD则有分解H2O2的作用[23-24],所以农桑14号在干旱胁迫期间SOD清除大量氧自由基的同时产生大量H2O2,当胁迫时间增长,植物体内正常的代谢开始失控,SOD活性开始下降,此时大量的H2O2仍然诱导POD活性的升高,而农桑12号和强桑1号的SOD活性还未显著下降,其体内的H2O2也处于不断堆积的阶段,POD活性上升但不显著。刘芳[25]对迷迭香的研究发现,随着干旱胁迫时间的延长,迷迭香体内代谢趋于混乱,SOD活性开始下降,而清除H2O2的CAT和POD活性继续升高,本研究的结果与此相符。MDA是膜脂过氧化的主要产物,其含量可表示细胞膜受损程度,本试验中强桑1号在干旱胁迫下MDA含量显著上升,而农桑14号和农桑12号MDA含量无显著变化,结合它们的生长状况分析,一方面干旱时间延长使得桑树体内SOD活性开始下降,但另一方面农桑14号和农桑12号通过在极端干旱下脱落基部叶片,减缓了植物体水分吸收和散失之间的不平衡,这种形态调整使剩余叶片的膜系统受损会减轻。而强桑1号在干旱胁迫下各部分生物量均无显著减少,在极端干旱下其体内水分的亏缺程度必然远超农桑14号和农桑12号,所以其MDA含量显著上升。根据保护酶活性和MDA含量的结果,认为强桑1号叶肉细胞膜受损程度较高,农桑14号其次,农桑12号受损相对较轻。
水分是限制干旱地区植物生长的主要因素,然而植物从来没有因水作为光合原料的不足而限制生长,陆地植物仅有1%~5%的水分用于代谢,而绝大部分的水以蒸腾的方式散失到体外[26],其中气孔是控制着水蒸气、CO2等气体交换的主要通道。干旱条件下,Gs、Tr均降低,一方面气孔的阻力增加使植物体保留了更多的水分,另一方面Gs的降低导致细胞内CO2的减少,Ci下降,O2成为电子传递链受体而形成氧自由基[27],进一步影响了植物的光系统和酶系统,气孔对CO2的限制和活性氧导致的叶肉细胞光合活性降低均能显著影响Pn。G.D.Farquhar和T.D.Sharkey[28]认为,植物叶片在气体交换的过程中,Pn下降时,Ci降低并且Ls逐渐升高,那么可认为气孔因素是主要原因。而Pn下降的同时Ci升高或者不变,同时Ls降低,则非气孔因素是主要原因。本研究中3个品种的桑树在干旱胁迫下的Pn、Gs、Tr均有显著下降,并且下降的幅度为农桑12号>强桑1号>农桑14号,3种桑树在干旱胁迫下Ci显著下降,Ls显著上升,根据Pn下降的判断依据,3种桑树光合速率下降的主要原因是气孔造成的。但对酶系统和MDA含量的分析显示,农桑14号SOD活性显著下降,POD活性上升,强桑1号膜系统受损,MDA含量显著上升,这表明农桑14号和强桑1号的叶肉细胞光合活性已受到损伤,非气孔因素是存在的,但究竟是哪种因素对光合的限制更大还无法判断。许大全[29]在对光合作用气孔限制的分析中指出,引起Pn下降的因素分为两类,气孔部分关闭使Ci降低,叶肉细胞光合活性下降使Ci增高,Ci的变化方向依赖于占优势的那个因素。而本研究认为Ls和Ci可作为判断气孔或非气孔因素的方式,但是作为唯一的判断依据则过于片面。原因如下:气孔因素和非气孔因素对Pn限制并非单独影响,2种因素对Pn影响的方式和水平也互不相同,即气孔的限制是优先对进入细胞中CO2含量的限制,是一种由气孔关闭造成CO2进入叶肉细胞阻力增加的物理性限制,气孔的状态易受外界环境因子的影响[30],植物的午休现象和叶片气孔的不均匀关闭也会造成气孔因素的假象[31]。而非气孔因素则是光合作用对已进入细胞的CO2固定消耗,由叶肉细胞光合活性所控制的生物化学性限制,对于Pn下降则是2种因素所叠加产生的结果,Ci的变化方向可作为分析气孔和非气孔因素的依据,但也仅仅是对叶肉细胞中CO2动态变化的分析,这2种因素对光合限制的“贡献值”还无法进行独立比较,所以单凭Ci来判断哪一个因素是主要原因还不妥当。总体来说,Ci有降低的趋势,则能说明的是气孔因素是限制光合的主要因素之一,而非气孔因素是否显著影响Pn,一方面Ci上升是判断依据之一,另一方面需要结合叶绿素荧光动力和酶系统对叶肉细胞光合能力和受损程度进行评估,这样才能得出更好的结论。所以对3种桑树Pn限制因素的结论为,气孔因素均显著影响了3种桑树的Pn,同时农桑14号和强桑1号的非气孔因素也显著限制了Pn。
综合分析,农桑14号和农桑12号具有生长势旺的特点,它们能将有限的水分尽可能多地用于植物组织的构建,适合在湿润地区的竞争环境生长。而它们对土壤水分减少更为敏感(尤其是农桑14号),不仅表现为各部分生物量的显著下降,并且通过淘汰叶基部功能较差的叶片来减少叶片水分蒸发,从而缓和植物体水分吸收和散失的不平衡,在重度干旱胁迫下,农桑14号和农桑12号通过迅速的形态调整和控制叶片气孔的水分散失来抵御干旱的环境。强桑1号有着类似于某些干旱地区植物的用水方式,与农桑14号和农桑12号不同,光合产物的分配被严格控制,在重度干旱胁迫下各部分生物量无显著减少,叶肉细胞膜所受损伤也更为严重,相比于农桑14号和农桑12号,强桑1号更适合在干旱地区生长,而若对强桑1号延长胁迫时间,其是否也会有基部落叶的形态调整还有待继续研究。对光合限制的因素分析认为,气孔因素均显著限制了Pn,而非气孔因素也显著影响了农桑14号和强桑1号的Pn。当前评价植物的抗旱性多关注于其短期内保护酶含量,渗透物质等生理生化指标的研究,而事实上植物不可能长期处于膜系统受损的代谢状况,植物是否具有极为有效的形态调节来达到形态与环境相适应,这种长期的生存适应能力也应作为抗旱性能的评判因素之一。

