Cu-MOFs固定化酶制备及染料降解应用研究
高霞,张国春,乔成芳
(商洛学院化学工程与现代材料学院/陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
酶是一种高效、绿色的生物催化剂,具有特异性好、反应条件温和、较广泛的来源等优点。但是游离酶难以回收和不能与反应物分离,限制了其在工业中的广泛应用[1],实现酶的固定化是解决这一问题的主要途径。染料废水的降解一直是一个热点话题,染料因其毒性强、种类多、色度大等性质,不仅有诱发人类癌症的可能,而且给环境保护造成了极大的威胁,而固定化酶一个最大的用途是处理废水中的有毒物质,防止水体污染[2-7]。金属有机骨架材料(MOFs)是一类具有优良吸附性能的多孔材料,近年来在催化、光电、生物等领域具有广阔的应用前景[8-16],可作为一种理想的固定化酶载体[17]。目前文献中报道的使用MOFs材料固定化酶主要有“一锅法”和“两步法”两种方法。“一锅法”[18-23]是将游离酶与形成MOF材料的原料液直接混合,温和的条件下制备得到,此方法制备过程简单,但由于绝大多数酶为水溶性生物大分子,因此要求作为载体的MOF材料在水溶液中必须是稳定存在的,同时制备过程不能在极端条件下(如高温、强酸碱、有机溶剂等)进行。“两步法”是先合成MOFs,然后通过吸附、包埋、共价结合等方式实现酶的固定化;吸附法[24]和包埋法[25]要求MOFs材料的孔径足够大,然而目前报道的大多数MOFs材料都是微孔材料,很难被用于吸附大分子的蛋白质,在生物和环境方面还有一定的局限;而共价结合[26]要求MOFs材料表面要有可以与酶形成共价键的基团,且基团活化和修饰步骤繁琐。利用MOFs自身的优点,设计制备多级孔MOFs作为一种固定化酶的新型载体用于工业废水中有毒物质的处理,相比于常规的沸石等无机载体,吸附量和酶活的保留都会大大加强。本文利用共模板导向组装法制备得到了两种不同孔径大小的多级孔Cu-MOFs材料,选择这两种多级孔Cu-MOFs材料为载体,对氯过氧化物酶(CPO)进行固定,并研究了固定化酶在染料降解中的应用。
1 实验部分
1.1 试剂及仪器
1,3,5 -苯三甲酸(H3BTC),分析纯(梯希爱化成工业发展有限公司);Cu(NO3)2·3H2O、柠檬酸(CA)、溴化钾(KBr)、30%过氧化氢均为分析纯(国药集团);十六烷基三甲基溴化铵(CTAB),分析纯(上海山浦化工有限公司);N,N-二甲基甲酰胺(DMF)、无水乙醇均为分析纯(天津化学试剂厂);结晶紫,分析纯(天津市福晨化学试剂厂);2,2'-连氮-二(3-乙基苯并噻唑啉-6-磺酸)(ABTS),98%(Sigma-Aldrich公司);氯过氧化物酶[27](CPO,Rz=1.34)(实验室提供);全自动X-射线衍射仪,D/Max-3C型(日本Rigalcu);紫外可见分光光度计,UV-1700型(岛津国际贸易上海有限公司);高速冷冻离心机,GL-20B型(上海安亭科学仪器厂);恒温培养振荡器,SKY-200B型(上海苏坤实业有限公司);物理吸附仪,ASAP 2020 PLUS HD88系列(麦克默瑞提克(上海)仪器有限公司);电热恒温干燥箱,202型(天津市泰斯特仪器有限公司)。
1.2 多级孔Cu-MOFs的制备
溶剂热反应条件下,选择阴离子表面活性剂十六烷基三甲基溴化铵(CTAB)为结构导向剂,羟基羧酸柠檬酸(CA)为螯合剂形成的共模板体系,通过调节CTAB的用量得到两种不同孔径大小的多级孔Cu-MOFs材料,分别标记为H-Cu-MOF-0.1和H-Cu-MOF-0.2。其中H-Cu-MOF-0.1的具体制备过程如下:先将0.232 g Cu(NO3)2·3H2O,0.116 g H3BTC 和 10 mL DMF置于20 mL耐热玻璃瓶中,磁力搅拌30 min。然后加入0.1 g CTAB和0.05 g CA,继续搅拌30 min,密封后在2 h内升温至75℃,恒温24 h,然后缓慢冷却至室温,经过滤,DMF洗涤,真空干燥后得蓝色固体粉末。将所得固体粉末产物用脱脂滤纸包好后置于索氏提取器中回流提纯(放置时上下端填充脱脂棉),提纯5次,每次提纯加入25 mL浓盐酸和125 mL乙醇,温度为100℃,回流时间为6 h。最后,样品在60℃真空干燥12 h备用。H-Cu-MOF-0.2的制备过程类似于H-Cu-MOF-0.1,不同之处是CTAB的用量增加为0.2 g。
1.3 固定化酶的制备
将10 mg载体材料加入1.5 mL含2.5 μmol·L-1CPO的pH=2.75的磷酸缓冲液(PBS)中,在30℃的恒温振荡器中以200 r·min-1的转速振荡40~50 min,将混合物以 8000 r·min-1的转速离心4 min,分离上清液与固体,并用缓冲液洗涤除去载体表面游离的CPO,30℃真空干燥12 h后在4℃下干燥保存。通过计算加入的CPO的量与上清液中没有固载上的CPO的量来计算酶的固载率。固载率的计算公式为:
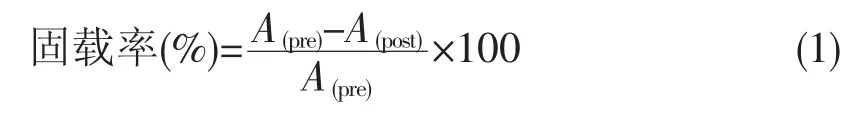
式(1)中,Apre为CPO固定前的吸光度值;Apost为CPO固定后上清液的吸光度值。固载量的计算公式为:
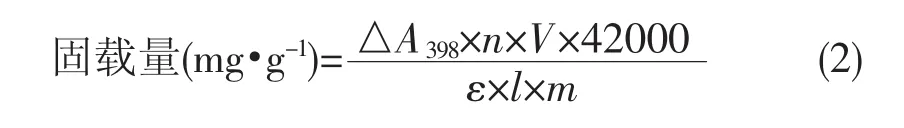
式(2)中,△A398为CPO在紫外波长398 nm处的吸光度值;ε为CPO的摩尔吸光系数(91 200 L·mol-1·cm-1);V 为实验体系最终的体积;m为加入载体的质量;l为实验中所用比色皿的宽度(cm)。
1.4 固定化酶的性质
1.4.1 固定化酶活性测定
根据文献[28-29]报道,CPO催化ABTS生成ABTS·+的过氧化反应为模型反应可用来测定固定化CPO的过氧化活性。ABTS经CPO催化和H2O2氧化转化为ABTS·+阳离子自由基的过氧化反应(见图1),反应溶液由无色变为蓝绿色,在415 nm处出现ABTS·+阳离子自由基的特征吸收峰。

图1 CPO催化ABTS生成ABTS·+的过氧化反应
由于在415 nm处ABTS·+自由基的吸光系数远大于底物ABTS,随着ABTS·+自由基浓度的增加,在415 nm处吸光度值变大,因此要检测ABTS·+在415 nm处吸光度的增加。具体过程如下:在2 mL离心管中分别加入一定量浓度为0.1 mol·L-1的磷酸缓冲液,30μL浓度为0.01 mol·L-1的ABTS,一定量的H2O2和10 μL浓度为0.05μmol·L-1的游离CPO溶液或等量的固定化CPO,于恒温下在转速为200r·min-1的恒温振荡器中反应30min,离心,测定上清液在415 nm处吸光度值,根据其摩尔吸光系数ε计算转化率。

1.4.2 热稳定性
在20℃~100℃温度下将一定量的游离CPO和含有等量CPO的固定化酶放置温育1 h,再将温育过的游离CPO和固定化酶分别催化ABTS过氧化反应,比较游离CPO和固定化酶的热稳定性。
1.4.3 重复使用性
将10 mg固定化酶用于ABTS过氧化反应,反应30 min后离心测定上清液在415 nm处的吸光度值,将剩余的固定化酶材料再次用于催化ABTS过氧化反应,以第一次ABTS转化率记作100%,将之后每次的转化率与第一次的比较,以残余催化活性表征固定化酶的重复使用性。
1.5 染料降解试验
在2 mL离心管中加入10 mg固定化酶,1 395 μL 浓度为 0.1 mol·L-1,pH=3 的磷酸缓冲液,75 μL 浓度为 10 mmol·L-1的结晶紫溶液以及 30 μLH2O2,反应 30 min 后,离心,测定上清液在583 nm处吸光度值。
2 结果与讨论
2.1 多级孔Cu-MOFs及其固定化酶的结构表征
2.1.1 N2吸附分析
本试验在HKUSK-1合成体系中,利用超分子模板剂CTAB和螯合剂CA的共同作用实现对材料孔径的调控,将制备的两种材料经180℃下过夜脱气后,在液氮温度下(77 K)进行氮气吸脱附测试,试验结果见图2、表1。由图2可知,这两种材料的N2吸脱附曲线具有较明显的第IV类N2吸脱附等温线特征,属于典型的介孔固体材料的吸附,存在滞后环,表明这两种材料均具有介孔结构。由表1可知,两种材料的微孔孔径均为0.83 nm,这与文献报道的0.85 nm基本接近,证明这两种材料为目标产物。同时H-Cu-MOF-0.1和H-Cu-MOF-0.2均具有较高的比表面积和孔体积,BET 比表面积(SBET)分别为 981.50 m2·g-1和1 087.49 m2·g-1,孔体积(Vt)分别为0.493 cm3·g-1和 0.557 cm3·g-1, 介孔孔径分别为 2.0、4.6、11.0 nm和2.0、4.8、12.0 nm。以上结果进一步证明最终成功制备了两种不同孔径大小的多级孔材料。

图2 多级孔Cu-MOFs材料的N2吸脱附

表1 多级孔Cu-MOFs材料的合成条件和孔性质
2.1.2 X-射线粉末衍射分析
多级孔Cu-MOFs材料及其固定化酶的室温粉末衍射结果见图3。由图3可知,所制备的两种多级孔Cu-MOFs材料及其固定化酶的XRD谱图与标准XRD谱图衍射峰吻合的较好,由此说明这两种材料为目标产物,同时也说明CPO的引入不会导致多级孔Cu-MOFs材料骨架的坍塌。

图3 多级孔Cu-MOFs材料及其固定化酶的粉末衍射图和Cu-BTC的标准模拟图
2.2 固定化条件的优化
本试验所用的固定化方法是物理吸附法,固定化条件的优化是按照1.3的实验步骤,分别对固定化过程的pH、温度以及固定时间进行了考察,结果见图4。如图4可知,H-Cu-MOF-0.1和H-Cu-MOF-0.2固定CPO的较佳固定化时间分别为40 min和50 min,较佳pH均为2.75,较佳固定化温度均为30℃,较佳固载量分别为14.51mg·g-1和 21.41 mg·g-1。
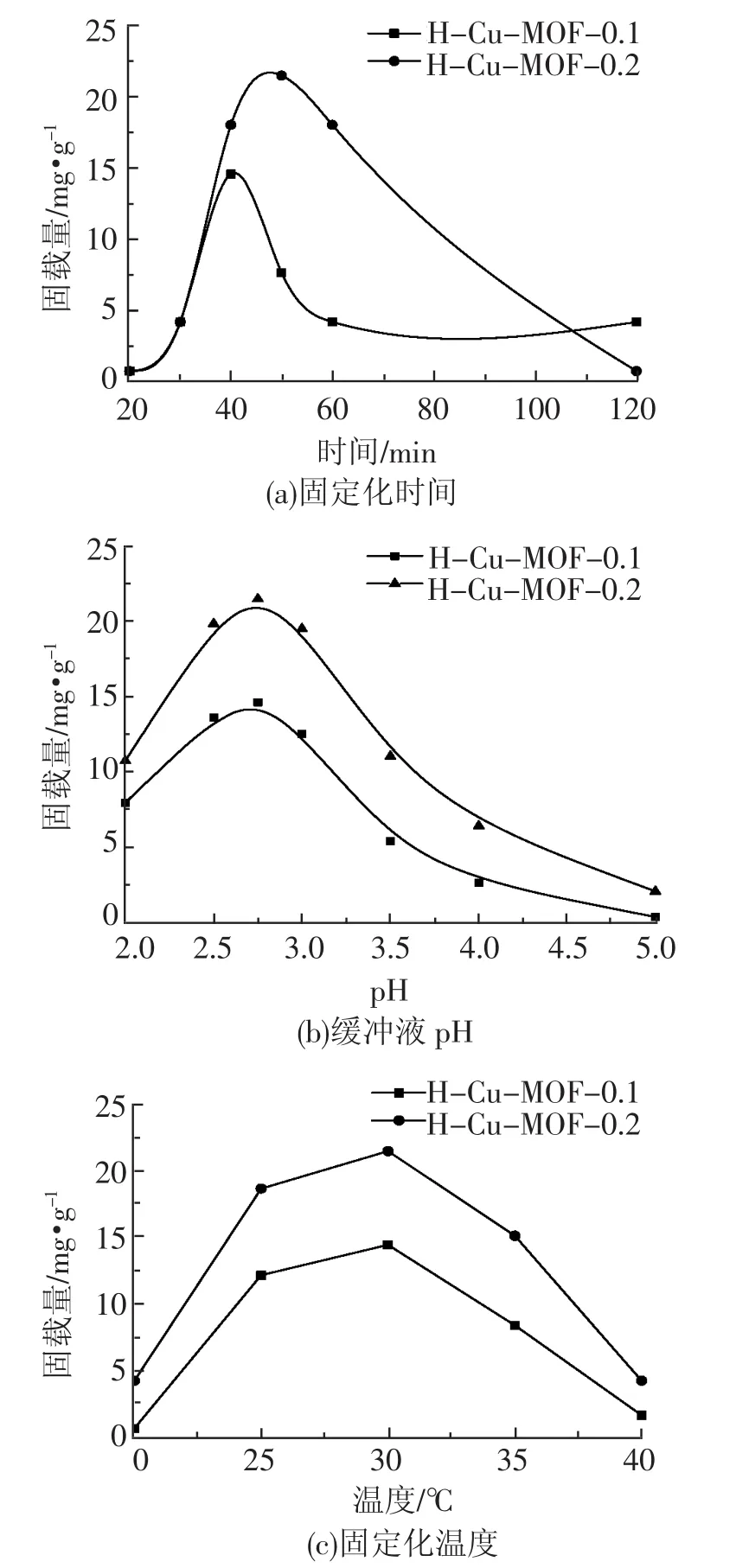
图4 固定化条件对CPO固定化效率的影响
2.3 固定化酶的性质
2.3.1 热稳定性
将游离CPO和固定化酶在20℃~90℃内不同温度下温浴1 h检测其相对活性,结果见图5。由图5可知,游离CPO的较佳反应温度为30℃,而固定化酶的较佳反应温度均为40℃。以较佳反应温度下的活性为标准,考察不同温度下CPO的相对活性,当温度升至50℃时,游离CPO仅能保持41.02%的催化活性,而CPO@H-Cu-MOF-0.1仍能保持84.93%的催化活性,CPO@H-Cu-MOF-0.2仍能保持88.94%的催化活性;当温度升至60℃时,游离CPO的残余活性仅剩23.33%,而CPO@H-Cu-MOF-0.1和CPO@H-Cu-MOF-0.2在 70℃仍能保持52.73%和64.04%的催化活性。实验结果表明,固定化酶的热稳定性较游离酶显著提高,这是因为载体材料为游离酶抵御高温提供了屏障,减弱了温度对固定化酶构象的影响。
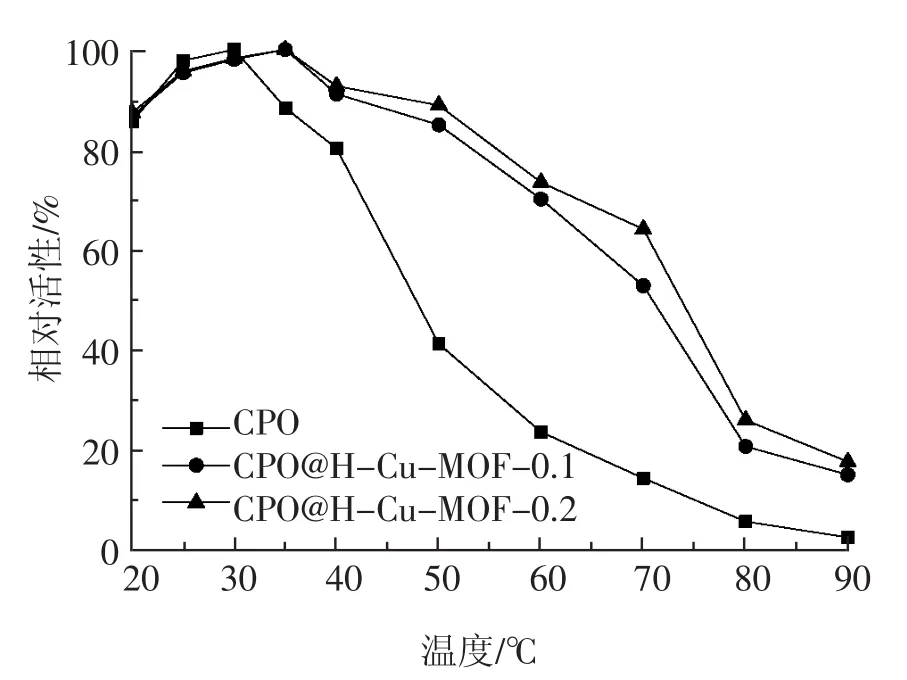
图5 游离CPO和固定化CPO的热稳定性
2.3.2 重复使用性
固定化酶的重复使用性研究结果见图6。由图6可知,随着重复使用次数的增加,固定化酶的催化活性缓慢下降,CPO@H-Cu-MOF-0.1和CPO@H-Cu-MOF-0.2在重复使用5次后,分别保持65.25%和76.38%的催化活性。CPO@H-Cu-MOF-0.1在重复使用7次之后仍能保持43.44%的催化活性,而CPO@H-Cu-MOF-0.2在重复使用7次后仍能保持48.35%的催化活性,表明固定化酶具有良好的重复使用性。

图6 固定化CPO的重复使用性
2.4 染料降解应用研究
基于CPO的氧化活性,将本试验制备的两种固定化酶材料应用于三苯甲烷类染料结晶紫的氧化降解反应中,通过对温度、H2O2浓度、染料浓度和磷酸缓冲液的pH进行优化,得到这两种固定化酶材料降解结晶紫的较佳降解条件分别为 H2O2浓度 10.0 mmol·L-1、 温度 30 ℃、结晶紫浓度 2.0 mmol·L-1、pH 3.0。试验结果见图7、图8。染料降解率的具体计算公式为:
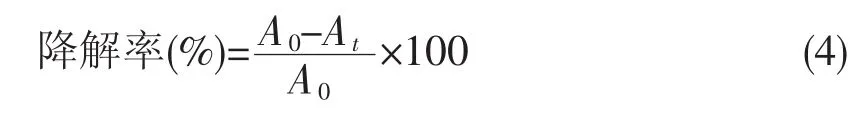
式(4)中,A0为降解前,染料在其紫外特征吸收峰处的吸光度值;At为降解后,染料在其紫外特征吸收峰处的吸光度值。

图7 固定化CPO降解结晶紫效果图
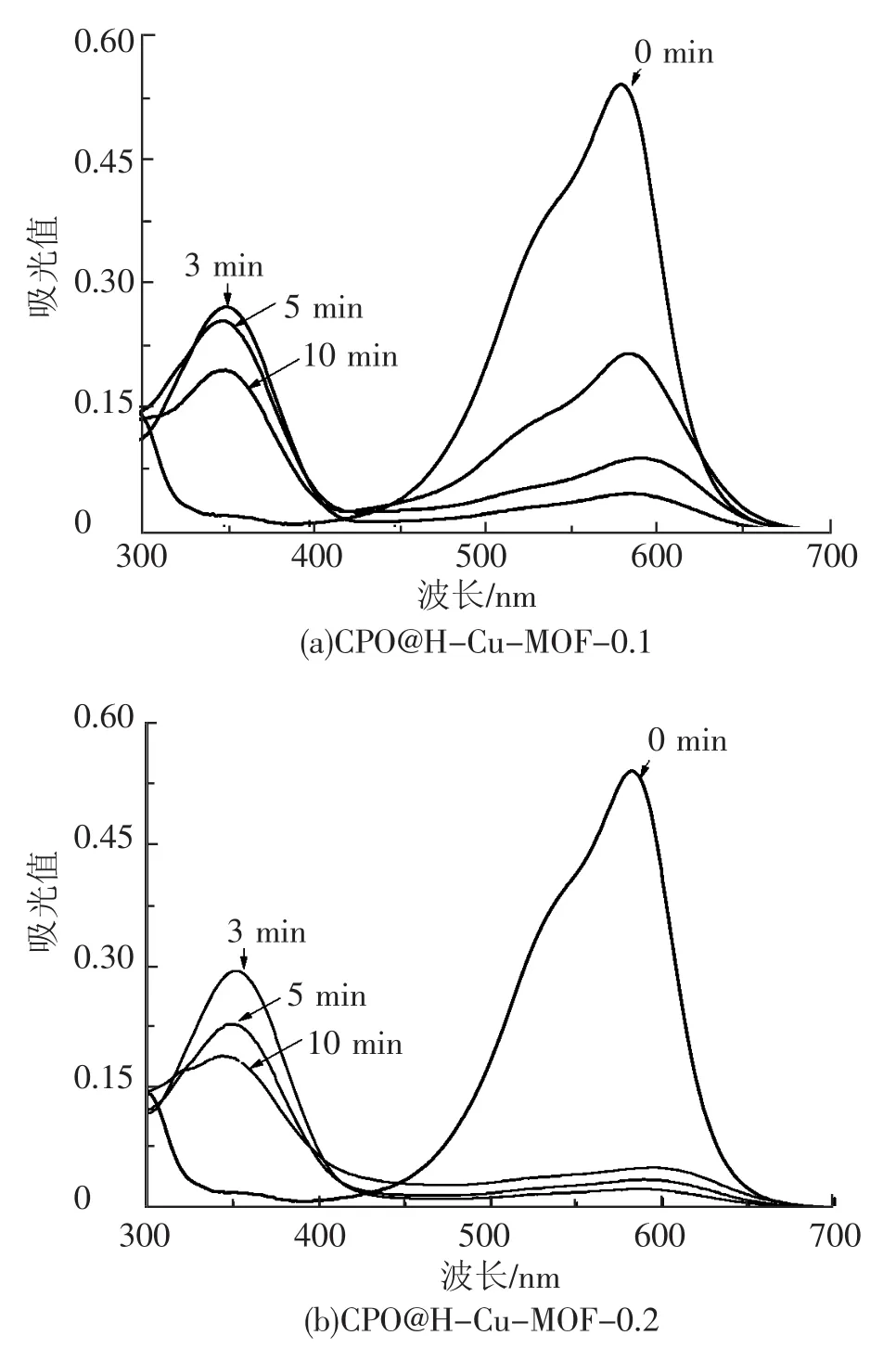
图8 降解结晶紫的紫外光谱图
由图7和图8可以看出,本试验制备的这两种固定化酶材料 CPO@H-Cu-MOF-0.1和CPO@H-Cu-MOF-0.2均能使结晶紫染料脱色,而且发色团基本被破坏。由图9可以得知,CPO@H-Cu-MOF-0.2对染料结晶紫的降解效果较好,3 min内降解率就可以达到91.11%,10 min时降解率达到94.63%,30 min时降解率几乎为100%,而CPO@H-Cu-MOF-0.1的降解时间相对较长,3 min内降解率为 60.56%,20 min时降解率达到 90.93%,30 min 时降解率为 91.67%。
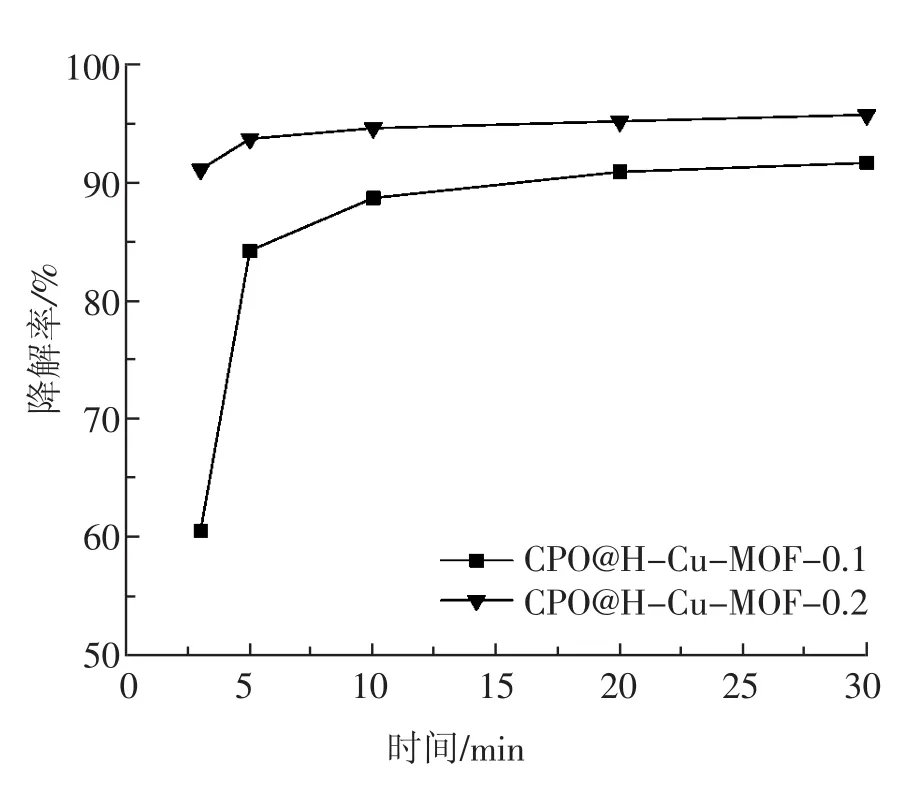
图9 时间对结晶紫降解率的影响
3 结论
利用多级孔Cu-MOFs材料为载体固定CPO,在 CPO 2.5 μmol·L-1,pH 2.75 下固定 40~50 min,成功得到两种活性较高的固定化酶,并对固定化酶的性质进行研究,结果表明,这两种固定化酶的热稳定性较游离CPO均明显增强,同时具有良好的重复使用性,在重复使用5次后,仍能保持大于65%的催化活性。此外,还探讨了固定化酶在三苯甲烷类染料结晶紫降解中的应用,结果表明其对染料结晶紫的催化降解效果显著,此类固定化酶材料作为一种绿色的固体催化剂在工业废水中有毒物质处理方面有着极为广阔的应用前景。

