医院Ⅰ期病房管理风险防范
礼 嵩,张 黎,周 铁,唐守艳,陆雯静,盛 夏*
(1.海军军医大学附属长海医院泌尿外科GCP平台,上海 200433;2.海军军医大学附属长海医院药学部,上海 200433)
医院I期病房是为开展药物I期临床试验和生物等效性等研究而建立的独立医疗病区[1]。由于I期临床试验是创新药物研发后初步临床药理学及人体安全性评价试验[2],涉及到新药的首次人体试验(first-in-humanstudy, FIH),缺乏临床资料和未知的不良事件的预期,新药的耐受性和安全性的不确定性是最高的,加之高密集采血等操作使得I期病房成为医院发生风险事件的高危区域,也成为医院风险管理的重中之重。国家食品药品监督管理总局于2011年发布《药物I期临床试验管理指导原则(试行)》(简称“指导原则”)将I期病房的风险管理作为一项重要内容写入章程。本文就近年来在本院开展I期临床试验的经验,通过对各风险因素的分析,制定一系列风险控制措施和应急预案,以最大程度控制风险,提高医院I期病房管理水平。
1 Ⅰ期病房风险因素分析
1.1研究药物因素新药从临床前试验转化为首次人体试验,大多只有临床前资料而缺乏相关的临床数据和经验,新药在人体中的剂量/浓度-毒性关系、剂量/浓度-效应关系等均处于初次摸索阶段,可能发生的不良事件(AE)甚至严重不良事件(SAE)均无法预期。特别是一些对身体重要的系统造成严重障碍的新药、激动剂或具有刺激作用的新药、免疫系统靶向剂等被认为是“高风险药物”[3]。
1.2试验操作因素新药药代动力学研究及生物等效性研究均需要进行高密集采血等操作,有病例报道在采血期间发生重度腹泻至低血容量休克及晕血等不良事件发生,另有因血管较细多次穿刺采血造成上肢穿刺部位瘀肿的不良事件报道[4]。
1.3受试者因素常规Ⅰ期试验受试者多为健康成人,个别I期临床研究的受试者需要选择特殊人群,如儿童、老年人、孕期妇女、患者或其他弱势群体[1]。比如在本科室进行的一项晚期前列腺癌新药的I期临床试验,因研究药物为抗癌药物,对健康人群有一定的伤害,受试者均为晚期肿瘤患者,合并疾病较多身体状况较差,发生突发事件的风险大幅度增加。
1.4软硬件设施因素“指导原则”中规定I期试验病房应具有原地抢救,以及迅速转诊的能力,配备抢救室。但通常I期病房配备抢救设备和急救药品均为常规抢救药品,对于新药发生的特殊突发事件,多数情况未准备特定抢救药品和设备,仍需要及时转诊至专科诊室进行抢救。
2 风险管理的措施
2.1完善各项管理制度
2.1.1 完善管理制度和SOP 制定完善的I期病房管理制度和标准操作规程(SOP),特别是建立保障健康与安全的管理制度,包括工作场所安全、饮食安全、污染控制、职业暴露防护、有害物质控制等措施。特别应备有常规急救预案等文件,例如心脏急救、过敏反应、细胞因子释放综合征、抽搐,以及低血压等常规的突发事件有较为完善的急救方法与流程[5]。
2.1.2 完善人员管理制度 加强研究人员管理,注重培训和考核制度,特别是强调研究医师应具备急诊和急救等方面的能力,试验病房至少有一名具有重症护理或急救护理经历的专职护士。
2.2Ⅰ期病房急救硬件设施核查
2.2.1 Ⅰ期病房常规急救硬件设施核查 Ⅰ期病房应具备一定的抢救要求:试验病房应具有原地抢救以及迅速转诊的能力,配备抢救室,具有必要的抢救、监护仪器设备和常用的急救药品、紧急呼叫系统等[1]。常规的急救设施包括除颤器、心电图机、心电监护仪、呼吸机、吸氧装置、吸引器等设施,应在试验前协调医院仪器科及相关专业科室医务人员集中核对检查,确保仪器正常使用,热敏纸等耗材数量充足等。抢救车应重点核查,清点急救药品及器械,并核查是否均在有效期内。另外,应配备专人对抢救仪器进行设备维护和管理。
2.2.2 非常规急救药品及预案准备 新药Ⅰ期临床试验可以根据前期非临床研究及相似机理药物的临床资料,预测可能发生的严重不良反应或紧急突发事件,有针对性准备急救设施和药品及相应急救预案。比如在本科室进行的一项晚期前列腺癌的新一代雄激素受体拮抗剂的新药Ⅰ期临床试验,相同机理药物在一项名为AFFIRM的临床试验中报道有0.6%的患者出现了癫痫发作,因此在进行该研究前联系神经内科准备相应的急救预案及地西泮、苯巴比妥及复方甘露醇等急救药品[6-7]。
2.3建立紧急突发事件应急预案
2.3.1 建立“Ⅰ期病房紧急突发事件应急分队” 可向医院医教部/医务科等分管医疗事务的医院机关部门提出申请,由该部门委派专人作为Ⅰ期临床试验紧急突发事件应急分队组长,项目主要研究者(PI)为副组长,同时协调急诊中心、心血管内科和呼吸科等常见突发事件相关科室指派专人共同组成“紧急突发事件应急分队”。除此之外,根据预期的严重不良反应协调特定临床科室委派专人作为预备成员,例如上述例子中因可能发生癫痫的突发事件,需要提前协调神经内科参与应急分队。
2.3.2 建立突发事件急救流程 开通急救“绿色通道” 建立突发事件急救流程,开通急救“绿色通道”(图1),医务人员有组织有纪律地开展施救,大幅度提高施救效率,获得宝贵的抢救时间。其中关键因素是“责任到人”,应在流程中标明姓名及手机号码,将流程图张贴于醒目位置,便于急救的实施。
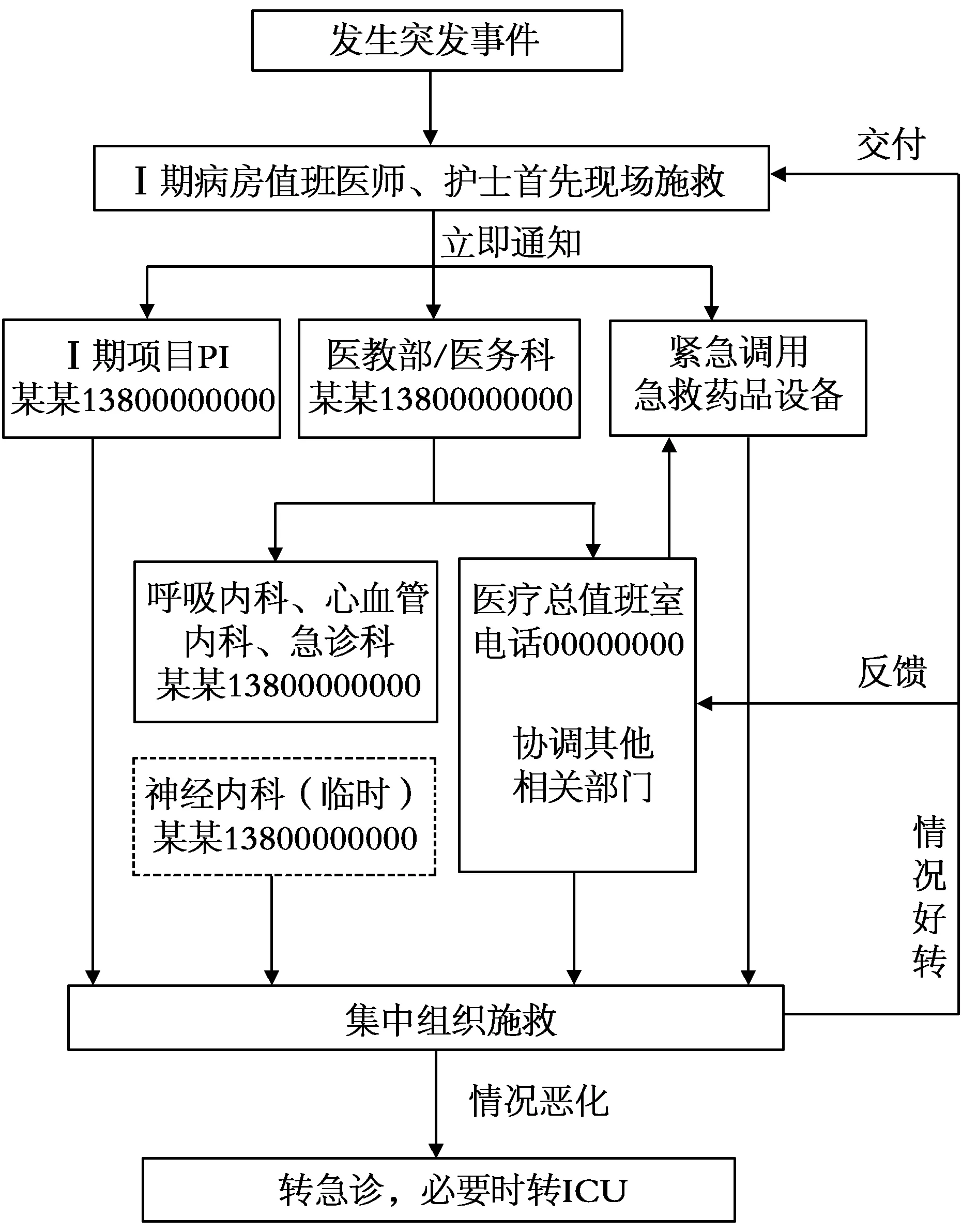
图1 Ⅰ期病房突发事件急救流程
2.3.3 紧急突发事件急救演练 一份完善的急救预案应具有良好的可操作性,急救演练是评价突发事件急救流程是否具有可操作性最直接也是最可靠的方法。由紧急突发事件应急分队组长(医教部或医务科人员)和副组长(项目PI)共同带队,所有参与抢救的医务人员以及申办方、CRC(临床研究协调员)、CRA(临床研究监察员)共同参与,对急救流程的可操作性进行评估,并及时修改完善。
2.4必要时建立“数据与安全监察委员会(DataandSaltyMonitoringBoards,DSMB)” 数据与安全监察委员会(DSMB)是一个由申办方授权成立的由多学科(视情况应包括相关专业背景的医师、临床药理/毒理学、流行病学、统计学、临床试验管理与伦理学等)专家组成的,对在研项目提供独立、有效、及时的数据审查组织。DSMB是一个独立的顾问团体,其构成、审查与决策程序不应受到政治、社会、机构、职业和市场的影响。对于高风险干预措施的早期研究、创新性的干预措施的早期阶段研究以及受试者招募对象属于弱势人群等8种情况的I期临床研究被建议需要建立DSMB[8]。有报道美国国立卫生研究院(NIH)已经建议在针对未成年人或有其他重大风险受试者参与的I/II期临床研究中成立DSMB[9-12]。
在突发事件发生后,DSMB组织召开审查会,对有关安全性的问题实施紧急审查与评估[8]。通过评估试验进展、分析安全性数据及重要的效应指标,及时进行必要的补充风险评估,并决定项目的后续实施计划[13]。如一旦出于安全考虑认为有必要,可建议申办者暂停或终止该研究[8]。
3 风险管理成效
本院Ⅰ期病房实施风险管理目前已取得初步成效。主要体现在四个方面:①Ⅰ期病房急救设备、管理制度、标准操作规程和急救预案文件等逐步到位,为Ⅰ期病房的风险管理从软件到硬件提供一定保证;②在本院Ⅰ期病房实施风险管理以来,在所开展各项临床试验中未出现重大医疗事故;③对本院Ⅰ期病房实施风险管理前后的风险事件发生数用SPSS 19.0统计软件进行χ2检验,结果显示开展风险管理前后风险事件的发生具有显著性差异,不良反应的发生率从24.3%降低到7.3%;④采用问卷调查的形式评估受试者对I期病房的满意度,设置20个封闭式条目和1个开放式条目,从病房环境、医务人员的业务能力,服务态度、发生不良反应事件的处理四个方面进行评估。量表的应答选项采用李克特量表(Likert-Scale)模式,分为很不满意、不满意、一般、满意、很满意5个等级,依次赋值1~5分,该量表经论证具有良好的信度、效度及可行性。受试者满意度调查结果达到98.75%(表1)。
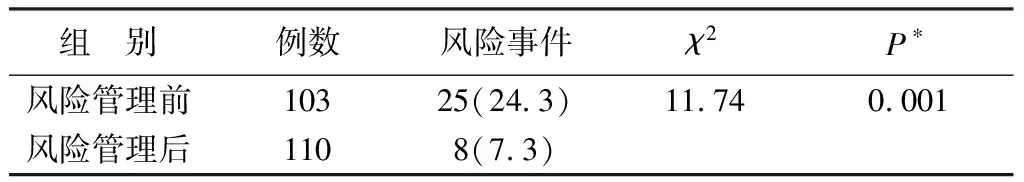
表1 风险事件发生率比较[例(%)]
*P<0.05被认为具有显著性差异
4 小 结
实践证明,建立和启动Ⅰ期病房风险管理和突发事件应急预案是必要的、可行的、有效的。本院实施Ⅰ期病房的风险管理虽初见成效,但因本院Ⅰ期病房于2016年才完成重建工作,仍缺乏一定的突发事件处理经验,仍然是本院风险管理的薄弱区域。研究者在项目实施过程中必须坚持“受试者安全第一”,不断加强和完善各项管理制度,在紧急突发事件发生时将损害降低到最小程度,以最大限度保证受试者人身安全。

