游泳和下坡跑通过CN/NFAT信号途径对2型糖尿病小鼠骨吸收代谢的影响
陈祥和,李世昌,孙 朋,陈爱国,马 涛,牟其林
游泳和下坡跑通过CN/NFAT信号途径对2型糖尿病小鼠骨吸收代谢的影响
陈祥和1,李世昌2,孙 朋2,陈爱国1,马 涛3,牟其林4
1. 扬州大学 体育学院, 江苏 扬州 225127; 2. 华东师范大学, 上海 200241 “青少年健康评价与运动干预”教育部重点实验室 ; 3. 齐鲁师范学院 体育学院, 山东 济南 250200; 4. 贵阳学院 体育学院, 贵州 贵阳 550000.
目的:探究游泳和下坡跑通过钙调磷酸酶(CN)/活化T细胞核因子(NFAT)途径对T2DM小鼠骨吸收代谢的影响。方法:采用6周高脂膳食和一次性注射链脲佐菌素(STZ)进行T2DM造模,成功后随机分为T2DM对照组(TC)、T2DM游泳组(TS)和T2DM下坡跑组(TD),另选C57小鼠为正常对照组(ZC)。T2DM小鼠继续高脂膳食,ZC小鼠饲以普通饲料。TS和TD小鼠分别进行8周游泳和下坡跑训练。末次训练24 h后处死小鼠并取材,应用Micro-CT、细胞原代培养、ELISA、RT-PCR及West-blotting等技术方法对骨组织形态计量学指标、OC数量、离子浓度、细胞因子mRNA和蛋白表达等进行检测。结果:TC组股骨中TRAF6、CN、Src-3、PLC、NFATc1、TRAP mRNA及胫骨中Src1和NFATc1蛋白表达上调(<0.05),血清IP3和Ca2+浓度升高(<0.05),BMM分化产生的OC总数量和≥10个核OC数量增多(<0.01)。股骨远端松质骨和皮质骨骨组织形态计量学指标显著下降(<0.05)。与TC比,TS组股骨中TRAF6、CN、PLC和TRAPmRNA及Src1蛋白表达下调,血清Ca2+浓度下降(<0.05或<0.01)。TD组股骨中TRAF6、CN、Src-3、PLC、NFATc1和TRAPmRNA及胫骨中Src1和NFATc1蛋白表达下调,血清IP3和Ca2+浓度下降(<0.05)。OC总数量和≥10个核OC数量显著减少(<0.05),松质骨和皮质骨骨组织形态计量学指标显著改善(<0.05)。与TS比,TD组股骨中TRAF6、Src-3、PLC和TRAP mRNA表达下调及血清IP3和Ca2+浓度下降(<0.05),OC总数量(<0.05)下降,松质骨BS/TV增加(<0.05)。结论:T2DM小鼠骨吸收增强。下坡跑通过抑制T2DM小鼠骨中CN/NFAT途径,减少OC数量,降低骨吸收,改善骨组织形态结构,且其作用效果优于游泳。
运动;CN/NFAT;2型糖尿病;破骨细胞;骨吸收;骨组织形态计量学
2型糖尿病(Type2 diabetes mellitus,T2DM)机体骨代谢发生紊乱,骨吸收大于骨形成,骨密度(Bone mineral density, BMD)降低、骨组织形态结构退化,导致骨质疏松发生[26]。T2DM小鼠松质骨的骨形成速率、骨小梁形态结构和生物力学性能显著下降[15]。人体研究中,T2DM患者骨代谢紊乱,股骨颈等BMD降低,骨质疏松及骨折发生率显著增加[19]。运动作为抑制骨吸收的有效干预方式,可显著提高T2DM人或动物的BMD、骨组织形态结构、骨生物力学等骨表型指标,改善骨健康[7,13]。但运动方式不同对骨产生的力学刺激方式(分为直接力学刺激,即地面反作用力和间接力学刺激,即肌肉牵拉力)存在较大差异,直接力学刺激抑制骨吸收的作用效果优于间接力学刺激[1]。钙调磷酸酶(Calcineurin, CN)/活化T细胞核因子(Nuclear factor of activated T cell, NFAT)是介导骨吸收的关键途径[20],其可调控OC分化产生、融核及其骨吸收能力。但有关运动影响该途径进而调控T2DM骨吸收代谢的相关研究尚待探究。本研究拟利用游泳和下坡跑对T2DM小鼠进行干预,探究两种运动方式对T2DM骨吸收代谢的影响及CN/NFAT信号途径在此过程中的调控机制,为运动改善糖尿病骨健康提供科学依据。
1 研究材料与方法
1.1 实验动物造模及分组
40只4周龄C57BL/6雄性小鼠购自上海西普尔—必凯公司(生产证号:SYXX(沪)2015-0011),初始体重19±0.24g,适应性喂养1周后,随机分为正常对照组(ZC,10只)和高脂饲料组(30只)。高脂饲料组小鼠喂饲高脂饲料(购自上海斯莱克公司,配方:繁殖鼠料54.6%、猪油16.9%、蔗糖14.0%、酪蛋白10.2%、预混料2.1%和麦芽糊精2.2%。其中碳水化合物、脂肪和蛋白质3大物质的供能百分比分别为40%、40%和20%。),6周末空腹12h后,利用注射器于小鼠下腹部离腹白线约0.5cm处刺入,针头与小鼠腹部成30°角,一次性注射链脲佐菌素(Streptozotocin, STZ, 80 mg/kg),ZC组注射柠檬酸/柠檬酸钠溶液。2周后,利用Roche血糖仪(型号ACCU-CHECK®Active)和血糖试纸检测小鼠空腹血糖浓度,≥8 mmol/L为T2DM小鼠[17],共27只。随机将T2DM小鼠分为T2DM对照组(TC,9只)、T2DM游泳组(TS,9只)和T2DM下坡跑组(TD,9只)。ZC组小鼠喂以普通饲料,T2DM小鼠继续高脂饲养,均自由饮水,昼夜比为1:1。该实验方案通过华东师范大学动物实验伦理委员会批准(动物伦理编号:M20150311)。
1.2 实验动物训练方案
利用游泳和下坡跑分别对TS和TD小鼠进行干预,方案如下:游泳:将小鼠放于长度(42 cm)×宽度(40 cm)×水深(36 cm)水箱中进行游泳训练,水温为32±1ºC,50 min/次,6天/周,共计8周(第1周为适应训练,前两天30 min/天,第3~4天40 min/天,第5~6天50 min/天,从第2周开始按50 min/天进行训练)。下坡跑:0.8 km/h、50 min/次,1次/天、坡度-9°、6天/周,共计8周(第1周为适应训练,前两天30 min/天,第3~4天40 min/天,第5~6天50 min/天,从第2周开始按50 min/天进行训练)。
1.3 实验动物取材
摘除小鼠眼球,利用1.5ml离心管收集全血,4℃过夜后,按1000 rpm×10 min离心,取血清并存于-80℃冰箱中以备ELISA检测相关指标;取小鼠左股骨并将肌肉等去除干净,以备利用微计算机断层扫描技术(Micro computed tomography, Micro-CT)检测股骨远端骨组织形态计量学指标;取小鼠骨髓巨噬细胞(Bone marrow-derived macrophage, BMM),进行细胞原代培养并诱导其向破骨细胞(Osteoclast, OC)分化;取小鼠右侧后肢骨用于相关因子mRNA(股骨)和蛋白(胫骨)表达检测。
1.4 指标检测
1.4.1 股骨骨组织形态计量学指标检测
股骨4%多聚甲醛(Paraformaldehyde, PFA)固定24 h后,利用Skyscan Micro-CT系统(型号: 1076)按18 μm/帧对其远端进行扫描,并利用CT An软件对松/皮质骨骨组织形态计量学指标进行分析,以获得三维结构图和骨组织形态计量学指标相关数据。
1.4.2 诱导BMM向OC分化及相关检测
取小鼠股骨和胫骨骨髓来制备单细胞悬液。离心、弃上清且重悬加入红细胞裂解液,再离心、弃上清和重悬后。加到6 cm培养皿并置于培养箱中。24 h后对贴壁细胞进行消化、计数,按3万/孔接于48孔板中。24 h后,培养基中加入核因子-κB受体活化因子配体(Receptor activator of nuclear factor-kB ligand, RANKL)诱导BMM向OC分化,每隔2天换液。第5天,4% PFA固定OC后,进行抗酒石酸酸性磷酸酶(Tartrate-resistant acid phosphatase,TRAP)染色,利用Canon相机和Leica显微镜进行拍照并利用Blindness法进行计数[21]。
1.4.3 股骨中相关细胞因子mRNA表达检测
按标准步骤[1]提取右侧股骨中RNA,并按反转试剂盒步骤(购自Takara Bio)将RNA反转为cDNA。按实时荧光定量PCR试剂盒(购自Takara Bio)步骤对相关因子的mRNA表达进行检测。利用Primer premer引物设计软件对相关引物进行设计后,由上海生工生物工程有限公司合成。引物序列见表1。

表1 引物序列
1.4.4 骨中Src1和NFATc1的蛋白表达检测
按标准步骤[21]提取骨中蛋白,利用BCA法[23]测定浓度后,蛋白变性。10%和12%分离胶电泳后将蛋白转至PVDF膜。5%脱脂奶粉封闭,分别Ⅰ抗4℃和Ⅱ抗室温孵育。TBST洗膜后,利用Alpha凝胶成像系统对PVDF膜进行显影拍照并利用自带软件进行数据分析。
1.4.5 血清中三磷酸肌醇(Inositoltriphosphate, IP3 )和Ca2+浓度检测
按酶联免疫试剂盒(IP3 ELISA Kit购自CSB;Ca2+ELISA Kit购自SIGMA)步骤要求进行血清IP3和Ca2+浓度检测,每个样品做一平行样。
1.5 数据处理方法
利用Excel、GraphPad Prism 5和SPSS18.0对实验检测的数据进行统计、分析(ZC和TC两组之间进行独立样本检验,TC、TS和TD 3组之间进行单因素方差分析),<0.05和<0.01分别表示差异具有显著性和差异具有非常显著性。
2 实验结果
2.1 游泳和下坡跑对T2DM小鼠股骨远端骨组织形态计量学指标的影响
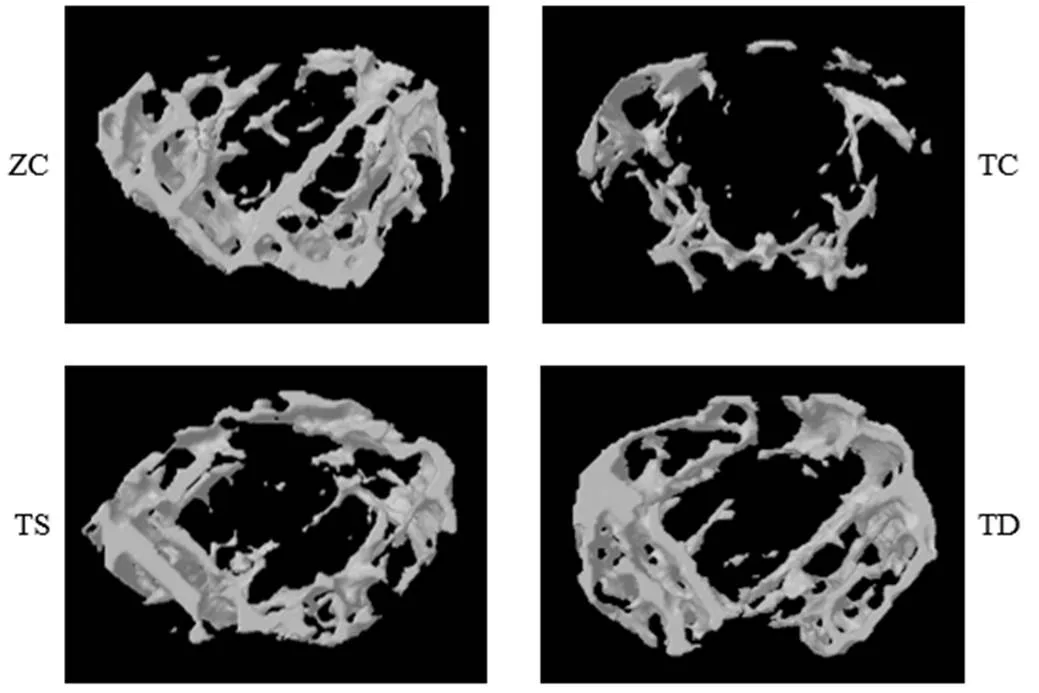
图1 T2DM小鼠运动后股骨远端松质骨骨组织形态结构变化
Figure 1 Changes of Morphological Structure of Trabecular after Exercises

表2 T2DM小鼠运动后股骨远端松质骨形态计量学指标的变化
注:与ZC组相比,“*”表示<0.05,“**”表示<0.01;与TC组相比,“★”表示<0.05,“★★”表示<0.01;与TS组相比,“●”表示<0.05。
由图1和表2可知,与ZC组相比,TC组小鼠股骨远端松质骨BMD、BV、BV/TV、BS、IS、BS/BV、BS/TV、Tb.Th和Tb.N均显著下降,而BS/BV和Tb.Sp显著升高(<0.05或<0.01)。与TC组相比,TD组小鼠股骨远端松质骨BMD、BV、BV/TV、BS、IS、BS/BV、BS/TV、Tb.Th和Tb.N均呈现显著性变化(<0.05或<0.01)。与TS组相比,TD组小鼠股骨远端松质骨BS/TV显著性增加(<0.05)。TS组与TC组之间没有显著差异。
分析表3可知,与ZC组相比,TC组小鼠股骨远端皮质骨BMD、IS和Tb.Th均显著下降(<0.05或<0.01)。与TC组相比,TD组小鼠股骨远端皮质骨BV/TV、BS/BV和Tb.Th均出现显著变化(<0.05)。TS组与TC组之间没有显著差异。
2.2 游泳和下坡跑对T2DM小鼠BMM分化产生的OC数量影响

表3 T2DM小鼠运动后股骨远端皮质骨骨形态计量学指标变化
注:与ZC组相比,“*”表示<0.05,“**”表示<0.01;与TC组相比,“★”表示<0.05。
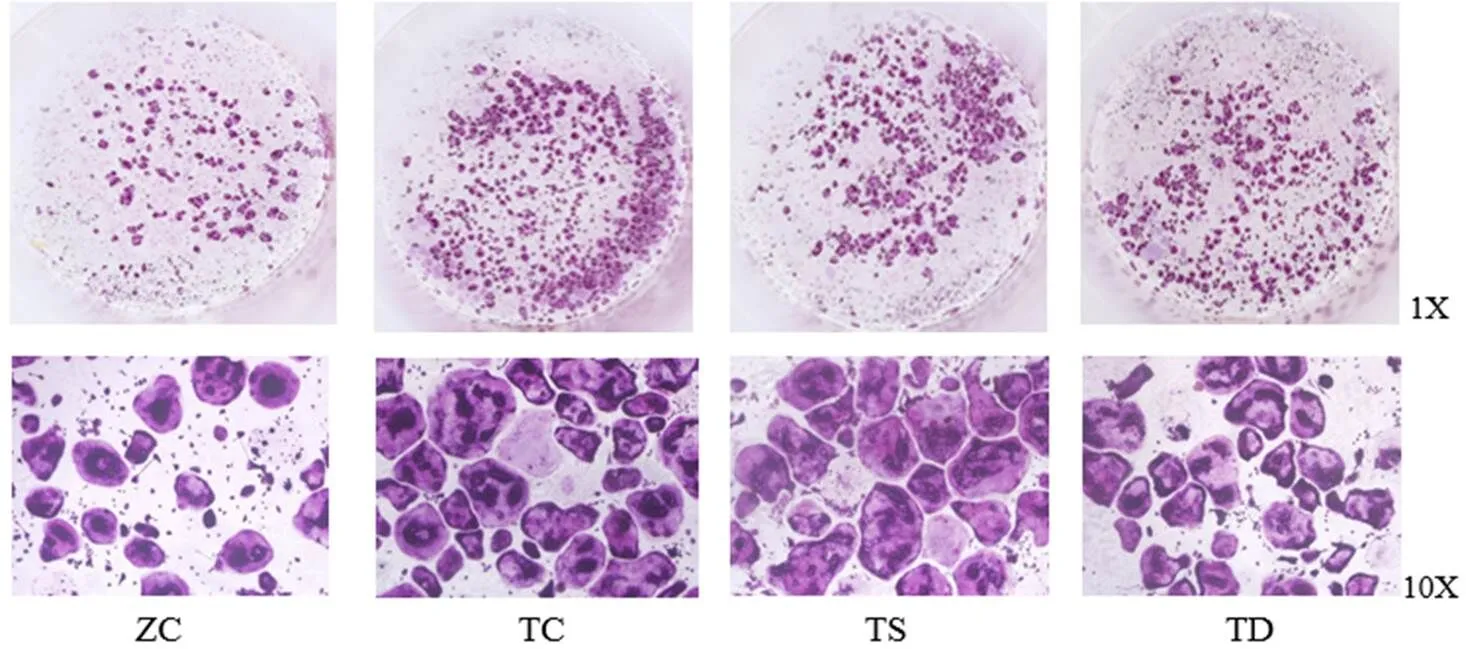
图2 T2DM小鼠运动后OC分化产生数量的影响
Figure 2 Changes of OC Number in T2DM Mice after Exercises

表4 T2DM小鼠运动后骨髓BMM分化产生OC数量的变化
注:与ZC组相比,“**”表示<0.05;与TC组相比,“★”表示<0.05,“★★”表示<0.01;与TS组相比,“●”表示<0.05。
由图2和表4可知,与ZC组相比,TC组小鼠骨髓中BMM分化产生的OC总数量和≥10个核OC数量显著增多(<0.01),TD组小鼠BMM分化产生的OC总数量和≥10个核OC数量显著少于TC组和TS组(<0.05或<0.01);TS组与TC组无显著差异。
2.3 游泳和下坡跑对T2DM小鼠股骨中相关因子mRNA表达的影响

表5 T2DM小鼠运动后股骨中相关因子mRNA表达变化(±SD,n=6)
注:与ZC组相比,“*”表示<0.05,“**”表示<0.01;与TC组相比,“★”表示<0.05,“★★”表示<0.01;与TS组相比,“●”表示<0.05,“●●”表示<0.01。
分析表5可知,与ZC组相比,TC组小鼠股骨中肿瘤坏死因子受体相关因子6(Tumor necrosis factor receptor-related factor, TRAF6)、类固醇受体辅助激活因子-3(Steroid receptor coactivator-3, Src3)、CN、磷脂酶C (Phospholipase C, PLC)、NFATc1和TRAP的mRNA表达均显著上调(<0.05或<0.01)。与TC组相比,TS组小鼠股骨中TRAF6、PLC、CN和TRAP的mRNA表达显著下调(<0.05或<0.01),TD组小鼠股骨中TRAF6、Src-3、PLC、CN、NFATc1和TRAP mRNA表达均显著下调(<0.05或<0.01)。与TS组相比,TD组小鼠股骨中TRAF6、Src-3、PLC和TRAP mRNA表达均显著下调(<0.05或<0.01)。
2.4 游泳和下坡跑对T2DM小鼠胫骨中Src1和NFATc1蛋白表达的影响
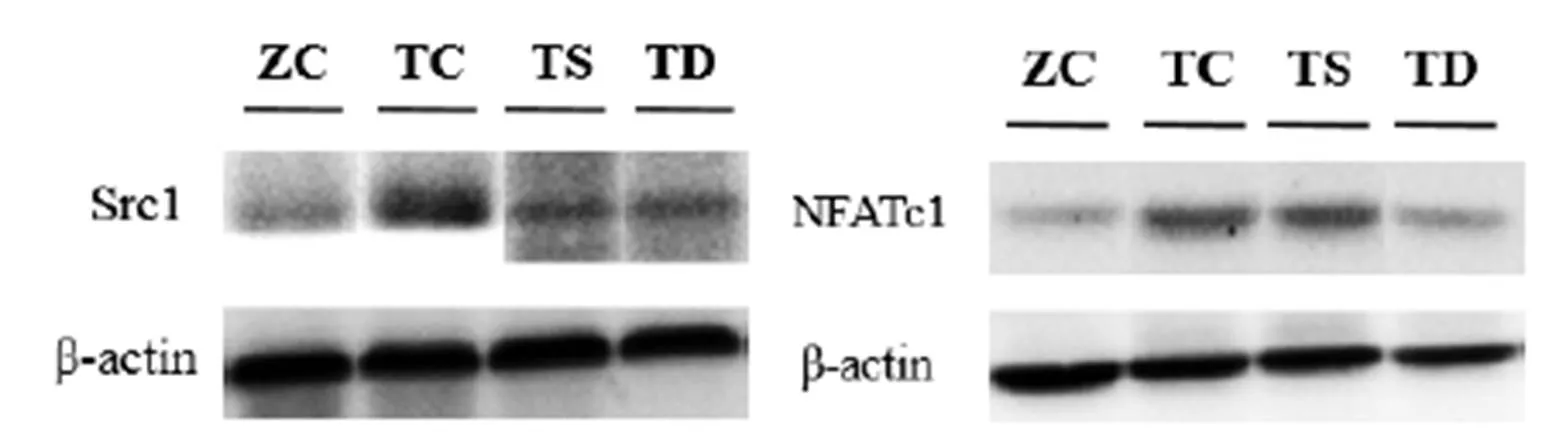
图3 T2DM小鼠运动后胫骨中Src1和NFATc1蛋白表达变化
Figure 3 Changes of Src1and NFATc1 Protein Expression after Exercises

表6 T2DM小鼠运动后胫骨中Src1和NFATc1蛋白表达变化
注:与ZC组相比,“**”表示<0.01;与TC组相比,“★”表示<0.05;“★★”表示<0.01。
由图3和表6可知,与ZC组相比,TC组小鼠胫骨中Src1和NFATc1蛋白表达显著上调(<0.01)。与TC组相比,TS组小鼠胫骨中Src1蛋白表达显著下调(<0.01);TD 组小鼠胫骨中Src1和NFATc1蛋白表达均显著下调<0.05或<0.01),TD组与TS组之间无差异。
2.5 游泳和下坡跑对T2DM小鼠血清中IP3和Ca2+浓度的影响

表7 T2DM小鼠运动后血清IP3和Ca2+浓度变化
注:与ZC组相比,“*”表示<0.05;与TC组相比,“★”表示<0.05;与TS组相比,“●”表示<0.05。
表7可知,与ZC组相比,TC组小鼠血清中IP3和Ca2+浓度均显著升高(<0.05)。与TC组相比,TS组小鼠血清中Ca2+浓度显著下降(<0.05);TD组小鼠血清中IP3和Ca2+浓度均显著下降(<0.05)。与TS组相比,TD组小鼠血清中IP3和Ca2+浓度均显著下降(<0.05)。
3 分析讨论
3.1 游泳和下坡跑对T2DM小鼠股骨远端骨组织形态计量学指标的影响
T2DM作为一内分泌代谢性疾病,其骨代谢紊乱,骨组织形态结构退化,骨小梁参数:BV/TV、Tb.N、Tb.Th和BMD等均显著下降[27,28]。人体研究发现,T2DM老年男性股骨颈和第3腰椎BMD下降,导致骨质疏松发生[8]。利用磁共振成像(Magnetic Resonance Imaging, MRI)对37名(平均年龄70.8岁)T2DM女性2年间胫骨远端松质骨骨小梁结构变化进行检测,发现BV/TV、Tb.Th、Tb.N等显著下降,导致骨质疏松发生[16]。无论动物还是人体研究均证实,T2DM骨代谢紊乱,导致骨组织形态结构退化及骨质疏松发生。本研究T2DM小鼠造模成功8周后,其股骨远端的松质骨BMD、BV/TV、BS/TV、Tb.Th和Tb.N等及皮质骨BMD、Tb.Th和BS/BV均显著下降,BS/BV和Tb.Sp显著升高,这与以上文献报道相一致。表明,本研究T2DM小鼠造模成功,另一方面,说明T2DM小鼠骨吸收超过骨形成,使得骨组织形态结构退化,而松质骨骨组织形态结构退化速度快于皮质骨,这与骨代谢发生变化时,先表现在松质骨有关[24]。
运动是改善T2DM骨代谢的重要手段。8周中等强度游泳显著提高T2DM大鼠股骨BMD和最大载荷等生物力学指标[4]。而8周跑台训练亦可提高T2DM大鼠BMD和骨生物力学性能[2]。人体研究证实,长时间、规律的体育锻炼显著提高T2DM患者(男/女性)股骨颈、Ward's三角等部位BMD,改善骨质疏松[10,13]。本研究发现,TD组松质骨BMD、BV/TV、Tb.Th、Tb.N等指标显著升高,皮质骨仅BV/TV、BS/BV和Tb.Th出现变化;而TS组松质骨和皮质骨的其他指标均无显著变化。提示,下坡跑显著改善T2DM小鼠骨组织形态结构,尤其是松质骨。这与下坡跑运动中,T2DM小鼠骨组织受到较大强度的地面反作用力(亦称直接力学刺激)有关[1],直接力学刺激促进成骨细胞分化及其骨形成能力,并抑制OC分化、融核及骨吸收能力[3],进而改善骨组织形态结构,并首先表现在松质骨上[24]。TS组松质骨和皮质骨的骨组织形态计量学指标均无显著变化,说明游泳对T2DM小鼠骨组织形态结构的改善作用不显著,这与赵剑等研究结果不一致。分析原因,与本研究游泳运动强度较小有关,强度较小的游泳运动对T2DM小鼠骨产生的力学刺激(即肌肉牵拉力)未能达到提高骨代谢的阈值,使得骨组织形态结构未显著改善。还可能与本研究中游泳训练时间较短有关。
3.2 游泳和下坡跑对T2DM小鼠BMM分化产生OC数量的影响
OC由BMM分化产生后,通过融核形成具有较强骨吸收能力的多核OC来主导骨吸收,并表达骨吸收生化标志物——TRAP[14]。T2DM小鼠BMM分化产生的OC和多核OC数量增多,骨吸收能力增强,导致骨质疏松发生[11]。本研究中,发现T2DM小鼠OC总数量和≥10个核OC数量显著增多。表明,T2DM促进小鼠BMM向OC分化、融核及其骨吸收能力,这与前人研究结果相一致。究其原因,T2DM可激活骨中骨保护素(Osteoprotegerin, OPG)/RANKL/核因子-κB受体活化因子(Receptor activator of nuclear factor-κB, RANK)分子轴,上调核转录因子κB(nuclear factor-κB, NF-κB)、c-Fos、NFATc1等靶基因表达,促进OC分化、融核及其骨吸收能力。并且,T2DM小鼠骨组织形态结构退化与分化产生的OC数量增加及其活性升高密切相关,OC会在骨基质Howship陷窝内形成酸性微环境,以吞噬泡形式降解骨质,使得松质骨和皮质骨形态结构退化[34]。
T2DM骨质疏松发生,与BMM分化产生的OC数量增加及骨吸收能力升高密切相关。运动训练作为改善骨组织形态结构的重要手段,其在抑制OC分化、融核及骨吸收能力上亦扮演关键角色[35]。但体育科学领域内,有关运动抑制T2DM小鼠BMM向OC分化及融核的相关研究尚待揭示。8周运动结束后,TD组OC总数量和≥10个核OC数量均显著下降,而TS组变化不显著。并且,TD组OC总数量显著低于TS组。说明下坡跑显著抑制T2DM小鼠OC分化产生、融核及骨吸收能力,而游泳效果不显著。这与下坡跑对T2DM小鼠骨产生的直接力学刺激可抑制其骨中OPG/ RANKL/RANK分子轴、IL-6和肿瘤坏死因子-α(Tumor necrosis factor-α, TNF-α)、NF-κB等激活或表达有关[30,31]。以上信号途径或细胞因子表达被抑制后,促进BMM向单核OC分化及单核OC融核形成具有较强骨吸收功能的多核OC[32]。游泳作用效果不显著,与其对T2DM小鼠骨产生的肌肉牵拉力强度较小,不能对BMM形成有效的力学刺激有关,从而抑制其向OC分化。然而,作为调控骨吸收代谢关键信号途径的CN/NFAT途径,其在调控OC分化及其骨吸收能力上具有重要调控作用。Ayse BC等[5]在研究间质液体剪切力和拉伸应变对骨细胞的影响时,发现这两种力学刺激均能抑制CN/NFAT途径激活。然而,目前有关运动抑制CN/NFAT途径,进而调控T2DM小鼠OC分化、融核及其骨吸收能力的相关研究尚待补充。
3.3 游泳和下坡跑对T2DM小鼠骨中CN/NFAT信号途径分子表达的影响
CN/NFAT是调控骨吸收的关键途径。TRAF6磷酸化后,活化Src1/3 (Src1起主要调控作用),并作用于PLC及IP3,促进胞内Ca2+浓度升高引起CN活化,激活NFATc1并迅速转移入核,调控OC前体细胞向OC分化及单核OC向多核OC融核,增强骨吸收[6]。T2DM小鼠分化产生的OC和多核OC数量显著增加,该过程受CN/NFAT途径调控,当其关键因子NFATc1激活后,促进BMM向OC分化及单核OC融核,使得骨吸收增强[18]。本研究显示,T2DM小鼠骨中TRAF6、Src3、CN和NFATc1的mRNA表达上调,IP3和Ca2+浓度升高,且关键因子Src1和NFATc1蛋白表达及骨吸收标志因子TRAP表达亦上调,这与前人研究结果相一致。提示,T2DM小鼠骨中CN/NFAT途径被激活,从而促进BMM向OC分化产生及融核,导致骨组织形态结构退化。
运动是改善T2DM骨代谢的重要手段,而目前相关研究集中在骨表型上。作为调控T2DM骨吸收的重要信号途径—CN/NFAT,运动影响T2DM小鼠骨中该途径表达的相关研究尚待揭示。本研究中,TD组小鼠骨中TRAF6、Src3、PLC、CN、NFATc1、TRAP的mRNA和Src1、NFATc1蛋白表达下调,IP3和Ca2+浓度下降。TS组TRAF6、PLC、CN、TRAP的mRNA和Src1蛋白表达及Ca2+浓度均下降,NFATc1 mRNA和蛋白表达不显著。而研究证实,NFATc1是评价CN/NFAT途径激活与否的关键靶基因,当其被激活后促进OC分化及其活性[25,33]。并且,与TS组相比,TD组TRAF6、Src3、PLC、TRAPmRNA和NFATc1蛋白表达及IP3和Ca2+浓度均低于TS组。表明,下坡跑抑制T2DM小鼠骨中CN/NFAT信号途径激活,而游泳却不能。证实,直接力学刺激改善T2DM骨吸收的作用效果优于间接力学刺激。直接力学刺激可抑制T2DM小鼠骨中OPG/RANKL/RANK分子轴,而TRAF6与RANK胞质区结合去磷酸化后抑制CN/NFAT途径激活[36]。再者与其抑制T2DM小鼠骨中Rho/蛋白激酶C1(Protein kinase C1, PKC1)信号通路和肌动蛋白聚合、肌球蛋白重链(Myosin heavy chain, MyHC)、骨形成蛋白-2(Bone morphogenetic protein 2, BMP-2)、白介素3(Interleukin 3, IL-3)和激活细胞表面糖蛋白147(Cell surface glycoprotein147, CD147)等有关[22,37]。以上信号途径或关键分子的抑制或激活均可抑制T2DM小鼠骨中钙调神经磷酸酶调节因子(Calcineurin-regulating factor, RCANs)与CN上由7个外显子编码的PxIxxT区域结合[29],进而抑制下游分子及靶基因NFATc1表达。而直接力学刺激激活Wnt5a与其膜上受体复合物结合后,可活化胞内散乱蛋白2(Dishevelled, DVL2),抑制CN及其下游NFATc1等基因表达[9,12]。
4 结论
T2DM小鼠骨吸收增强,导致骨质疏松发生;下坡跑通过抑制T2DM小鼠骨中CN/NFAT途径,导致OC及多核OC数量下降,骨吸收降低,进而改善骨组织形态结构,且其作用效果优于游泳对骨产生的间接作用力。
[1] 陈祥和, 李世昌, 严伟良, 等. 不同方式运动对生长期雄性小鼠骨形成和骨吸收代谢影响的研究[J]. 西安体育学院学报, 2015, 32(2):205-211.
[2] 高海宁, 王艳杰, 赵丹玉, 等. 2型糖尿病发病不同阶段的运动干预对大鼠骨代谢及骨髓瘦素和瘦素受体蛋白表达的影响[J]. 沈阳体育学院学报, 2015, 34(1):73-77.
[3] 马涛, 李世昌, 梁晓霞, 等. 上、下坡跑台运动对去卵巢小鼠骨密度及骨组织形态计量学指标的影响[J]. 体育科学, 2011, 31(1):48-55.
[4] 赵剑. 有氧运动对2型糖尿病大鼠骨密度和骨生物力学指标的影响[D]. 上海:上海体育学院, 2010.
[5] AYSE B C, HIROSHI M, THOMAS R G,Nuclear factor of activated T cells mediates fluid shear stress-and tensile strain-induced Cox2 in human and murine bone cells [J]. Bone, 2010, 46(1): 167.
[6] ASAGIRI M, TAKAYANAGI H.The molecular understanding of osteoclast differentiation [J]. Bone, 2007, 40(2):251-264.
[7] BELLO M, SOUSA MC, NETO G,. The effect of a long-term, community- based exercise program on bone mineral density in postmenopausalwomen with pre- diabetes and type 2 diabetes [J]. J Hum Kinet, 2014, 43(13):43-48.
[8] B.SIDDHARTHA K, RAVISANKAR A, ALLADI M,Effect of oral hypoglycaemic agents on bone metabolism in patie-nts with type 2 diabetes mellitus & occurrence of osteoporosis [J]. Indian J Med Res, 2015, 141(90): 431-437.
[9] CHATTOPADHYAY S, CHATTERJEE R, LAW S. Noncanoni-cal Wnt5a- Ca(2+) -NFAT signaling axis in pesticide induced bone marrow aplasia mouse model: A study to explore the novel mechanism of pesticide toxicity[J]. Environ Toxicol,2016,31(10): 1163-1175.
[10] DE LUIS R D, ALLER R, PEREZ C J,. Effects of dietary intake and life style on bone density in patients with diabetes mellitus type 2[J]. Ann Nutr Metab, 2004, 48(3):141-145.
[11] ERJAVEC I, BORDUKALO-NIKSIC T, BRKLJACIC J,. Constitutively elevated blood serotonin is associated with bone loss and type 2 diabetes in rats[J]. PLoS One, 2016, 11(2):e0150102.
[12] FROMIGUÉ O, HAŸ E, BARBARA A,Essential role of nuclear factor of activated T cells (NFAT)-mediated Wnt signal-ing in osteoblast differentiation induced by strontium ranelate[J]. J Biol Chem, 2010, 285(33):25251-25258.
[13] GUSHIKEN M, KOMIYA I, UEDA S,Heel bone strength is related to lifestyle factors in Okinawan men with type 2 diabetes mellitus[J]. J Diabetes Investig, 2015, 6(2):150-157.
[14] HYEON S, LEE H, YANG Y,. Nrf2 deficiency induces oxidative stress and promotes RANKL-induced osteoclast differe-ntiation[J]. Free Radic Biol Med, 2013, 65(11):789-799.
[15] JEYABALAN J, VIOLLET B, SMITHAM P,The anti-diabetic drug metformin does not affect bone mass in vivo or fracture healing[J]. Osteoporos Int, 2013, 24(10): 2659-2670.
[16] JANET M P, LORA M G,STEPHANIE A A,Changes in trabecular bone microarchitecture in postmenopausal women with and without type 2 diabetes: a two year longitudinal study [J]. BMC Musculoskelet Disord, 2013,14(5): 114.
[17] KANAZAWA I, YAMAGUCHI T, YAMAUCHI M,. Serum under- carboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus [J]. Osteoporos Int, 2011, 22(1):187-194.
[18] KAMIO N, KAWATO T, TANABE N,.Vaspin attenuates RANKL-induced osteoclast formation in RAW264.7 cells[J]. Connect Tissue Res, 2013, 54(2):147-152.
[19] LOPES L S, SCHWARTZ R P, FERRAZ-DE-SOUZA B,The role of enteric hormone GLP-2 in the response of bone markers to a mixed meal in postmenopausal women with type 2 diabetes mellitus[J]. Diabetol Metab Syndr, 2015, 7(2):13-18.
[20] LI X, HE L, HU Y,. Sinomenine suppresses osteoclast formation and Mycobacterium tuberculosis H37Ra-induced bone loss by modulating RANKL signaling pathways [J]. PLoS One, 2013, 8(9):e74274.
[21] LUO J, YANG Z, MA Y,LGR4 is a receptor for RANKL and negatively regulates osteoclast differentiation and bone resorption [J]. Nat Med, 2016, 22(5): 539 -546.
[22] LOMONOSOVA Y N, TURTIKOVA O V, SHENKMAN B S.Reduced expression of MyHC slow isoform in rat soleus during unloading is accompanied by alterations of endogenous inhibitors of calcineurin/NFAT signaling pathway[J]. J Muscle Res Cell Motil, 2015, 37(1-2):7-16.
[23] MARILINA P, MELDA O, JINHU X,Suppression of autophagy in osteocytes does not modify the adverse effects of glucocorticoids on cortical bone [J]. Bone, 2015, 75(6):18-26.
[24] NEUMANN AJ, GARDNER OF, WILLIAMS R,. Human articular cartilage progenitor cells are responsive to mechanical stimulation and adenoviral-mediated over-expression of bone morphogenetic protein 2[J].PLoS One,2015,10(8): e0136229.
[25] NATSUKO T, BENJAMIN D W, JIYUN K,Osteopontin signals through calcium and nuclear factor of activated T cells (NFAT) in osteoclasts [J]. J Biol Chem, 2011, 286(46): 39871-39881.
[26] OCHIAI M, KURODA T, GOHTANI S,Dietary protein derived from dried bonito fish improves type 2 diabetes mellitus-induced bone frailty in to Goto- Kakizaki rats [J]. J Food Sci, 2015, 80(4):848-856.
[27] PEREZ-CASTRILLON J L, RIANCHO J A, DE LUIS D,. The deleterious effect of bariatric surgery on cortical and trabecular bone density in the femurs of non-obese, type 2 diabetic Goto-Kakizaki rats[J]. Obes Surg, 2012,22(11):1755-1760.
[28] QIAN C, ZHU C, YU W,. High-fat diet/low-dose streptozotocin-induced type 2 diabetes in rats impacts osteogene-sis and Wnt signaling in bone marrow stromal cells [J]. PLoS One, 2015, 10(8):e136390.
[29] RAO A. Signaling to gene expression: calcium, calcineurin and NFAT [J]. Nat Immunol, 2009, 10(1):3-5.
[30] TROIB A, GUTERMAN M, RABKIN R,. Endurance exercise and growth hormone improve bone formation in young and growth-retarded chronic kidney disease[J]. Nephrol Dial Transplant, 2015, Epub ahead of print.
[31] WANG QS, ZHANG XC, LI RX,. A comparative study of mechanical strain, icariin and combination stimulations on impro-ving osteoinductive potential via NF-kappaB activation in osteobl-ast-like cells[J]. Biomed Eng Online, 2015, 14(2): 46.
[32] XIE W, LORENZ S, DOLDER S,Extracellular iron is a modulator of the differentiation of osteoclast lineage cells[J]. Calcif Tissue Int, 2015, 15(3):25-31.
[33] YARILINA A, XU K, CHEN J,. TNF activates calcium-nuclear factor of activated T cells (NFAT)c1 signaling pathways in human macrophages[J]. Proc Natl Acad Sci U S A, 2011,108(4):1573-1578.
[34] YUUKI I, YOUN MY, KAZUKI I,Nuclear receptors in bone physiology and diseases [J]. Physiol Rev, 2013, 93(2): 481-488.
[35] ZHANG M,SHINTARO I,TOMOKO I,Influence of mechanical force on bone matrix proteins in ovariectomised mice and osteoblast-like MC3T3-E1 cells [J]. Vivo, 2017, 31(1):87-96.
[36] ZHOU L, LIU Q, YANG M,Dihydroartemisinin, an anti-malaria drug, suppresses estrogen deficiency-induced osteoporo-sis,osteoclast formation, and RANKL-induced signaling pathways[J]. J Bone Miner Res, 2016, 31(5):964-974.
[37] ZHANG M, SARA JD, WANG FL,. Increased plasma BMP-2 levels are associated with atherosclerosis burden and coronary calcification in type 2 diabetic patients[J]. Cardiovasc Diabetol, 2015, 14(7):64-69.
Effects of Swimming and Downhill Running on Bone Absorption Metabolism in Type 2 Diabetic Mice via CN/NFAT Signal Pathway
CHEN Xiang-he1, LI Shi-chang2, SUN Peng2, CHEN Ai-guo1, MA Tao3, MOU Qi-lin4
1.Yangzhou University, Yangzhou 225127, China; 2. East China Normal University, Shanghai 200241, China; 3. Qilu Normal University, Jinan 250200, China; 4.Guiyang University, Guiyang 550000, China.
Objective: The purpose of this study was to explore the effect of swimming and downhill running on bone resorption and metabolism in T2DM mice through calcineurin (CN)/activated T-cell nuclear factor (NFAT) pathway. Methods: Six-week high-fat diet and one-time injection of streptozotocin (STZ) were used to make T2DM models. After it, the mice were randomly divided into T2DM control group (TC), T2DM swimming group (TS) and T2DM downhill running group ( TD), C57 mice were selected as normal control group (ZC). T2DM mice continued to have a high-fat diet and mice of ZC group were fed normal diets. The mice of TS and TD group were trained for 8 weeks swimming and downhill running. After 24 hours of the last training, the mice were sacrificed and each bone samples were harvested. Microscopy, primary cell culture, ELISA, RT-PCR, and West-blotting techniques were used to measure bone histomorphometry, OC number, ion concentration , mRNA and protein expression of cytokine were detected. Results: The expressions of TRAF6, CN, Src-3, PLC, NFATc1, TRAP mRNA and Src1, NFATc1 protein were up-regulated in TC group (<0.05), and the concentrations of IP3 and Ca2+were increased (<0.05). The total number of OC and the number of ≥10 nuclear OCs were increased (<0.01). Histological indicators of cancellous bone and cortical bone were significantly decreased (<0.05). Compared with TC, the expression of TRAF6, CN, PLC, TRAP mRNA and Src1 protein in TS group were down-regulated, and Ca2+concentration was also decreased (<0.05 or<0.01). The expression of TRAF6, CN, Src-3, PLC, NFATc1, TRAP mRNA and Src1, NFATc1 protein were down-regulated in the TD group, and the IP3 and Ca2+ concentrations were also decreased (<0.05). The total number of OC and ≥10 nuclear OC were significantly decreased (<0.05), and histomorphometric indexes of cancellous bone and cortical bone were significantly improved (<0.05). Compared with TS, the expression of TRAF6, Src-3, PLC, TRAP mRNA were down-regulated and the concentration of IP3 and Ca2+ were decreased (<0.05). The total number of OC decreased (<0.05) and the BS/TV of cancellous bone were increased (<0.05). Conclusion: The bone resorption of T2DM mice was enhanced. Downhill running inhibited the CN/NFAT pathway in bone of T2DM mice, reduced the number of OC, decreased the bone resorption, and improved the morphological structure of bone, and its effect was better than swimming.
G804.5
A
1002-9826(2018)04-0113-07
10.16470/j.csst.201804013
2017-07-21;
2018-06-06
江苏省高等学校自然科学研究面上项目(17KJB180017)。
陈祥和,男,讲师,博士,主要研究方向为运动与骨适应的机制, E-mail:huashixh@163.com。

