血清类黏蛋白1样蛋白3基因单核苷酸多态性与儿童肺炎支原体感染相关哮喘的相关性
袭学芹, 毕玉娜, 谷亚星, 王金荣*
1. 山东省妇幼保健院小儿呼吸科,济南 250014 2. 山东省立第三医院小儿呼吸科,济南 250031 3. 山东大学附属省立医院儿科呼吸综合科,济南 250021
支气管哮喘是一种呼吸系统频发的异质性疾病,多在凌晨发作和(或)夜间加剧。哮喘的临床表现主要为反复发作的喘息、咳嗽、气促和胸闷,以慢性炎性反应和气道高反应性为特征。呼吸道症状的严重程度和具体表现形式随时间而变化,可伴有可变的呼气气流受限[1]。1970年,Berkovich等[2]首次报道,支原体肺炎(mycoplasma pneumoniae,MP)与哮喘患儿喘息发作有直接联系。近年来关于哮喘病因学的研究逐渐增多。有学者提出,MP感染为哮喘急性发作的重要诱发因素,并且是小儿哮喘迁延不愈、反复发作的主要独立危险因素。
另外,目前认为哮喘是一种多基因遗传病,是由环境因素和遗传因素相互作用而形成的。研究[3]证实,人血清类黏蛋白1样蛋白3(orosomucoid 1-like protein 3,ORMDL3)基因多态性与哮喘密切相关。ORMDL3基因位于17号染色体上,有3个外显子和2个内含子,编码1个位于内质网膜的跨膜蛋白,可以调节Ca2+浓度,从而导致未折叠蛋白反应,进而成为炎性反应发生的内源性诱因。为探讨ORMDL3基因单核苷酸多态性与儿童MP感染相关哮喘的相关性,本研究选取ORMDL3基因的rs4794820和rs7216389这2个位点进行基因型分析,比较各基因型在MP哮喘组与MP非哮喘组的分布差异,以期为儿童MP感染相关哮喘的早期识别和干预治疗提供新的思路。
1 资料与方法
1.1 一般资料 选取2015年1月至2015年12月山东大学附属省立医院儿科诊治的200例MP住院患儿。随访观察1年以上,失访6例,最后纳入194例MP住院患儿为研究对象。所有入组患儿的治疗及临床资料使用均取得监护人同意,并由其签署知情同意书。根据我国2008年《儿童支气管哮喘诊断与防治指南》[4]及《2015年全球哮喘防治创议》[5]关于儿童哮喘的诊断标准,将有反复或持续咳嗽和(或)喘息的患儿分为MP哮喘组,无上述表现的患儿为MP非哮喘组。收集所选患儿的血清免疫球蛋白E(immunoglobulin E,IgE)水平等资料。所有入选患儿均按照操作规范,测量身高、体质量,并进行体格检查。
入选标准:(1)年龄3~12岁;(2)已于院外或入院后确诊为MP,诊断标准符合中华医学会儿科学分会呼吸学组2013年修订的《儿童社区获得性肺炎管理指南》[6]和2015年《儿童肺炎支原体肺炎诊治专家共识》[7]中MP的诊断标准;(3)患儿或监护人能正确理解研究内容,并能清楚描述患儿发病情况。排除标准:(1)3代直系亲属中有其他遗传性疾病者;(2)存在先天性支气管或肺发育异常、支气管扩张、气管内阻塞或气管外压迫、肺结核或先天性心脏病;(3)既往1年内有反复或持续咳嗽及喘息表现;(4)近期合并其他病原体引发的呼吸道感染者;(5)无法取得家长的知情同意者。
1.2 哮喘易感基因ORMDL3 rs4794820、rs7216389基因型检测 所选儿童均于入院当天治疗前留取外周静脉血3 mL,采用天根自动核酸提取仪(TGuide S32 Nucleic Acid Extractor)提取目的基因ORMDL3。根据ORMDL3基因中哮喘易感的2个位点(rs4794820、rs7216389)序列设计引物。
rs4794820引物序列ASP1:5′-AGG AAG GAA GGA AGA AAG ACA G-3′,ASP2:5′-AGG AAG GAA GGA AGA AAG ACA A-3′,产物大小260 bp。rs7216389引物序列ASP1:5′-GCA ACC CTG GAA AGT CAC AAA CAT-3′,ASP2:5′-GCA ACC CTG GAA AGT CAC AAA CAC-3′,产物大小150 bp。
应用Bio-MarkTM96.96动态陈列集成流体通路(integrated fluidic circuit,IFC)Juno系统对哮喘易感基因ORMDL3的rs4794820、rs7216389基因型进行检测。检测结果用Fluidigm SNP Genotyping Analysis软件分析。
1.3 血清IgE水平检测 清晨空腹采集静脉血2 mL,采用双抗体夹心酶联免疫吸附实验(ELISA)测定血清IgE水平。ELISA试剂盒为北京欧蒙生物技术有限公司产品,操作过程由检验科医师严格按照说明书进行。
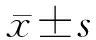
2 结 果
2.1 一般资料的比较 194例患儿中,男性136例(70.1%),女性58例(29.9%),男女比例为2.3∶1。MP哮喘组患儿63例(32.5%),其中,男性患儿45例(71.4%),女性患儿18例(28.6%),男女患儿比例为2.5∶1。MP非哮喘组患儿131例(67.5%),其中,男性患儿91例(69.5%),女性患儿40例(30.5%),男女患儿比例为2.3∶1。MP哮喘组平均年龄(6.43±1.82)岁,MP非哮喘组平均年龄为(6.13±2.09)岁,两组年龄构成分布差异无统计学意义。
2.2 MP哮喘与ORMDL3基因rs4794820位点基因型分布的关系 结果(表1)表明:在ORMDL3基因的rs4794820位点有 AG、GG、AA共3种基因型,MP哮喘组和MP非哮喘组在此位点均以纯合子GG基因型的分布频率最高、纯合子AA分布频率最低;两组在此位点的基因型差异均有统计学意义(P<0.05)。MP哮喘组GG纯合子基因型和G等位基因频率均明显高于MP非哮喘组,但MP非哮喘组AA纯合子基因型和A等位基因频率明显高于MP哮喘组;两组此位点的等位基因差异均有统计学意义(P<0.05)。
2.3 MP哮喘与ORMDL3基因 rs7216389位点基因型分布的关系 结果(表2)表明:ORMDL3基因的rs7216389位点有TT、TC、CC 共3种基因型,MP哮喘组和MP非哮喘组在此位点均以纯合子TT基因型的分布频率最高、纯合子CC分布频率最低;两组在此位点的基因型分布差异有统计学意义(P=0.002)。MP哮喘组的TT纯合子基因型和T等位基因频率明显均高于MP非哮喘组(P<0.05);MP非哮喘组CC纯合子基因型和C等位基因频率明显高于MP哮喘组。两组此位点等位基因差异均有统计学意义(P<0.05)。

表1 MP哮喘组和非哮喘组患儿ORMDL3基因rs4794820位点的基因型分布 n(%)
*P<0.05与MP非哮喘组相比

表2 MP哮喘组和非哮喘组患儿ORMDL3基因rs7216389位点的基因型分布 n(%)
*P<0.05与MP非哮喘组相比
2.4 rs4794820 GG基因型和rs7216389 TT基因型的MP哮喘危险度分析 结果(表3)表明:MP哮喘组在哮喘易感基因ORMDL3的rs4794820位点GG基因型分布频率(60.3%)明显高于AG+AA基因型(39.7%),在rs7216389位点 TT基因型(65.1%)明显高于TC+CC基因型(34.9%);MP非哮喘组在ORMDL3的rs4794820位点GG基因型分布频率(42.7%)低于AG+AA基因型(57.3%),在rs7216389位点 TT基因型(45.0%)低于TC+CC基因型(55.0%)。MP哮喘组哮喘易感基因ORMDL3的rs4794820位点GG基因型分布频率(60.3%)和rs7216389位点 TT基因型分布频率(65.1%)均明显高于MP非哮喘组,两基因型均为MP哮喘发生的危险因素(P=0.022,P=0.009)。
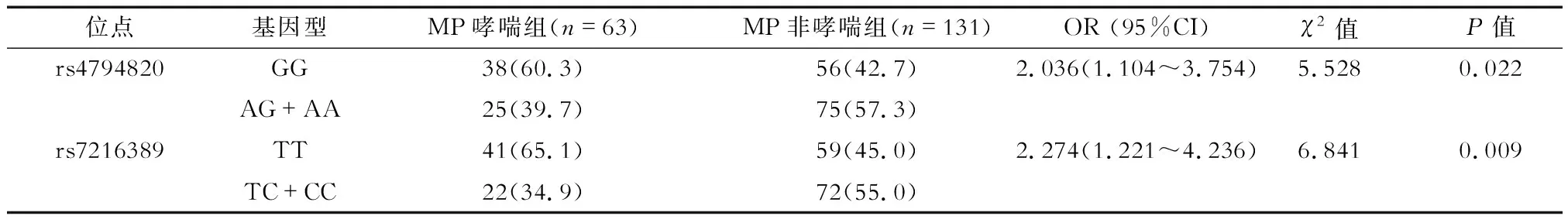
表3 哮喘易感基因ORMDL3 rs4794820 GG基因型和rs7216389 TT基因型的危险度分析 n(%)
2.5 MP哮喘与血清IgE水平的关系 ELISA结果显示:63例MP哮喘组患儿血清IgE水平升高者18例(28.6%),131例MP非哮喘组患儿中19例血清IgE水平升高(14.5%),两组间差异有统计学意义(χ2=5.188,P=0.023)。
3 讨 论
目前,我国儿童哮喘的总体控制水平尚不理想,其发病率在近年来不断升高,给家庭及社会带来了沉重负担,也严重损害着儿童身心健康。哮喘是一种多基因遗传疾病,遗传度高达80%,具有明显的家族倾向性,其发病与遗传易感性和环境暴露的相互作用有关[8-9]。Ober等[10]的荟萃性分析结果发现,共有118个基因与哮喘或变应性疾病相关。有学者利用全基因组关联性研究[3]分析发现,ORMDL3 基因是儿童哮喘的潜在候选基因。
MP是一种通过黏附及细胞毒效应对呼吸道上皮细胞形成直接损伤,也通过免疫机制引起肺部感染及肺外系统损伤的细胞外病原体[11],可引起咽炎、支气管炎和肺炎,诱发和加重哮喘[12]。目前,对于小儿MP有无性别差异,相关报道结论不一,考虑与不同地区男女患儿的构成比差异较大有关。本研究纳入的194例MP患儿中,男性患儿约为女性患儿的2.3倍,提示在本研究病例中男性MP感染阳性率高于女性。已有文献显示,哮喘初发患者中,MP阳性率为50%以上,复发患者中约为20%,而哮喘急性发作期的MP阳性率为34.0%[13]。王晔等[14]研究发现,哮喘患儿的MP阳性率为48.8%,以学龄期儿童最高(达57.6%)。本研究显示,MP哮喘组的MP阳性率约为32.5%,比文献统计数据值偏低。这可能与本次研究选取患儿的病情较重,而一些病情较轻或症状不典型的患儿未纳入研究有关。
2007年,Nature首次报道ORMDL3基因单核苷酸多态性控制的遗传变异与哮喘发作高度相关[15],携带该基因遗传变异的儿童患哮喘的风险增加60%~70%。目前ORMDL3基因作为哮喘易感基因的相关机制研究正在进行中。有研究[15]显示,ORMDL3基因参与哮喘发病,推测ORMDL3能结合肌质网,抑制其三磷酸腺苷酶(adenosine triphosphatase,ATP)活性,进而降低内质网中的ATP浓度,促进非折叠蛋白中激活转录因子6(activating transcription factor 6,ATF6)通路,活化的ATF6 通路促进肌质网钙泵的表达,进而促进炎性反应,引起气道高反应性,使患儿对哮喘的易感性增加,引发哮喘。之后有研究提出,ORMDL3蛋白有3种异构体[16],是丝氨酸棕榈酰转移酶(serine palmitoyl transferase, SPT)的抑制剂,可作为鞘脂合成的限速酶,通过SPT抑制鞘脂的合成,调节机体内神经酰胺的产生,发挥负性调节作用;并且其可以独立于过敏或炎性反应。
目前,ORMDL3基因的单核苷酸多态性位点rs4794820、rs7216389已经被广泛研究。其中,rs4794820参与上皮细胞炎性反应和气道反应性的调节;rs7216389则因其碱基由C改变为T,影响了ORMDL3基因的表达,从而在哮喘的发病过程中发挥重要作用。韩国儿童中,rs4794820位点基因型为AG和AA的哮喘患儿相较于GG基因型的患儿,肺功能损害较低,嗜酸性粒细胞水平也更低[17]。Tavendale等[18]研究发现,苏格兰儿童中rs7216389位点为TC基因型的群体有发展为持续性哮喘的高危险性。本研究发现,rs4794820位点GG基因型和G等位基因在MP哮喘组的分布频率明显高于MP非哮喘组,而rs7216389位点TT基因型和T等位基因在MP哮喘组的分布频率明显高于MP非哮喘组;在基因型危险度分析中,rs4794820位点GG基因型和rs7216389位点TT基因型均是儿童MP相关哮喘的危险因素,而rs4794820位点AA基因型和rs7216389位点CC基因型则可能是儿童MP感染相关哮喘的保护因素。
IgE属于免疫球蛋白,可诱发Ⅰ型变态反应,导致患儿出现可逆的气管阻塞,诱导哮喘发作。多项研究显示,MP感染后可导致IgE水平升高;IgE既可以是感染源,也可以是特异的过敏原[19]。MP感染患儿具有更高水平的促炎细胞因子,总IgE水平升高[20]。MP引起的呼吸道炎性反应和Th2细胞因子反应增加导致T淋巴细胞免疫功能失常,Th1/Th2比例降低。这是形成哮喘的启动因素,并在哮喘发展中成为维持因素,提示MP可诱发和加重哮喘。本研究显示,MP哮喘组患儿血清IgE水平升高的比例高于MP非哮喘组,提示MP感染后IgE水平升高是支气管哮喘患儿发病的重要危险因素,需要在临床工作中引起重视,早期识别,以避免哮喘的发生。
综上所述,MP相关哮喘患儿的病例对照研究发现,MP相关哮喘的发病率升高,而且ORMDL3基因rs4794820位点GG纯合子基因型和rs7216389位点TT纯合子基因型是儿童MP感染相关哮喘的易感基因型,rs4794820位点AA基因型和rs7216389位点CC基因型可能是其保护基因型;MP感染后血清IgE水平升高,是MP感染相关哮喘的潜在危险因素。

