GA3浸种对露蕊乌头种子破眠及萌发生理特性的影响
马文静, 赵 颖, 魏小红, 曹 丽
(甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
露蕊乌头(Aconitumgymnandrum)是毛茛科乌头属露蕊乌头亚属的唯一物种[1],海拔2 000 m以上的高山地区均有分布,尤其是在弃耕地或退化草地中经常有较大居群[2]。一方面露蕊乌头具有重要的药用价值,露蕊乌头与川乌、草乌等名贵中药材亲缘关系接近,其叶、花和根皆可入药,具祛风镇静、驱虫杀蛆的功效,也可用于治疗关节疼痛、风湿等病症[3]。另一方面露蕊乌头的花颜色鲜艳,也具有一定的观赏价值。但多年来对露蕊乌头系统的研究和开发利用一直很少,因此研究露蕊乌头具有重要的现实意义。
在种子休眠和萌发过程中,激素占据重要的位置,他们能通过信号传导对种子内各种生理变化做出反应,调节一系列蛋白质、酶的代谢,从而调控种子的休眠和萌发[4]。赤霉素(gibberellin acid, GA3)能显著促进种子的萌发,GA3在促进种子萌发中至少起到两种作用:一是软化种胚周围的组织,克服种皮机械限制;二是促进种胚的生长[5-6]。研究发现GA3能显著提高白背紫斑杜鹃和三花杜鹃的发芽率(germination percentage, GP),发芽势( germination energy, GE)以及发芽指数(germination index, GI)[7],GA3能够促进流动沙丘先锋植物沙米种子的萌发[8]。此外,王立辉等人研究船盔乌头种子萌发的适宜温度为15℃~25℃,最适温度为25℃[9]。用200、600、1 000 mg·L-1的GA3浸种处理12 h可使短尾越橘的发芽率分别提高到60%、65%和64%[10]。用100、250、500 mg·L-1的GA3浸种处理可极显著提高乌饭树种子的发芽率,发芽势及活力指数(vigor index, VI)[11]。综上所述,本研究细化GA3浓度设置:0、125、250、500、750、1 000、1 500 mg·L-1GA3,设置了18℃(12 h)、25℃(12 h)变温培养,探究不同浓度 GA3浸种处理对露蕊乌头种子萌发的影响。
种子萌发是植物建苗的关键阶段。露蕊乌头种子的萌发率极低,严重限制了露蕊乌头的开发利用[12]。目前外源GA3已广泛应用于促进种子萌发,但是使用外源GA3促进露蕊乌头种子萌发方面的研究尚未见报道。本试验通过外源GA3处理露蕊乌头种子对萌发期的碳水化合物含量、水解酶及抗氧化酶活性动态变化进行研究,探讨露蕊乌头种子萌发的最佳培养条件及GA3浓度,明晰外源GA3促进露蕊乌头种子萌发的生理机制,旨在为破除露蕊乌头种子休眠及其人工栽培提供理论基础和技术支撑。
1 材料与方法
1.1 试验材料与处理
试验材料为露蕊乌头种子,采于海拔2 960~2 970 m的甘肃省天祝草原(东经102°84′, 北纬37°24′)。在露蕊乌头的植株上直接采集,后将种子风干,人工去掉果壳,在低温、干燥的环境下保存,备用。
本试验挑选大小一致、饱满的露蕊乌头种子,先用5%的次氯酸钠溶液消毒灭菌5~10 min,然后用蒸馏水冲洗3~5次。将露蕊乌头种子在0、125、250、500、750、1 000、1 500 mg·L-1GA3溶液中浸泡24 h,然后置于垫有两层滤纸的培养皿中(φ=9 cm),每皿放置100粒,每个处理重复6次。将所有培养皿分别置于A:光照强度3 000 Lx,培养温度25℃(12 h)/18℃(12 h),B:完全黑暗,培养温度25℃(12 h)/18℃(12 h)两个条件下培养[13],共培养8 d。以种子露白作为萌发标志,每天记录各皿中发芽的种子数,共统计8 d。试验结束后计算发芽率,发芽势,发芽指数和活力指数,分别于第1,3,6天测定相关生理指标。
1.2 测定指标与方法
1.2.1种子发芽指标 发芽率(GP)= 8 d内发芽种子数/供试种子数×100%[14]
发芽势(GE) = 5 d内发芽的种子粒数/供发芽种子粒数×100%[15-16]
发芽指数(GI)= ∑(Gt/Dt)。其中Gt为8 d的发芽数,Dt为发芽日[17]
活力指数(VI) = 发芽指数×幼苗平均鲜重[18]
1.2.2生理指标测定 可溶性糖含量采用蒽酮比色法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定;α-淀粉酶活力采用3,5-二硝基水杨酸法测定;蛋白酶活性采用酪氨酸法测定;脂肪酶活性采用底物乳化法测定;超氧化物歧化酶(superoxide dismutase, SOD)采用NBT显色法测定;过氧化物酶(peroxidase, POD)采用愈创木酚氧化法测定;过氧化氢酶(catalase, CAT)采用紫外吸收法测定[19]。
1.3 数据分析
试验结果数据均重复3次,数据采用Microsoft Excel 2003和SPSS 18.0软件进行数据分析和图表绘制,用Duncan进行多重比较分析差异显著。
2 结果与分析
2.1 光照及黑暗条件下GA3浸种对露蕊乌头种子萌发的影响
由表1和2可知,在光照和黑暗条件下,在0~1 000 mg·L-1GA3范围内,随着GA3浓度的升高,露蕊乌头种子的发芽率(GP)、发芽势(GE)、发芽指数(GI)、活力指数(VI)呈现逐渐升高的变化趋势。当GA3浓度为1 000 mg· L-1时发芽率达到最大值,分别为91.66%和95.67%。与光照相比,黑暗处理下露蕊乌头种子的发芽率、发芽势、发芽指数和活力指数分别提高4.37%,72.19%,26.58%和32.60%。综上,黑暗条件下1 000 mg·L-1GA3浸种是促进露蕊乌头种子萌发的最佳条件。

表1 GA3溶液浸种对露蕊乌头种子在光照条件下萌发率的影响Table 1 Effects of GA3 on seed germinations of Aconitum gymnandrum in illumination
注:同列不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)
Note: The data indicates mean ±SD. Different capital letters indicate significant difference at the 0.01 level, and different lowercase letters indicate significant difference at the 0.05 level
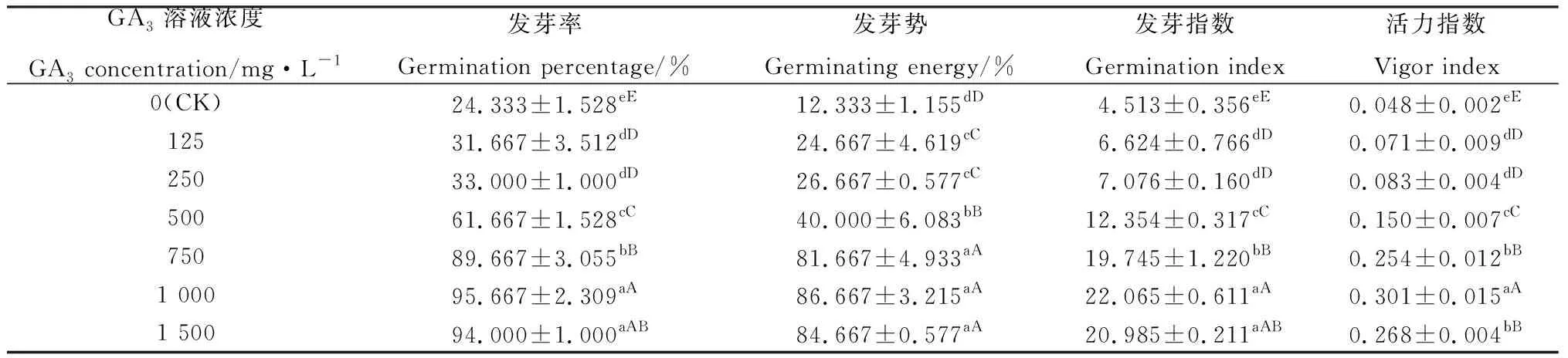
表2 GA3溶液浸种对露蕊乌头种子在黑暗条件下萌发率的影响Table 2 Effects of GA3 on seed germination s of Aconitum gymnandrum in dark
2.2 黑暗条件下1 000 mg·L-1 GA3浸种处理对露蕊乌头种子萌发中主要物质及相关酶的影响
2.2.1浓度为1 000 mg·L-1GA3浸种处理对露蕊乌头种子可溶性糖、可溶性蛋白的影响 由图1可知,萌发第1天,GA3处理与对照种子的可溶性糖含量没有显著差异(P<0.05),与对照相比,萌发第3、6天,GA3处理下种子内可溶性糖含量分别下降11.53%,33.33%。
由图2可知,与CK处理相比,萌发第1、3天,1 000 mg·L-1GA3处理露蕊乌头种子内可溶性蛋白含量均无显著变化(P<0.05)。萌发第6天,1 000 mg·L-1GA3处理的种子的可溶性蛋白含量比对照提高28.30%。1 000 mg·L-1GA3处理与CK处理种子内可溶性蛋白含量均在第6天达到最大值,相比第3天分别提高了78.95%和53.18%。
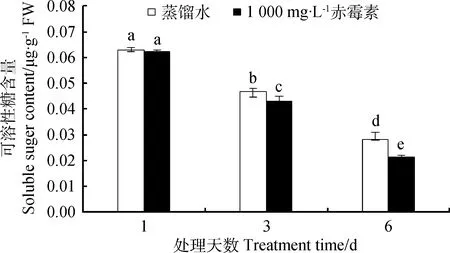
图1 GA3溶液浸种对露蕊乌头种子萌发过程中可溶性糖含量的影响Fig.1 Influences of GA3 on soluble sugar contents in the process of Aconitum gymnandrum seed germination
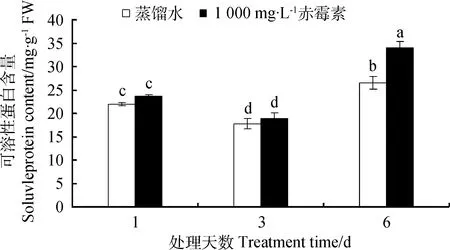
图2 GA3溶液浸种对露蕊乌头种子萌发过程中可溶性蛋白质含量的影响Fig.2 Influences of GA3 on soluble protein contents in the process of Aconitum gymnandrum seed germination
2.2.2浓度为1000mg·L-1GA3浸种处理对露蕊乌头种子α-淀粉酶、蛋白酶、脂肪酶活性的影响 由图3可知,与CK处理相比,萌发第1、3、6天,1 000 mg·L-1GA3处理下露蕊乌头种子α-淀粉酶活性分别提高了4.47%、30.56%、7.30%。在萌发过程中,对照组种子内α-淀粉酶活性无显著变化(P<0.05),而GA3处理组α-淀粉酶活性在第3天达到最大值,并且在萌发过程中α-淀粉酶活性均保持在较高水平。
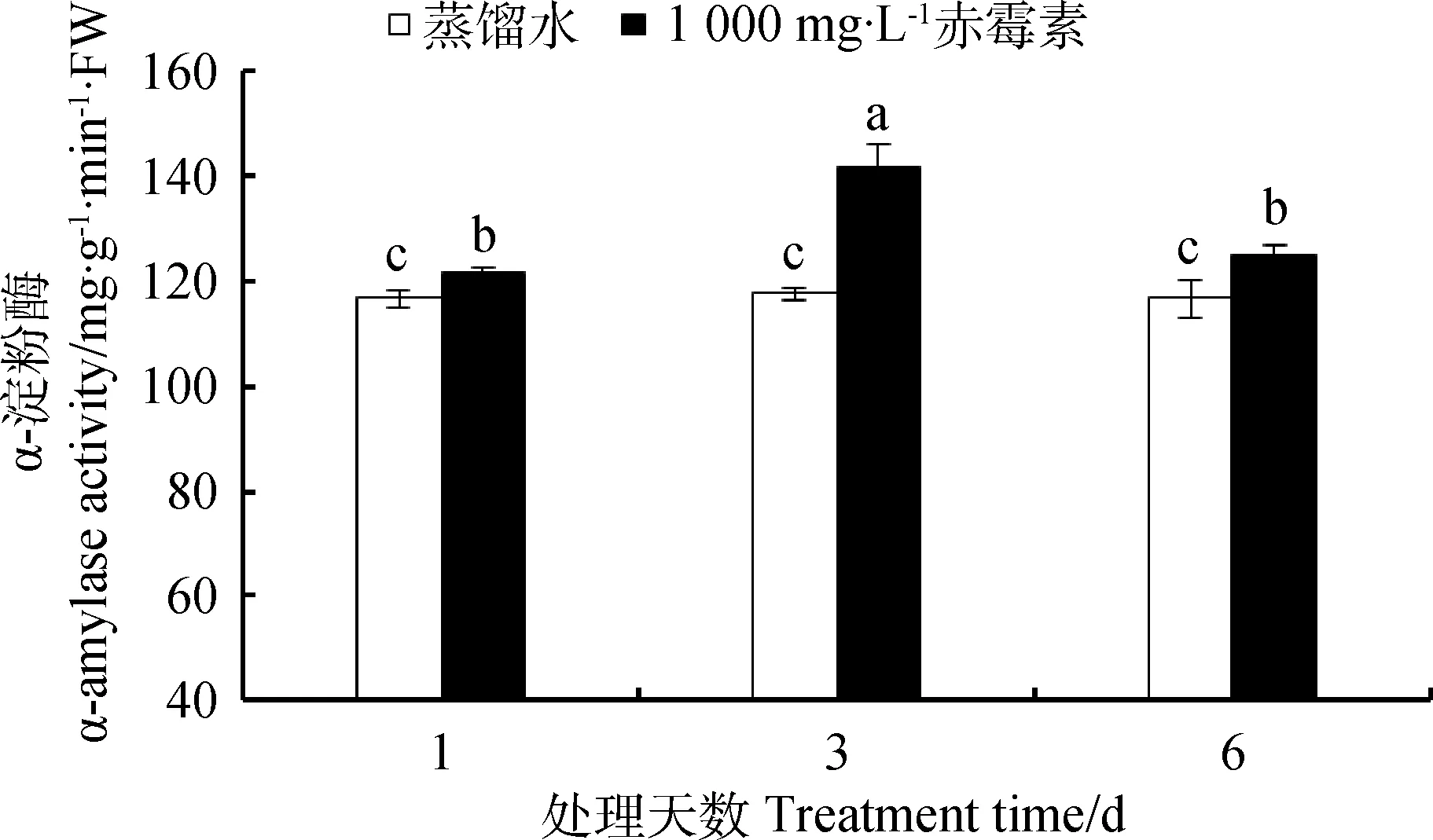
图3 GA3溶液浸种对露蕊乌头种子萌发过程中α-淀粉酶活性的影响Fig.3 Influences of GA3 on α-amylase activity in the process of Aconitum gymnandrum seed germination
如图4所示,在萌发过程中,用GA3处理的露蕊乌头种子内蛋白酶活性始终高于CK处理。萌发第1天,与CK相比,1 000 mg·L-1GA3处理种子中蛋白酶活性无显著变化(P<0.05)。萌发第3、6天,GA3处理露蕊乌头种子内蛋白酶活性分别比CK提高了48.78%,70%。
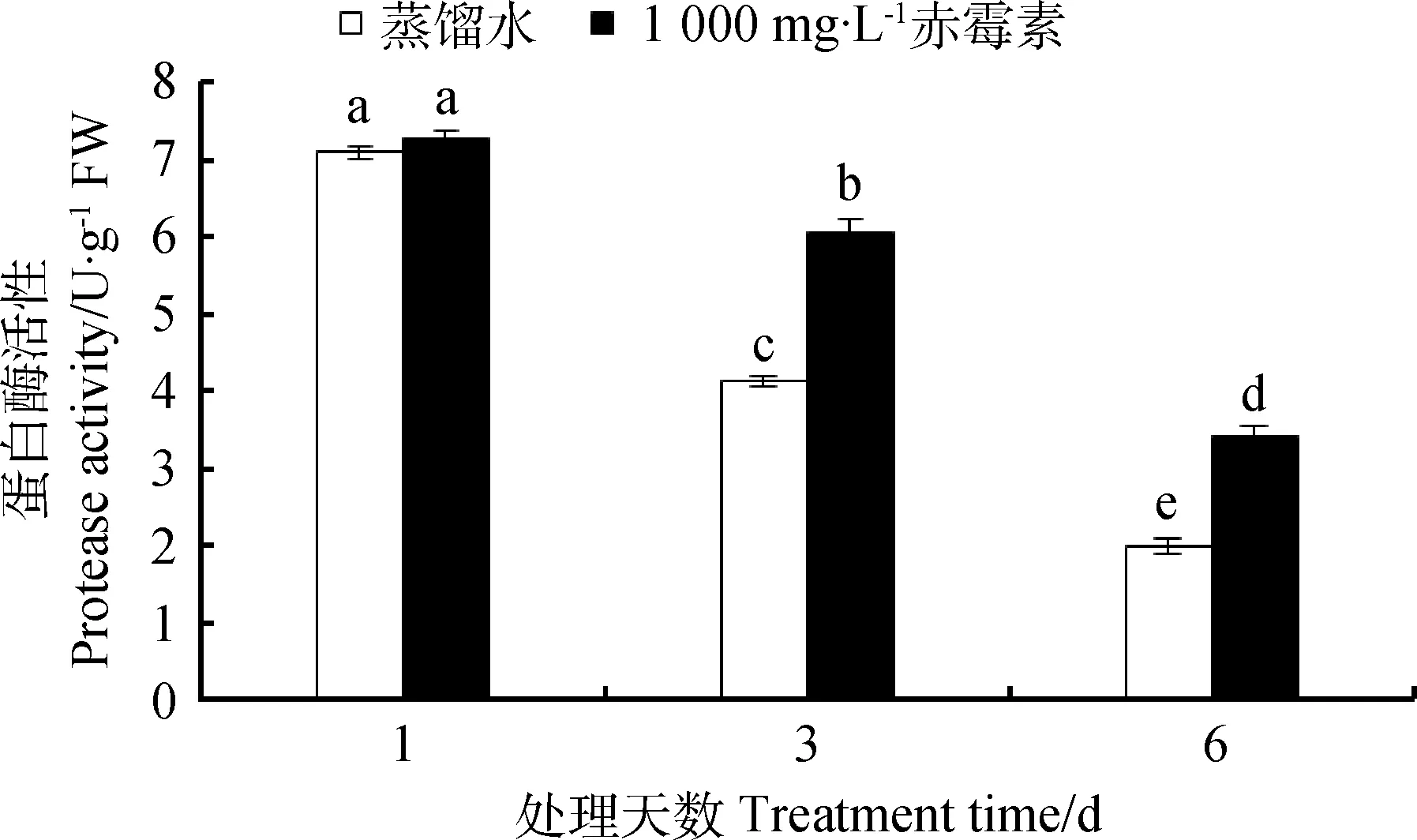
图4 GA3溶液浸种对露蕊乌头种子萌发过程中蛋白酶活性的影响Fig.4 Influences of GA3 on proteinase activity in the process of Aconitum gymnandrum seed germination
如图5可知,萌发第1天,GA3处理种子中脂肪酶活性比CK下降了10.87%。萌发第3天,经GA3处理的种子脂肪酶活性达到最大值,相比CK提高了48.8%,在处理的第6天,GA3处理种子内的脂肪酶活性比对照提高了17.65%。
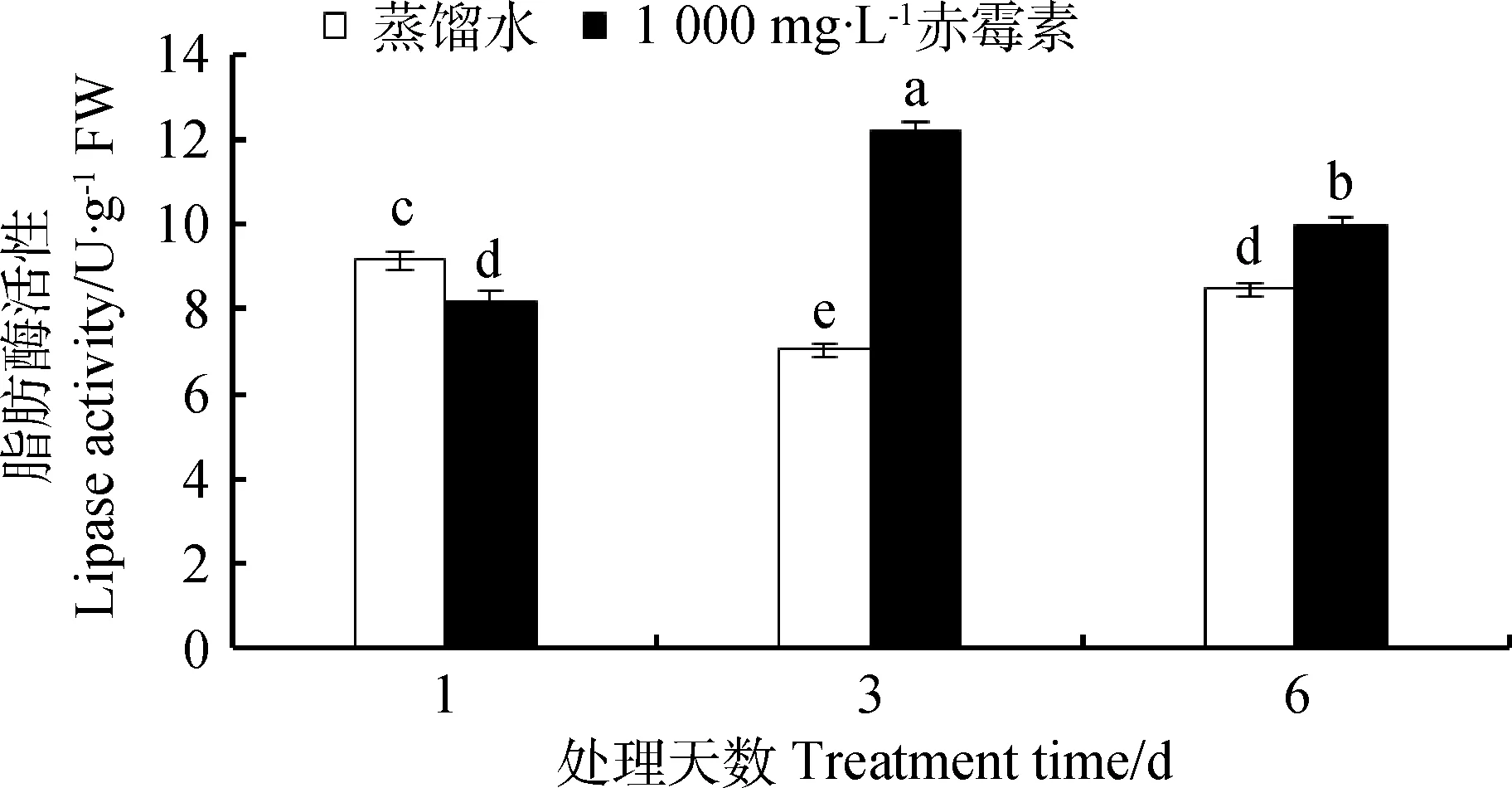
图5 GA3溶液浸种对露蕊乌头种子萌发过程中脂肪酶活性的影响Fig.5 Influences of GA3 on lipase activity in the process of Aconitum gymnandrum seed germination
2.3 黑暗条件下1 000 mg·L-1GA3浸种处理对露蕊乌头种子萌发中抗氧化酶活性的影响
由图6所示,随发芽时间的延长,经1 000 mg·L-1GA3处理的种子SOD活性始终高于CK组。在处理的第1、3、6天,GA3处理的种子内SOD的活性分别比CK提高了6.48%,9.68%,32.67%。
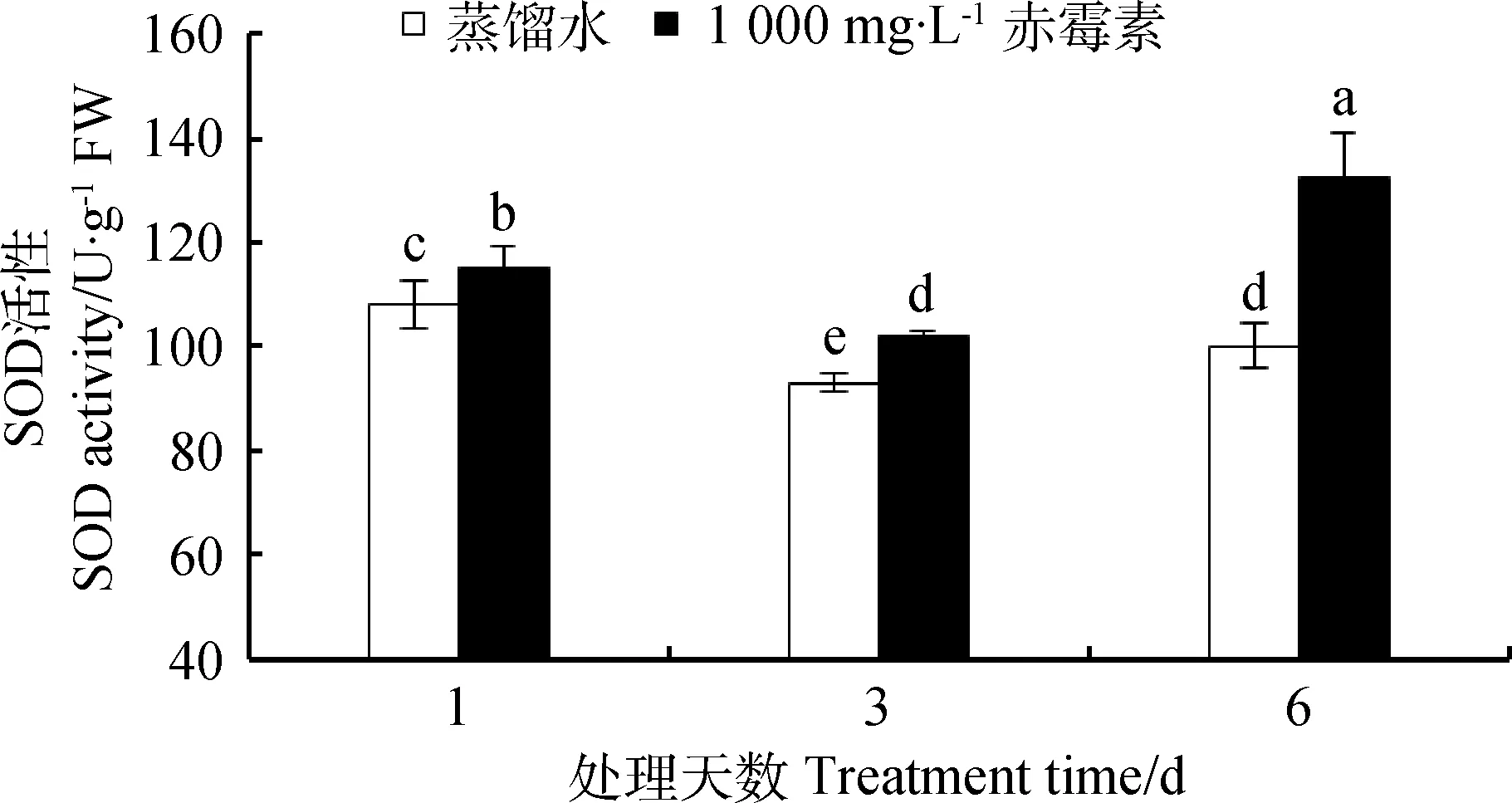
图6 GA3溶液浸种对露蕊乌头种子萌发过程中超氧化物歧化酶活性的影响Fig.6 Influences of GA3 on SOD activity in the process of Aconitum gymnandrum seed germination
由图7所示,处理第1天,GA3和CK处理下露蕊乌头种子内POD活性无显著性差异(P<0.05)。处理第3、6天,GA3处理下POD活性分别比对照提高了102.80%和24.65%。第6天与第1天相比,经1 000 mg·L-1GA3处理的种子的POD活性显著提高了160.97%(P<0.05),CK处理组则提高了119.39%,GA3处理显著增强露蕊乌头种子内POD的活性(P<0.05)。
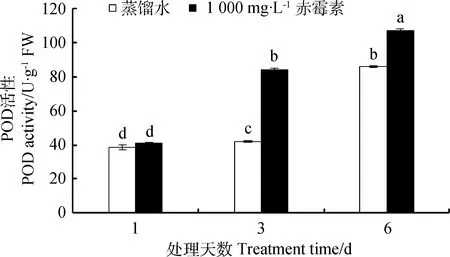
图7 GA3溶液浸种对露蕊乌头种子萌发过程中过氧化物酶活性的影响Fig.7 Influences of GA3 on POD activity in the process of Aconitum gymnandrum seed germination
由图8可知,在萌发第1天,经1 000 mg·L-1GA3与蒸馏水(CK)处理的种子CAT活性无显著差异(P<0.05)。处理第3天,GA3处理露蕊乌头种子内CAT活性比CK处理提高了30.88%。处理第6天,GA3处理种子内CAT活性比CK处理下降45.57%。
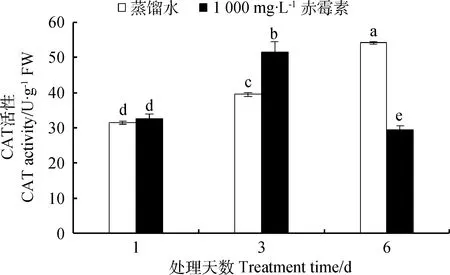
图8 GA3溶液浸种对露蕊乌头种子萌发过程中过氧化氢酶活性的影响Fig.8 Influences of GA3 on CAT activity in the process of Aconitum gymnandrum seed germination
3 讨论
3.1 外源GA3作用下露蕊乌头种子的萌发
种子萌发是植物生活史的重要阶段,植物种子能对适宜萌发的外界条件做出反应,及时萌发并建苗以避开不利于幼苗生长与存活的恶劣环境,从而提高植物的整体适合度[20],因此人为设置适宜的外界条件可以有效促进种子的萌发。GA3作为一种信号物质,在促进种子萌发的过程中发挥着重要的作用。周丽霞、李赫男等人对紫花高乌头和黄花乌头种子的研究表明不同浓度的GA3处理对乌头种子萌发的促进效果不同[21-22]。李开祥等研究表明GA3可以促进肉桂种子的萌发[23]。本实验结果表明,0、125、250、500、750、1 000、1 500 mg·L-1不同浓度梯度的GA3处理露蕊乌头种子后均可以提高种子的发芽率、发芽势、发芽指数和活力指数,其中以1 000 mg·L-1的GA3处理结果最为明显。此外,黑暗处理下的露蕊乌头的发芽率、发芽势、发芽指数和活力指数均高于光照处理组。说明黑暗条件下培养,1 000 mg· L-1GA3浸种是促进露蕊乌头种子的萌发的最佳条件。
3.2 外源GA3作用下对露蕊乌头种子主要物质及相关酶的影响
种子成熟的过程中会积累大量的可溶性糖、可溶性蛋白等贮藏物质,当种子打破休眠进入萌动状态时,首先动用胚部或胚中轴的可溶性糖及贮藏蛋白。吴玉香等研究表明GA3使西洋杜鹃中的可溶性糖、可溶性蛋白发生不同的变化[24]。黄珍等人研究表明GA3处理使得华重楼种子可溶性糖呈下降趋势[25]。胥学峰研究表明用GA3处理黄芪后的可溶性蛋白含量呈先下降后上升的趋势[26]。本研究表明1 000 mg·L-1GA3处理后的露蕊乌头种子萌发中可溶性糖和可溶性蛋白的变化情况均比CK处理的种子变化显著。在萌发过程中,与对照相比,GA3浸种促进了露蕊乌头种子内可溶性糖的水解,为种子萌发提供动力。1 000 mg·L-1GA3处理露蕊乌头种子内可溶性蛋白的含量先下降后上升,萌发前期可溶性蛋白水解为其他物质为种子的萌发提供能量;萌发后期可溶性蛋白含量上升这可能与露蕊乌头种子内相关代谢酶的积累变化有关,因为大多数代谢酶的本质是蛋白质。综上所述,GA3处理促进了露蕊乌头种子中可溶性糖的水解和可溶性蛋白的水解再合成,从而为种子打破休眠提供足够的动力。
种子萌发过程中,贮藏于其组织中的大分子物质在相关代谢酶类(α-淀粉酶、蛋白酶、脂肪酶等)的催化作用下被分解成可溶性的小分子物质,随后运送到胚的生长部位被继续的分解和利用。鱼小军等人研究表明外源GA3提高了条叶车前种子的α-淀粉酶的活性从而促进了种子的萌发[27]。本实验结论与其基本一致。结果表明GA3提高了α-淀粉酶的活性,α-淀粉酶可以促进了种子内淀粉的水解,淀粉仅作为一种暂时的贮藏物质,不断的水解为可溶性糖以满足种子萌发生长所需要的营养物质,萌发第6天,可溶性糖的积累已经足够并一直处于水解状态,使得淀粉酶的活性降低。在萌发过程中,GA3处理和CK中蛋白酶活性都降低,但相比对照而言,GA3提高了蛋白酶的活性,可以促进可溶性蛋白水解为氨基酸,水解后的氨基酸可以重新合成其他蛋白质。GA3促进蛋白质的新陈代谢,这和本研究中可溶性蛋白含量的变化相一致。与CK处理相比,GA3处理提高了露蕊乌头种子内脂肪酶活性,促使种子内部贮藏物质大量分解,然后将营养物质输送到各器官供生长使用,从而促进露蕊乌头种子打破休眠状态继而进入萌发状态。
3.3 外源GA3作用下露蕊乌头种子抗氧化酶活性的变化
4 结论
本文研究表明,在光照和黑暗条件下,适宜浓度的GA3浸种均可以提高露蕊乌头种子的发芽率、发芽势、发芽指数、活力指数,其中黑暗条件下培养,1 000 mg·L-1GA3浸种是促进露蕊乌头种子萌发的最佳条件。 通过测定1 000 mg·L-1GA3浸种处理后种子萌发期生理指标,进一步探索了其萌发机制,发现GA3可以通过改变露蕊乌头种子内可溶性糖及可溶性蛋白的含量,提高相关水解酶及抗氧化酶的活性来促进种子萌发。总之,黑暗条件下培养,1 000 mg·L-1GA3浸种可用于实际生产中促进露蕊乌头种子的萌发。

