N-甲基环丙沙星氟喹诺酮查尔酮类衍生物对人胰腺癌BxPC-3细胞凋亡和自噬的影响
梁红霞,余艺华,王 萌,石贞玉,皇甫超申,胡国强,厉永强,刘 彬
(河南大学 1. 护理与健康研究所、2. 药学院、3. 基础医学院,河南 开封 475004)
喹诺酮类抗感染药物是一类细菌DNA回旋酶的抑制剂。真核生物的拓扑异构酶氨基末端结构域的氨基酸序列与原核生物回旋酶的β亚型具有较高的同源性,中间部分的结构域与原核生物回旋酶的Iα亚基具有较高同源性[1],这是抗菌氟喹诺酮改造为抗肿瘤化合物的理论依据[2]。本研究运用电子等排体和拼接原理,应用α,β-不饱和酮作为氟喹诺酮碳-3位羧基的生物等排体,设计合成了一系列溶解性好、分子质量较小的的氟喹诺酮类查耳酮结构类似物,并对该类化合物的抗肿瘤活性进行筛选。结果显示,该类衍生物均具有较好的抗肿瘤活性,其中1-环丙基-6-氟-7-(4-甲基-哌嗪-1-基)-3-[2-(3,4,5-三甲氧苯甲酰基)-乙烯-1-基]-喹啉-4-(1H)-酮(HGQ7)活性最强(Fig 1),其IC50值达4.952 μmol·L-1,具有进一步研究和开发的价值。近期已有文献报道,临床常用的抗肿瘤药物能诱导肿瘤细胞发生自噬[3],多数诱导产生的自噬作用对肿瘤细胞具有保护作用,并能降低化疗药物的疗效。抑制细胞自噬,可增强肿瘤细胞对化疗药物的敏感性[4]。但某些抗肿瘤药物利用自噬作用造成肿瘤细胞的死亡,并将这种作用称为Ⅱ型程序性细胞死亡[5]。因此,自噬现象已成为抗肿瘤药物研究开发中需要重视的问题。课题组在对新合成化合物的筛选和研究过程中,发现多数氟喹诺酮类衍生物具有诱导肿瘤细胞自噬现象。本研究应用人胰腺癌BxPC-3细胞株,对HGQ7抑制细胞增殖和诱导自噬的机制进行了初步研究,为该类药物的开发和应用提供一定的实验依据。
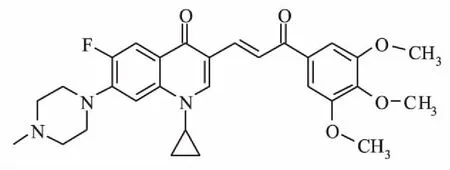
Fig 1 Structure of 1-cyclopropyl-6-fluoro-7- (4-methyl-piperazin-1-yl)-3-[2-(3,4,5-trimethoxy-benzoyl)-vinyl-1-yl]-quinoliN-4(1H)-one
1 材料与方法
1.1材料
1.1.1细胞株 人胰腺癌BxPC-3细胞购自中国医学科学院基础医学研究所,培养于含10%胎牛血清(杭州四季青生物工程材料有限公司)的RPMI 1640培养基(Gibco公司),置5%的CO2、37℃恒温培养。
1.1.2药物与试剂 HGQ7由河南大学化学生物学研究所合成,经HPLC法测定纯度>99%,HP5989A质谱仪测得相对分子质量为521.23。四甲基偶氮唑盐(MTT,Solarbi公司);TUNEL细胞凋亡检测试剂盒(碧云天试剂公司);AnnexinⅤ-FITC/PI双染法细胞凋亡检测试剂盒(上海七海复泰生物科技有限公司);氯喹(chloroquine,CQ)、羊抗兔HRP二抗(Santa Cruz公司);兔抗LC3B多克隆抗体(Sigma公司);驴抗兔Alexa Flour 488抗体(Abcam公司);鼠抗人β-actin单克隆抗体(北京鼎国昌盛生物技术公司)。
1.1.3仪器 二氧化碳培养箱(Thermo Forma公司);酶标仪(Thermo Multiskan Ascent);倒置显微镜(莱卡显微系统公司);BX51荧光显微镜(Olympus公司);高速离心机(艾本德公司);凝胶成像系统(UVP公司);流式细胞仪(艾森生物公司);电泳仪、半干式印迹膜转印仪(六一电子仪器设备厂)。
1.2方法
1.2.1MTT法测定细胞存活率 以细胞数1.5×107·L-1接种于96孔板,分别加入含HGQ7(0、0.625、1.25、2.5、5.0、10.0 μmol·L-1)和氯喹的培养液,培养24、48 h后,每孔加入5 g·L-1MTT 20 μL培养4 h,吸去培养液,每孔加入DMSO 150 μL,振荡至蓝色晶体完全溶解,测定570 nm吸光度(OD)值并计算抑制率,以含有等体积的培养液和DMSO的无细胞孔吸光度值为空白对照,按公式计算细胞抑制率:细胞抑制率=(1-实验组OD值/对照组OD值)×100%。
1.2.2AnnexinⅤ-FITC/PI双染法检测细胞凋亡 取对数生长期细胞,加入400 μL 1×Binding buffer重新悬浮细胞,再加入5 μL Annexin Ⅴ-FITC,室温避光静置15 min。加入10 μL PI染色液,冰浴避光静置5 min,用流式细胞仪检测,激发光波长为488 nm。
1.2.3TUNEL法测定细胞凋亡率 细胞以1.5×107·L-1接种于放有盖玻片的6孔板中,每孔500 μL,设立HGQ7组(0、1.25、5.0 μmol·L-1)和HGQ7联合氯喹组,同时收集细胞,按试剂盒说明书检测,应用ImageJ计算单位面积细胞总数,统计细胞凋亡率。
1.2.4间接免疫荧光检测LC3在BxPC-3细胞的表达 收集对数生长期细胞,用RPMI 1640培养液制成6×107·L-1浓度的细胞悬液,接种多聚赖氨酸预处理爬片的6孔板,每孔3 mL。24 h后PBS洗涤,4%的多聚甲醛4℃冰箱固定,用含0.5% Triton X-100的PBS室温摇床孵育5 min,5%脱脂奶粉室温封闭1 h,PBS洗涤,每片加入LC3抗体(1 ∶50)200 μL,4℃冰箱过夜;加入对应的二抗Alexa Fluor 488标记驴抗兔抗体(1 ∶300)200 μL,室温避光孵育1 h,封片拍照。
1.2.5Western blot法检测细胞LC3表达 取BxPC-3细胞,低温提取细胞总蛋白,BCA法测定蛋白浓度,以20 μg蛋白上样,SDS-PAGE分离样品,转膜,封闭。按1 ∶500浓度稀释一抗,4℃摇床震荡孵育过夜,按1 ∶5 000浓度稀释二抗,室温摇床震荡孵育2 h,ECL显影。
2 结果
2.1HGQ7对BxPC-3细胞增殖的抑制作用Fig 2的MTT结果显示,HGQ7处理BxPC-3细胞24、48 h,对细胞增殖有明显抑制作用(P<0.05,P<0.01),24 h和48 h的IC50分别为4.952 μmol·L-1和4.564 μmol·L-1。

Fig 2 Proliferation inhibition effect ofHGQ7 on BxPC-3 cells n=5)
*P<0.05,**P<0.01vscontrol
2.2HGQ7诱导BxPC-3细胞凋亡Fig 3的Annexin V/PI检测结果显示,对照组细胞凋亡率为3.17%,HGQ7(1.25、5 μmol·L-1)处理24 h细胞凋亡率分别为30.82%、59.26%,明显高于对照组(P<0.01)。Fig 4的TUNEL结果显示,随着HGQ7浓度增加,细胞凋亡率明显增加,与对照组相比,差异有统计学意义(P<0.01)。
2.3HGQ7对BxPC-3细胞自噬的影响Fig 5间接免疫荧光结果显示,对照组BxPC-3细胞质中的LC3绿色荧光亮点较弱,不同浓度HGQ7处理后,BxPC-3细胞荧光亮点明显增加,表明HGQ7诱导BxPC-3细胞发生自噬。Fig 6的Western blot结果显示,LC3-Ⅱ的表达量随HGQ7处理时间延长而增加,在24 h达到最高,48 h时,LC3-Ⅱ表达量较之前明显下降,表明HGQ7具有自噬诱导作用。
2.4氯喹对HGQ7抑制细胞增殖作用的影响如Fig 7所示,HGQ7及HGQ7联合氯喹对BxPC-3细胞的增殖有抑制作用,在HGQ7低剂量(0.312 5~2.5 μmol·L-1)时,HGQ7联合氯喹组细胞增殖抑制率明显高于HGQ7单独处理组;而在HGQ7高剂量(5~10 μmol·L-1)时,HGQ7联合氯喹组的细胞增殖抑制率明显低于HGQ7单独处理组,差异有统计学意义(P<0.01)。

Fig 3 The apoptotic rate of BxPC-3 cells aftertreatment with HGQ7 for 24 n=3)
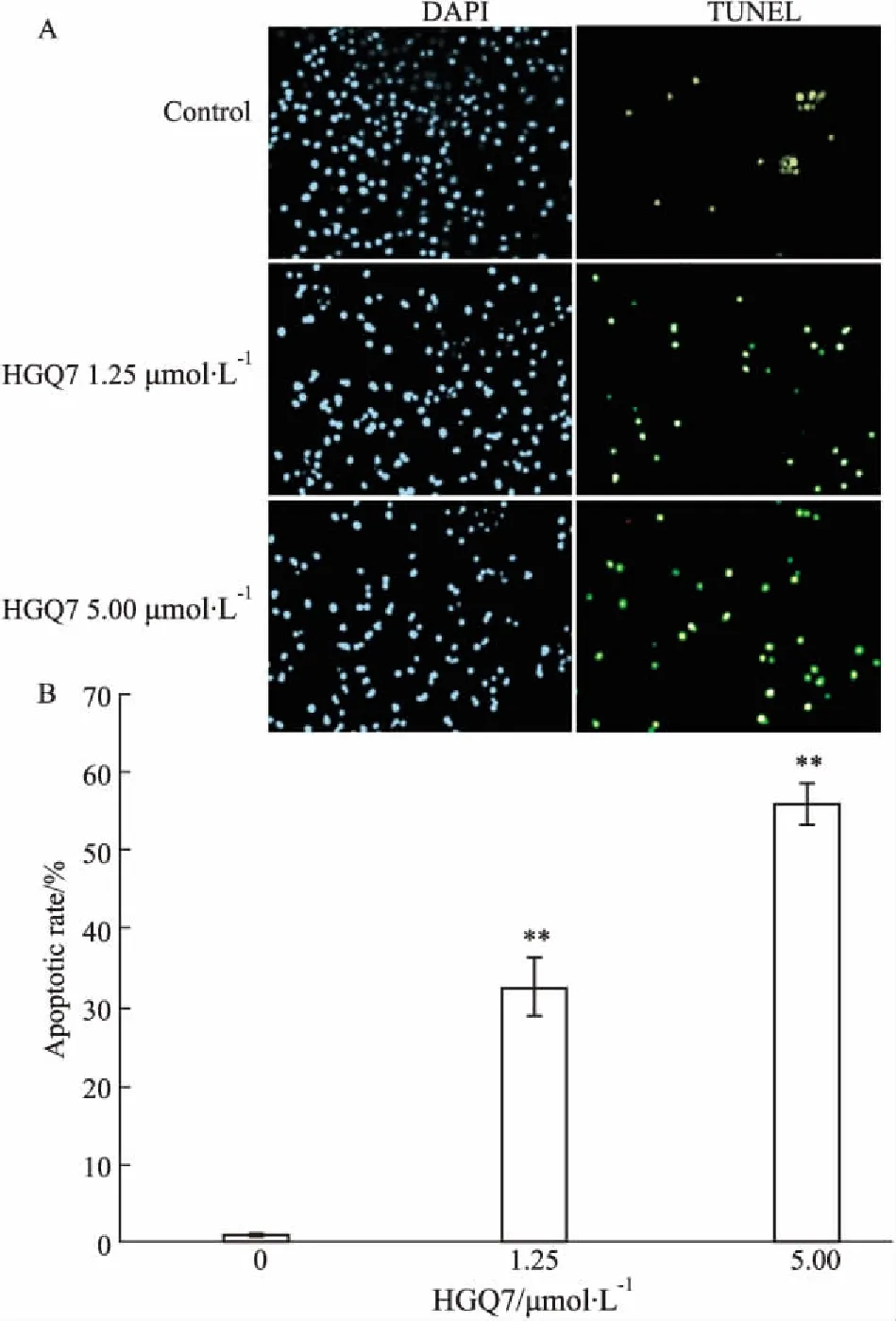
Fig 4 Induction of apoptosis of BxPC-3 cells treated withHGQ7 for 24 h evaluated by TUNEL assay (×100)
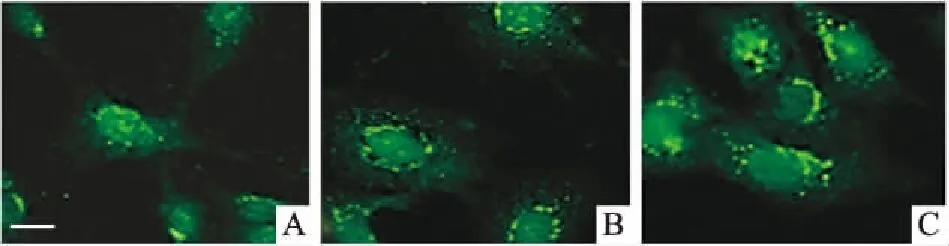
Fig 5 Induction of autophagy of BxPC-3 cellstreated with HGQ7 for 24 h evaluated byan immunofluorescence assay (scale bar=50 μm)
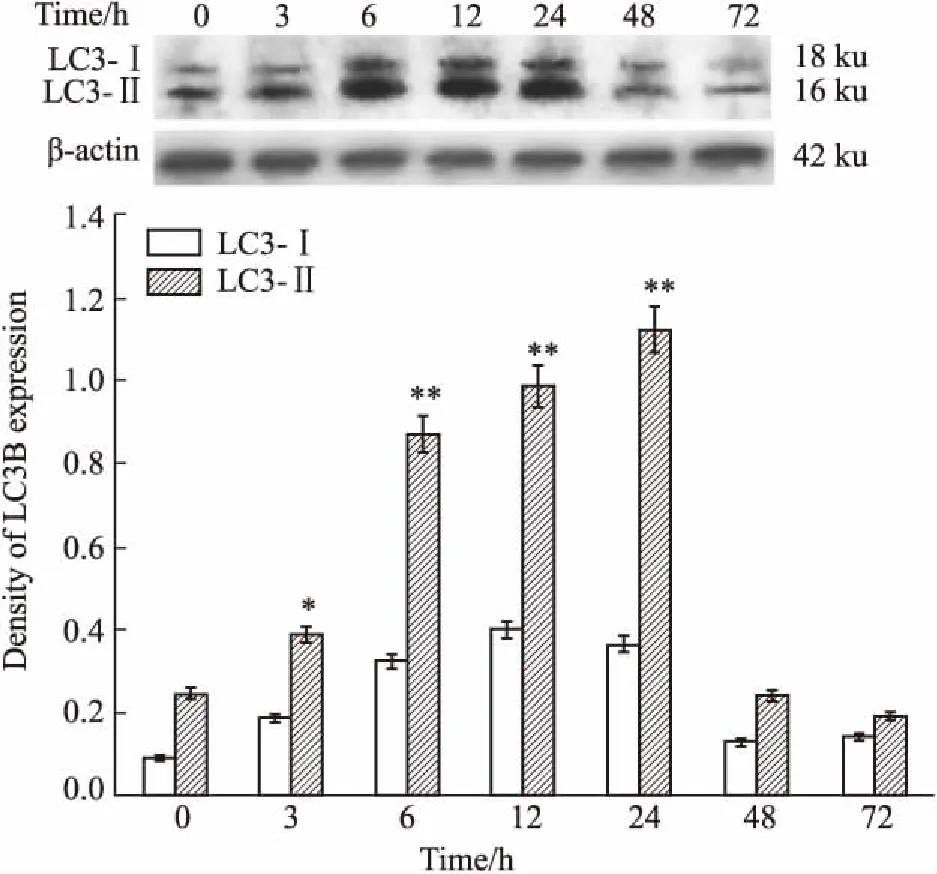
Fig 6 Effects of HGQ7 (5.0 μmol·L-1) onLC3 expressions in BxPC-3 cells n=3)
*P<0.05,**P<0.01vs0 h group
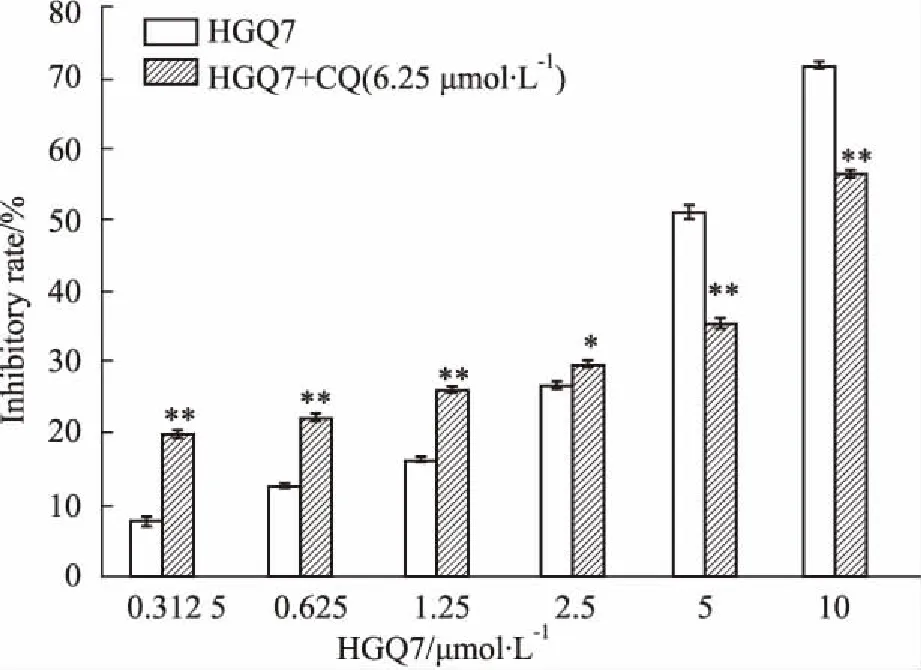
Fig 7 Proliferation inhibition effect of HGQ7 andCQ on BxPC-3 cells
*P<0.05,**P<0.01vsHGQ7 group
2.5氯喹对HGQ7诱导细胞凋亡的影响Fig 8结果显示,HGQ7(1.25 μmol·L-1)联合氯喹组细胞凋亡率高于HGQ7单独处理组,差异有统计学意义(P<0.05);HGQ7(5 μmol·L-1)联合氯喹组的细胞凋亡率低于HGQ7单独处理组,差异有统计学意义(P<0.01)。
3 讨论
本研究所选用的氟喹诺酮类化合物是以环丙沙星为原料,以舒尼替尼(索坦)为模板,利用活性拼接原理,合成11种氟喹诺酮-吲哚类查尔酮目标化合物。一般认为,经改造的喹诺酮类抗肿瘤化合物是DNA拓扑异构酶Ⅱ毒剂,与DNA断裂片段及拓扑异构酶Ⅱ结合形成复合物,防止DNA再连接,造成DNA损伤[6]。本研究应用MTT法检测新合成的氟喹诺酮类化合物对肿瘤细胞增殖的影响,前期共合成此类化合物11种,在不同浓度下对细胞均有不同程度的增殖抑制作用,其中HGQ7对胰腺癌BxPC-3细胞增殖抑制作用最强,24 h的IC50值达4.952 μmol·L-1。为了进一步观察HGQ7对胰腺癌细胞的抑制作用,又设置了48 h时间点,结果显示,在48 h时,IC50值达4.564 μmol·L-1,说明具有药物浓度和时间依赖性。TUNEL法进一步观察HGQ7对BxPC-3细胞的凋亡作用,荧光显微镜下观察到随着HGQ7浓度升高,细胞凋亡数量明显上升,凋亡率也明显增高,与对照组比较,差异有统计学意义,与AnnexinⅤ-FITC/PI双染法的结果一致,说明HGQ7对胰腺癌BxPC-3细胞凋亡具有明显诱导作用。
自噬在真核细胞的病理生理过程中广泛存在,自噬细胞内的溶酶体可以对一些受损、错误折叠的蛋白质以及衰老细胞器进行一系列的分解和再循环应用[7],维持细胞内环境稳定[8]。临床常用的抗肿瘤药物能诱导肿瘤细胞发生自噬,多数自噬作用结果是对肿瘤细胞具有保护作用,保护细胞免于凋亡,但也有部分药物通过自噬作用加速细胞进入死亡程序,即所谓的Ⅱ型程序性死亡[9-10]。LC3是自噬的标志物,其中LC3-Ⅱ含量与自噬泡的数量成正比。自噬进展过程中,位于自噬体内膜的LC3-Ⅱ和自噬体内容物一起由溶酶体酶降解[11]。本实验选取LC3观察HGQ7对BxPC-3细胞自噬的影响,应用间接免疫荧光技术检测LC3的表达。结果显示,HGQ7组反映LC3的绿色荧光斑点明显高于对照组,斑点主要位于细胞核附近的细胞质中,其数量增多、亮度增加,提示细胞中自噬体数量增加,说明HGQ7能够诱导细胞发生自噬。应用Western blot对LC3的表达量作半定量分析,不同时间点的HGQ7浓度均为5.0 μmol·L-1,结果显示,与0 h相比,在3、6、12、24 h的LC3-Ⅱ表达量逐渐增加,明显高于对照组,但在48、72 h时,LC3-Ⅱ的表达量呈下降趋势,说明定位于自噬体内膜的LC3-Ⅱ随着自噬过程的进展进入了溶酶体降解的过程。从自噬流的角度来看,自噬体增多有可能是由于自噬体的形成增加,也可能是其清除受阻所致[12]。为了进一步了解自噬与细胞增殖及凋亡的关系,本实验应用自噬抑制剂氯喹来阻断自噬体和溶酶体融合形成自噬溶酶体的过程[13]。为了有效利用氯喹研究自噬对药物作用的机制,前期应用MTT法已证明,在6.25 μmol·L-1浓度以下时,氯喹对BxPC-3细胞增殖的影响不明显。应用MTT法检测HGQ7单独处理BxPC-3细胞48 h,与HGQ7联合氯喹处理细胞48 h后生长抑制率的变化,结果显示,在低剂量(0.312 5 ~2.5 μmol·L-1)时,HGQ7联合氯喹组细胞生长抑制率明显高于HGQ7单独处理组,而在HGQ7高剂量(5.0 ~10 μmol·L-1)时,HGQ7联合氯喹组的细胞生长抑制率明显低于HGQ7单独处理组。说明低剂量HGQ7处理BxPC-3细胞,自噬对细胞具有保护作用,而在HGQ7高剂量时,自噬则促进细胞死亡。进一步的验证采用TUNEL法检测细胞凋亡率,结果显示,以不加任何药物组和单独氯喹组作为对照,1.25 μmol·L-1的HGQ7联合氯喹组细胞凋亡率高于HGQ7单独处理组,而5.0 μmol·L-1的HGQ7联合氯喹组的细胞凋亡率较HGQ7单独处理组低,与MTT结果相吻合。提示HGQ7对BxPC-3细胞的作用中,自噬的影响与细胞凋亡有关,自噬对肿瘤细胞的保护作用依化合物浓度不同差别明显,对其机制的阐明需进一步研究。
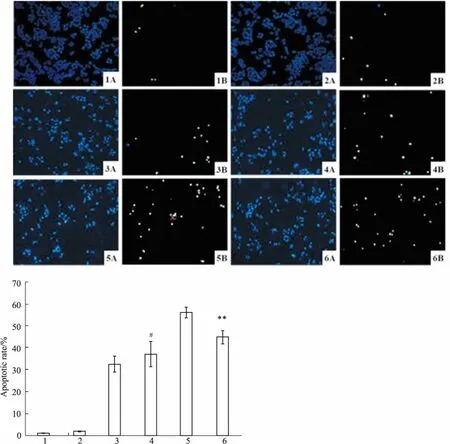
Fig 8 Effects of HGQ7 andCQ on apoptosis of BxPC-3 cells n=9)
Representative images were taken(×100), nuclear stain(DAPI, A) and apoptotic stain (TUNEL, B) overlaid. 1: Control;2: CQ (6.25 μmol·L-1) 3: HGQ7 (1.25 μmol·L-1);4: HGQ7(1.25 μmol·L-1)+CQ (6.25 μmol·L-1);5: HGQ7 (5.00 μmol·L-1);6: HGQ7 (5.00 μmol·L-1)+CQ (6.25 μmol·L-1).#P<0.05vsHGQ7 (1.25 μmol·L-1) group;**P<0.01vsHGQ7 (5.00 μmol·L-1) group.
(致谢:本实验在河南大学护理与健康重点实验室完成,李晓华参与部分实验工作,特此致谢!)