铁稳态及黄酮类化合物对其调控的研究进展
肖 轩,牛银波,杨园园,董 栋,李京宝,商 澎
(1.西北工业大学生命学院,陕西 西安 710072;2.空间生物实验模拟技术国防重点学科实验室,陕西 西安 710072;3.西北工业大学深圳研究院,广东 深圳 518057)
铁是人体所必需的微量元素之一,参与人体组织的构成和正常生理代谢的维持。铁的来源主要有两个,从食物中摄取的外源性铁和红细胞破裂后释放的内源性铁,其吸收部位主要在十二指肠、胃和空肠上端,是血红蛋白、肌红蛋白、细胞色素、过氧化氢酶等的组成成分。人体缺铁会导致缺铁性贫血症,但由于人体缺乏铁的排泄机制,当体内铁含量过高时(又称为“铁过载”)会对机体产生巨大危害,目前针对铁过载诱发疾病的药物尚存在不能大量制备、副作用大等局限性。研究发现,广泛存在于植物中的黄酮类化合物,不仅具有防治心脑血管疾病、抗炎、抗菌、抗肿瘤、护肝、抗自由基、抗氧化等功效,而且近年来发现其具有螯合铁的作用[1]。基于此,利用黄酮类化合物治疗铁稳态失衡导致的疾病已经受到关注。本文着重对铁稳态、铁稳态失衡诱发的疾病,以及黄酮类化合物对铁稳态的调控进行综述。
1 铁稳态相关调节蛋白及铁稳态的调节
机体中铁稳态调节相关蛋白种类较多,包括十二指肠细胞色素b(duodenal cytochrome b, Dcytb)、二价金属转运蛋白l(divalent metal transporter 1, DMT1)、铁蛋白(ferritin, Fn)、膜转铁蛋白(ferroportin, FPN)、膜铁转运辅助蛋白(hephaestin, Heph)、转铁蛋白(transferrin, Tf)、铁调素(Hepcidin)等。下面将对这几种重要的铁稳态调节蛋白进行介绍。
1.1铁稳态相关的调节蛋白人类每天的膳食中平均包含10~20 mg铁,但只有1~2 mg能被人体吸收。铁的吸收、利用、贮存和循环过程需要多种蛋白质参与。十二指肠黏膜中具有铁还原酶活性的铁调节蛋白Dcytb,主要作用是将三价铁(Fe3+)还原为二价铁(Fe2+),然后通过DMT1将Fe2+运输进入细胞内。当机体中铁的储存量较高时,Fe2+将会与细胞中的Fn结合,能通过氧气或过氧化氢的作用,使Fe2+转变为Fe3+,最终以稳定的氧化铁形式贮存。同时,由肝脏分泌的肽类激素Hepcidin,能够和组织细胞膜上的FPN结合,使FPN进入细胞内并使其降解,最终导致细胞内铁离子的输出减少。当机体中铁含量较低时,细胞中Fn内部的矿物质氧化铁被外部的还原剂溶解,被Fn结合的Fe2+被释放。Fn通过这种特殊的结构可有效地释放和贮藏铁离子,调节机体的铁稳态平衡。铁吸收时,胞内铁将通过表达于十二指肠肠上皮细胞基底外侧表面的FPN以及Heph的协调作用,在铜蓝蛋白(ceruloplasmin, CP)的作用下,将Fe2+再氧化为Fe3+,经FPN输出,依次加载到Tf上,使铁从肠上皮细胞释放到血液循环中,运送到需要铁的部位[2]。同时,Hepcidin分泌减少,促进体内铁含量升高(Fig 1)。
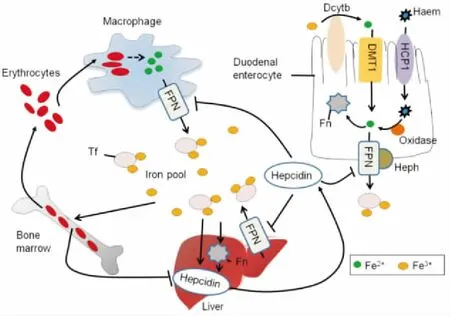
Fig 1 Regulatory mechanisms of iron homeostasis-associatedregulation proteins on systemic iron homeostasis
1.2铁稳态的调节
1.2.1铁响应元件/铁调节蛋白(iron-responsive elements/iron-regulatory proteins, IREs/IRPs)与细胞内铁稳态调控 细胞内的铁受到铁稳态相关蛋白的严格控制,其中由IREs/IRPs系统介导的转录后调控在该过程中发挥核心作用。细胞内铁池中不稳定的铁主要受IREs/IRPs系统调控,由铁调节蛋白1/2(iron-regulatory protein 1/2, IRP1/2)结合到多种特定蛋白mRNA序列的IREs上。通过IREs/IRPs相互作用,调节编码铁稳态相关蛋白质mRNA的表达,从而对细胞内的铁稳态进行调控。IREs位于编码转铁蛋白受体1(transferrin receptor 1, TfR1)和DMT1的mRNA序列3’非编码区(untranslated region, UTR)和编码Fn、FPN的mRNA序列5’-UTR。当铁含量较低时,IRP1/2和IREs结合活性增加,IRP1/2与位于TfR1和DMT1 mRNA 3’-UTR末端的IREs结合,刺激TfR1和DMT1的翻译;相反,IRP1/2与位于Fn、FPN mRNA 5’-UTR末端的IREs结合,导致Fn和FPN翻译抑制,最终使细胞内铁吸收增加。当铁含量升高时,IREs-IRPs复合物的稳定性下降,其增强5’-UTR端具有IREs的mRNA序列(编码Fn和FPN)转录,抑制3’-UTR端具有IREs的mRNA序列(编码TfR1和DMT1)转录,最终降低细胞内铁含量[3-4]。
1.2.2Hepcidin/FPN与系统性铁稳态的调控 FPN是存在于细胞膜上的,使铁从细胞内向细胞外输出的一种膜铁转运蛋白,也是Hepcidin的受体。FPN能将胞内铁转运至系统内的铁池中,在正常稳定的状态下,进入系统中的铁主要和Tf结合,大部分用于红细胞的生成。系统中过量的铁大部分作为Fn储存在肝脏中,少量储存在其他组织中。衰老的红细胞中的铁被巨噬细胞重新回收利用,通过巨噬细胞膜上FPN转运到系统的铁池中[5]。FPN的表达和系统中可利用的铁量受Hepcidin的抑制。Hepcidin与FPN结合,使FPN进入细胞内,致使其降解,从而减少细胞内铁离子的输出,降低血清中铁离子的浓度,在体内铁过载时发挥重要作用。综上可知,Hepcidin在系统性铁稳态中起着核心调节作用。
Hepcidin受铁储存、炎症、缺氧、红细胞生成等的调节,其过程需要多种蛋白质的协调,包括铁调素调节蛋白(hemojuvelin, HJV)、骨形态发生蛋白6(bone morphogenetic protein 6, BMP6)、人血色素沉着蛋白(human haemochromatosis protein, HFE)、转铁蛋白受体2(transferrin receptor 2, TfR2)、蛋白裂解酶2(matriptase 2, MT2)、再生蛋白(Neogenin)、骨形态发生蛋白受体(bone morphogenetic protein receptor, BMPR)等。编码Hepcidin的基因是HAMP,Smad信号通路能够对HAMP转录进行调节。肝脏非实质细胞产生的BMP6先和肝细胞上的BMPR复合物结合,然后与HJV结合,导致下游信号通路Smad1、Smad5或Smad8激活Smad4,最终激活Hepcidin的表达。HJV能够微调BMP6信号,Neogenin能够使HJV稳定存在,MT2能够裂解HJV。Smad信号是通过TfR2与HFE和HJV协调调控。细胞外铁以铁饱和转铁蛋白(holotransferrin, HoloTf)的形式绑定到它的两个受体(TfR1和TfR2),通过铁特异性衔接子HFE相互连通,并使BMPR对其配体如BMP6敏感。当体内的铁供应量较高时,HFE和TFR1分离,能够和TFR2结合,从而通过Smad信号通路提高Hepcidin的表达。当体内出现炎症反应时,白细胞介素-6(interleukin 6, IL-6)和相关细胞因子结合IL-6受体,导致Janus激酶1/2-信号转导子和转录激活子3(Janus kinase 1/2-signal transducer and activator of transcription 3, JAK1/2-STAT3)激活,促进Hepcidin表达,以降低可利用性的铁[2,6](Fig 2)。
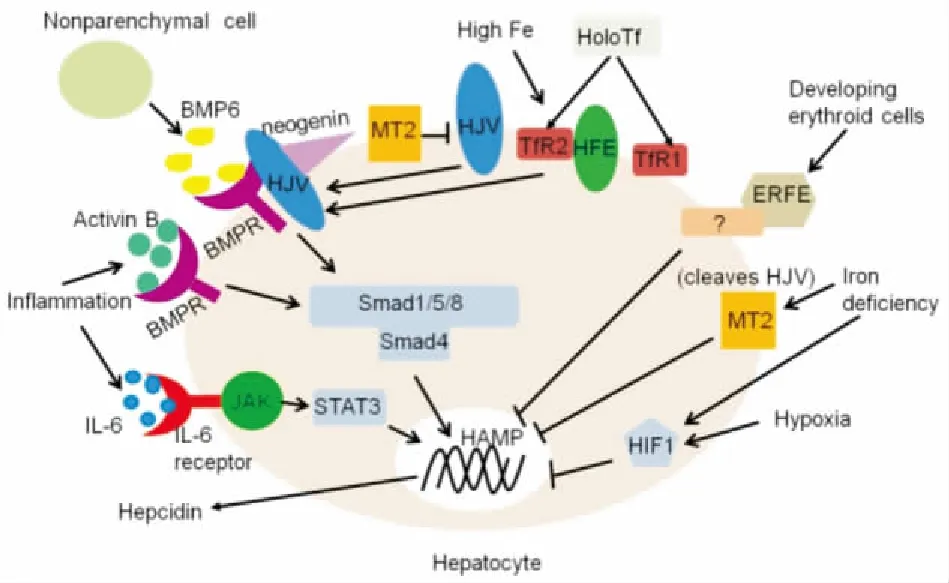
Fig 2 Regulation of hepcidin expression in hepatocytes
2 铁稳态失衡相关疾病及其治疗
2.1铁过载诱发的疾病及其治疗铁稳态失衡造成的铁过载会引发多种疾病,如肝硬化、心力衰竭、糖尿病、癌症、阿尔茨海默病、帕金森病和亨廷顿病等[7-8]。近年来,铁过载被认为是导致骨质减少、骨软化和骨质疏松的新致病因子,铁过载与骨质疏松症之间的关系已成为研究热点。许多研究表明,在体外,铁过载可诱导成骨细胞死亡。Tian等[9]首次证明,线粒体凋亡途径参与铁诱导的成骨细胞凋亡。Yang等[10]研究表明,铁能够通过抑制前成骨细胞的分化,降低骨形成。Wang等[11]研究显示,铁过载促进了破骨细胞的形成,并且加重了雌激素缺乏对骨量的影响。He等[12]研究认为,铁过载能够通过氧化应激作用,抑制成骨细胞活性。由此可见,铁代谢与骨代谢之间也存在密切联系。
目前,针对铁过载引发的疾病主要有两种治疗措施:放血法和使用去铁胺等铁螯合剂治疗法,但这两种方法存在一定的局限性,前者只适用于无放血禁忌者的短期治疗,后者用药较为频繁,会产生副作用[13]。随着人们对人体铁稳态相关通路的深入了解,通过对铁稳态中某些关键分子(如Hepcidin)的调控,来维持机体铁稳态已被广泛研究。但就现在的技术来说,获取这类物质比较困难,获得的量仅够用于科学研究,未能进行临床应用。因此,用具有螯合金属离子铁和抗氧化等功效的黄酮类化合物治疗铁过载疾病受到极大关注。
2.2铁缺乏诱发的疾病及其治疗铁是人体必需的一种微量元素,在维持机体生理代谢方面起着重要作用,铁缺乏常归因于慢性失血或饮食摄入量不足,系统对铁的需求超过铁的供应就会出现缺铁,导致贫血、延迟生长和发育、免疫功能异常等症。体内铁用于红细胞生成是重要的一个生理过程,铁缺乏通常会导致缺铁性贫血。大多数情况下,增加或补充膳食中铁的摄入量可治疗缺铁症。然而,在难治性缺铁性贫血罕见的遗传形式中,跨膜蛋白酶丝氨酸6的突变,导致Hepcidin表达异常升高,并且抑制肠铁吸收,因此需要静脉注射铁剂[14]。高Hepcidin含量也是炎症性和慢性病贫血的标志之一。在慢性炎症如炎性疾病和癌症的条件下,IL-6和结构相关细胞因子的表达增加,使IL-6受体途径激活,导致信号转导和STAT3介导的Hepcidin表达,并因此限制铁的吸收和可用性[15]。此外,在炎症条件下,肝脏中表达的转化生长因子β(transforming growth factor β, TGF-β)超家族的成员——激活素B,通过Smad1、Smad5或Smad8的信号传导途径,诱导HAMP转录[16]。因此,降低患有炎症性和慢性病贫血患者体内Hepcidin的表达,可有效缓解贫血症。
3 黄酮类化合物对铁稳态失衡的调控
3.1黄酮类化合物对铁过载的调控
3.1.1黄酮类化合物对铁过载调控的可行性 黄酮类化合物广泛存在于植物界,是植物多酚类物质中的一个大类。现已有大量研究证明,黄酮类化合物是有效的抗氧化剂和自由基清除剂,这主要是因为它能够螯合机体中参与产生自由基反应的过量金属(主要是Fe3+、Fe2+、Cu2+)。研究表明,黄酮类化合物含有多种铁的结合位点,如6,7-二羟基、3-羟基-4-酮基、2,3-双键、儿茶酚B环等,其中6,7-二羟基结构是最有效的铁结合位点,具有这种结构的黄芩素在所有pH条件下均具有较强的螯合铁活性,且不亚于去铁胺。具有3-羟基-4-酮基、2,3-双键和儿茶酚B环的槲皮素和杨梅素在中性条件螯和铁的能力相当于去铁铵,但在偏酸的环境下,螯合铁的活性有所下降[1]。机体内铁过载时,槲皮素通过螯合铁,在一定程度上抑制体内铁的吸收和再分配,从而降低体内铁含量[17]。
3.1.2黄酮类化合物对铁过载调控的研究进展 Baccan等[17]研究发现,儿茶酚类黄酮芦丁和槲皮素能够抑制铁过载血清中具有氧化还原活性的不稳定铁离子,这两种类黄酮都能有效地将金属铁加载到转铁蛋白中。槲皮素和芦丁的铁衍生物能够渗透细胞膜,游离的槲皮素能够进入细胞溶质,并减少细胞内不稳定的铁池。因此,槲皮素的抗氧化活性可能取决于其从细胞中运输不稳定铁离子,然后转移到转铁蛋白的能力。Lesjak等[18]的研究显示,大鼠十二指肠黏膜短期注射槲皮素,能够使十二指肠上皮细胞顶膜对铁的吸收增加,十二指肠细胞基底膜处铁的排出减少。因为槲皮素3-羟基和4-羰基之间能够结合铁,而当槲皮素的3-羟基甲基化后,均抑制了十二指肠上皮细胞顶膜对铁的吸收增加,十二指肠细胞基底膜处铁的排出减少,因此表明槲皮素对十二指肠的短暂性处理导致的该现象是通过槲皮素3-羟基对铁的螯合引起的。对大鼠进行槲皮素长期灌胃处理,导致十二指肠非血红素铁增加,血清铁、Tf饱和度和FPN含量下降,表明患有铁过载类疾病的患者通过食用富含黄酮类化合物的食物,可能有利于限制肠铁吸收。Guo等[19]研究C6神经胶质瘤细胞中铁积累与FPN表达的关系,探讨在帕金森病大鼠中,黄芩苷对铁过载的抑制作用机制,结果表明,C6神经胶质瘤细胞用不同浓度的柠檬酸铁铵处理后,细胞存活率和FPN表达与柠檬酸铁铵浓度呈负相关,但DMT1表达与柠檬酸铁铵的浓度呈正相关。在100 mg·L-1柠檬酸铁铵处理的C6神经胶质瘤细胞中,黄芩苷或去铁胺降低了DMT1的表达,增加了FPN的表达。这些结果表明,黄芩苷能够通过降低DMT1的表达,增加FPN的表达,从而降低C6神经胶质瘤细胞中的铁含量。
铁过载诱发的多种疾病机制中,氧化应激调控作用尤为突出。这主要是由于机体中过多的铁能够刺激脂质过氧化作用,铁通过Fenton反应促进羟基自由基的形成,引起后续组织损伤,诱发各类疾病。近年来,越来越多的研究表明,广泛存在于植物界的黄酮类化合物不但能螯合金属离子,发挥抗氧化的作用,而且当黄酮类化合物螯合三价铬、二价铜、二价钴等金属离子后,其抗氧化作用明显增强[20-22]。以上研究说明黄酮类化合物在治疗铁过载性疾病方面具有一定效果。
3.2黄酮类化合物对铁缺乏的调控已知黄酮类化合物具有螯合铁的能力,为了测试姜黄素的螯合剂活性是否足以诱发体内铁缺乏,潜在触发或恶化缺铁性疾病,将小鼠置于含有不同浓度的铁和姜黄素的饮食中26周。膳食中不含姜黄素的情况下,尽管相对于标准铁膳食小鼠,低铁膳食小鼠的肝脏和脾脏中储存铁含量被耗尽,但小鼠膳食铁含量的改变没有影响造血功能。在小鼠膳食缺铁情况下,姜黄素对系统性铁稳态有两个明显影响,导致红细胞容积、血红蛋白、血清铁、转铁蛋白饱和度呈剂量依赖性下降,血红蛋白含量过少的微小红细胞呈剂量依赖性增加,并且脾脏和肝脏中铁含量减少;通过抑制Hepcidin表达,增加FPN的表达,从而调节系统性铁平衡[23]。Hart等[24]研究表明,杨梅素、杨梅黄酮3-葡萄糖苷、槲皮素和槲皮素3-葡萄糖苷可以通过目前未知的机制,降低Caco-2细胞中Fn(一种铁储存蛋白)的含量,并且提高了Caco-2细胞对铁的吸收。Mu等[25]的研究结果表明,杨梅素通过靶向BMP/Smad通路,选择性抑制Smad1/5/8的磷酸化,抑制Hepcidin的表达,进而增加FPN的表达,促进细胞内铁的释放,增加铁的动员,使血清铁水平升高,脾铁水平下降,调节体内系统性铁稳态。杨梅素也增加小鼠红细胞数量、血红蛋白浓度和血红细胞容积,降低了平均红细胞容积,表明杨梅素促进红细胞生成,提高了小鼠的造血功能。这些发现表明杨梅素通过抑制Hepcidin的表达,在调节铁稳态和维持造血功能方面起关键作用。
4 结语
综上所述,自然界中抗氧化作用最强的黄酮类化合物具有很强的抑制活性氧、清除自由基和调控铁稳态的作用,同时副作用相对较小。近年来大量研究表明,黄酮类化合物在铁稳态调控中能够发挥重要作用,因此,黄酮类化合物有望开发为治疗铁稳态失衡性疾病的天然药物。