红花玉兰截干对矮化和生理的影响
陈思雨,贾忠奎,马履一,张山山,宁娜娜
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京 100083)
红花玉兰Magnolia wufengensis L.Y.Ma et L.R.Wang又名五峰玉兰,是北京林业大学马履一教授及其所率团队于2004年在湖北五峰考察时发现并于2006年正式发表的木兰科木兰属玉兰亚属新种[1]。红花玉兰为高大落叶乔木,生长在海拔1 500 m天然次生林中,最高可达30 m,先花后叶,花大且芬芳,花部形态变异丰富,花型有月季型、荷花型等,花被片内外全红,花瓣数目9~46瓣不等,是极佳的园林绿化树种[2]。作为庭院观赏植物,红花玉兰过于高大有两大劣势,一是会挤占过多空间,妨碍其余观赏树种及花草生长,二是不能与其余观赏树种形成和谐的整体性,过于高大使庭院植物的垂直空间分布出现断层,影响整体观赏效果;作为室内盆栽,红花玉兰过高也有两大不便,一是不能适应室内有限的高度,二是过于高大意味着盆栽质量的增加,过重不便于室内盆栽移动。红花玉兰有突出的观花效果,将红花玉兰矮化成庭院矮小乔木或室内盆栽,能充分发挥其观赏价值和经济价值。
目前对红花玉兰已展开多方面的研究,如播种育苗技术、物候期、种质资源等等[3-8],却缺少关于红花玉兰矮化相关的研究。国内外已开展多方面的乔木树种矮化相关试验,可为红花玉兰矮化提供参考。常用的矮化方法可大致分为化学手段和物理方法,化学手段主要有施用植物生长延缓剂[9]、病毒矮化、辐射致矮等,物理方法主要包括密集矮化、嫁接矮化砧、修剪矮化等。适度修剪可改善植株生理[10],并改善冠型,调整叶幕微气候[11],修剪还能促进幼树侧枝生长[12]。修剪矮化的重要手段之一是截干,截干是指将苗木主干在一定高度截断,去除苗木顶端优势,使直干性下降,促使侧枝萌发,有利于树木后期形成良好的树形条件,板栗Castanea mollissimaBL.的低干矮冠树形不仅树体矮化,而且果量高于其它树形[13]。为了探讨截干处理对红花玉兰矮化效果的处理,本人参考前人的工作经验研究红花玉兰最佳截干矮化处理及其效果,为后续开展矮化工作奠定技术基础。
1 材料与方法
1.1 试验材料与试验地概况
试验于2016年7月1日开始,试验地位于湖北宜昌五峰土家族自治县。该地为亚热带季风气候,夏季炎热多雨,冬季寒冷有雪,是典型的山地气候,平均海拔1 100 m,也是红花玉兰的原生地。选用接穗直径、株高基本一致、长势健康的红花玉兰娇红2号1年生嫁接苗Magnolia wufengensis‘JiaoHong2’作为试验材料,嫁接苗砧木为规格一致的2年生望春玉兰Magnolia biondiiPamp.,该批苗木于2015年秋季进行嫁接,嫁接方式为单芽腹接,2016年5月份剪砧。
1.2 试验设计
试验共设置4个处理,在红花玉兰嫁接苗的生长旺季(2016年7月1日)分别截去株高的1/4、1/3、1/2和不截干对照,试验所用苗木的基底数据和截干后高度见表1,每个处理以9株苗木为小区,重复3次,试验田间布设采取完全随机区组设计。截干处理后由于高温高湿的气候环境,应特别注意苗木的养护工作,及时消毒和涂抹保护剂。

表1 试验苗木截干前后基底数据†Table 1 The base data of the seedlings
1.3 试验方法
每个处理有27株红花玉兰嫁接苗,分别对其进行标记和进行营养生长调查。试验开始后于2017年7月完成红花玉兰嫁接苗的株高、接穗基部直径的测量工作,并记录节数和侧枝数,其中株高是指从嫁接口到接穗顶端的垂直高度,接穗直径从嫁接口上方5 cm处测量。
在测量的同时进行采样,在试验每个处理中随机摘取1~3叶位功能叶,用锡纸包裹,做好标记。过液氮,将采得的样品放在干冰中立即带回实验室,于-80 ℃超低温冰箱中保存,保存期限不超过6个月。后续尽快进行超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)、可溶性糖、可溶性蛋白这5种生理指标的测定工作。其中超氧化物歧化酶(SOD)采用NBT 还原法测定[14];过氧化物酶(POD)采用愈创木酚显色法进行测定[15];丙二醛(MDA)采用硫代巴比妥酸法测定[16];可溶性糖使用蒽酮法测定[17];可溶性蛋白采用考马斯亮蓝法测定[18]。
2 结果分析
2.1 截干对形态的影响
不同截干强度影响红花玉兰嫁接苗的形态,主要体现在株高、接穗直径、侧枝数量上,试验结果见图1~图3。
2.1.1 截干对株高的影响
根据图1可知,截干对株高有显著影响,株高随着截干强度的增加而逐渐降低,当截干1/2时,株高达到最矮,在该处理下平均株高为120.71 cm,是不截干处理平均株高222.78 cm的54.18%,截干处理对矮化红花玉兰嫁接苗矮化效果显著。同时经过多重比较,不截干、截干1/4和截干1/3这3个处理两两之间互相差异显著,截干1/3和截干1/2这两个处理的平均株高差异不显著,截干1/2的株高是截干1/3的89.45%,因此对株高而言矮化效果最好的处理是截干1/2或截干1/3。
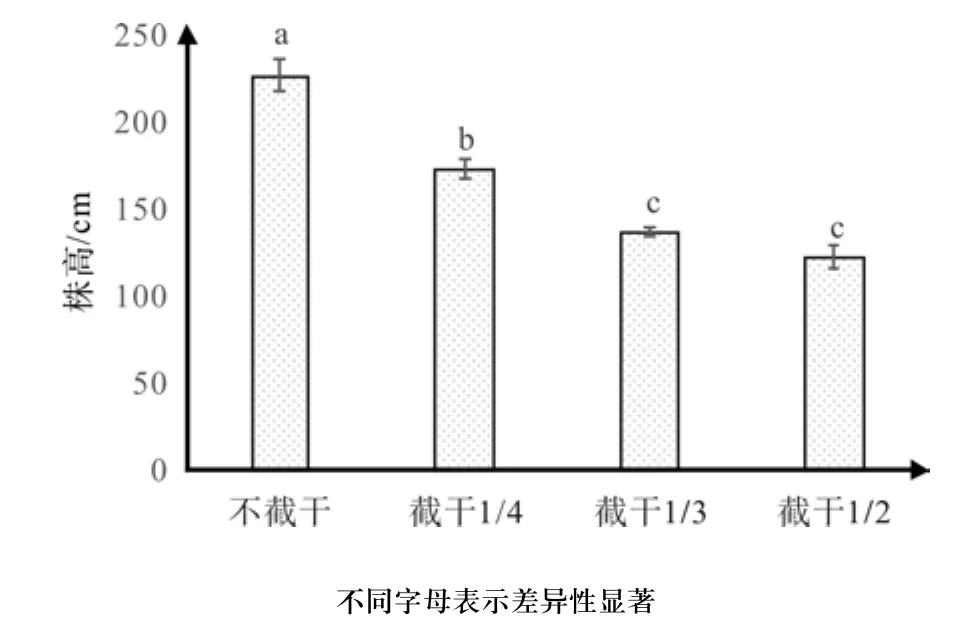
图1 不同截干处理对红花玉兰株高的影响Fig. 1 Effects of different cutting strunk treatments on height of Magnolia wufengensis
2.1.2 截干对接穗直径的影响
根据图2可知,截干对红花玉兰嫁接苗有显著的影响,接穗直径呈现出随着截干强度的增强而下降的趋势。当截干强度为1/2时,接穗直径最小,为14.62 mm,是不截干处理平均接穗直径18.83 mm的77.66%,该规律与株高相吻合。同时经过多重比较,不截干、截干1/4以及截干1/3这3个处理两两之间互相差异显著,而截干1/3和截干1/2差异不显著。
2.1.3 截干对侧枝数量的影响
根据图3可知,截干处理对红花玉兰嫁接苗单株的侧株数量有显著影响,侧枝数量随着截干强度的增加而减少,当截干1/2时侧枝数量最少,平均数量为5.07,是不截干处理平均侧枝数量15.62的32.49%,同时经过多重比较,除截干1/3和1/2这二者之间差异不显著之外,其余处理两两之间互相差异显著。综上所述,截干处理可有效减少侧枝数量,当截干1/2时侧枝数达到最少。
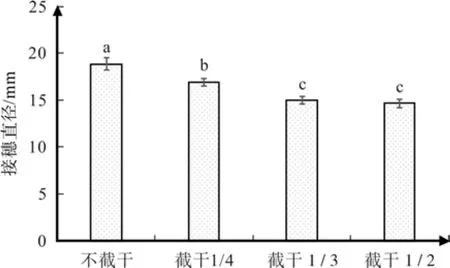
图2 不同截干处理对红花玉兰接穗直径的影响Fig. 2 Effects of different cutting strunk treatments onscion diameter of Magnolia wufengensis
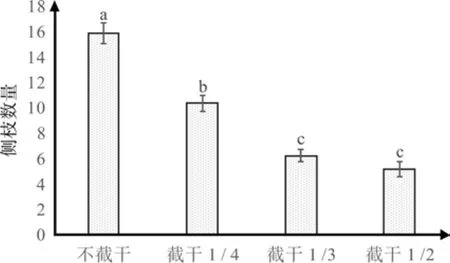
图3 不同截干处理对红花玉兰侧枝数量的影响Fig. 3 Effects of different cutting strunk treatments on the number of side branches of Magnolia wufengensis
2.1.4 截干对形态影响小结
根据上述试验结果,截干能有效矮化红花玉兰嫁接苗,当截干1/2时可实现株高最矮,接穗直径最小,侧枝数量最少,该处理平均株高为120.71 cm,平均接穗直径14.62 mm,平均侧枝数量5.07枝,分别是对照的54.18%、77.66%、32.49%。目前对截干矮化的研究大部分集中在老龄母树和盆景制作上,前者的研究主要集中在经过截干后老龄树木焕发生机,萌生侧芽,促进新枝萌发,从而恢复长势,实现树木复壮,恢复其观赏或者经济价值[19-22],而后者的研究主要集中在盆景制作上,通过截干可促进盆景植物侧芽萌发,从而获得理想的盆景造型[23],其中有关幼树截干矮化的研究较为稀少。然而要矮化高大乔木,从幼树开始进行有极大的优势,幼树纸条柔嫩,便于操作,有较强的可塑性和极大的发展前景,幼树生长几年后,其乔木树种高大的特性和独特的树形基本定型,此时再进行修剪矮化无疑会大大地加大矮化的难度,也不利于塑造理想的矮化树形[24]。在幼树期间进行截干处理只是乔木修剪矮化的第一步,后续可根据红花玉兰嫁接苗的生长情况相应调整修剪方式和方法。从目前截干矮化的结果来看,该方法对红花玉兰嫁接苗的矮化效果是十分明显的,非常有助于开展后续的修剪矮化工作。
2.2 截干对生理的影响
不同截干强度影响红花玉兰嫁接苗的生理,主要体现在超氧化物歧化酶(SOD)、过氧化物酶(POD)、可溶性蛋白、丙二醛(MDA)、可溶性糖上,试验结果见图4~图8。
2.2.1 截干对SOD活性的影响
根据图4的结果,红花玉兰嫁接苗体内SOD的活性随着截干强度的上升具有先增强后减弱的趋向,当截干强度为1/3时SOD活性达到最高,该处理的平均SOD活性为291.12 U·mg-1,是不截干处理平均值213.45 U·mg-1的136.38%。经过多重比较,不截干和截干1/3这两个处理之间存在显著差异,而截干1/3和截干1/2差异不显著。总结上述结论,当截干强度处于一定范围时,SOD活性会随着截干强度的上升而增强,当超过一定范围时,过强的截干强度会使SOD活性减弱。SOD是一种植株内常见的生物酶,它的主要作用是可以清除氧自由基,从SOD的活性水平在一定程度上可看出植株抗逆性强弱,SOD活性越高则可以表明该植株拥有更强的抗性,具有更强的应对不良环境的能力[25-26],本次试验中,截干处理在一定强度范围时可提高SOD活性,当截干1/3时,SOD活性最强,而截干1/2处理的SOD活性虽然弱于1/3,但仍然强于不截干处理。
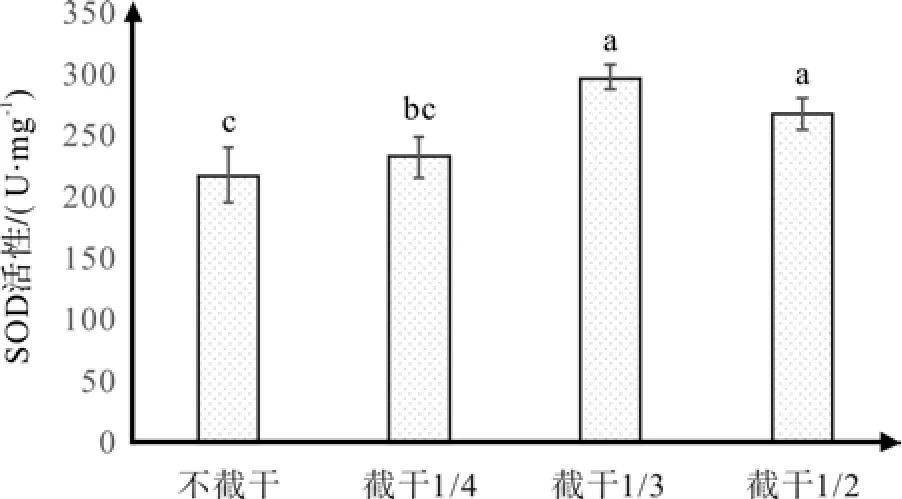
图4 不同截干处理对红花玉兰SOD活性的影响Fig. 4 Effects of different cutting strunk treatments on SOD activity of Magnolia wufengensis
2.2.2 截干对POD活性的影响
根据图5,红花玉兰嫁接苗体内的POD活性随着截干强度的增强呈现减弱的趋势,当截干1/2时POD活性最低,为532.89 U·mg-1min-1,当不截干时POD活性最高,为630.21 U·mg-1min-1。经过多重比较,不截干和截干1/4之间差异不显著,其它处理两两之间互相差异显著。POD和植物呼吸作用以及光合作用有密切的联系。在本次试验中,POD活性随着截干强度的上升而减弱,与SOD活性变化的大致趋势相反,可能原因如下:一是截干打破了红花玉兰嫁接苗的顶端优势,使其植株体内内源激素比例和含量等发生变化;二是POD活性相比SOD活性可能对截干后续反应更加敏感,SOD活性在截干强度超过一定范围时才出现下降的趋势,POD却是从截干开始就呈减弱趋势[27]。
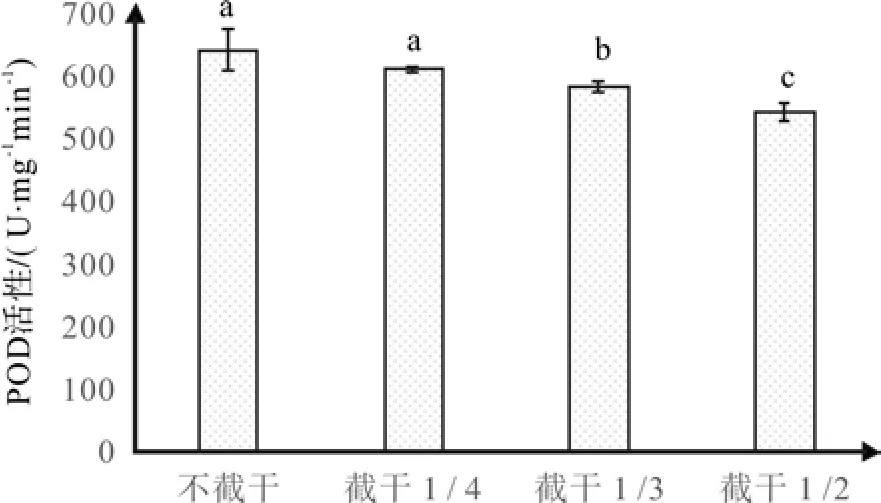
图5 不同截干处理对红花玉兰POD活性的影响Fig. 5 Effects of different cutting strunk treatments on POD activity of Magnolia wufengensis
2.2.3 截干对可溶性蛋白含量的影响
根据图6的试验结果,红花玉兰嫁接苗中可溶性蛋白含量随着截干强度的增强呈现减少的趋势,当截干1/2时红花玉兰可溶性蛋白含量最低,为12.03 mg·g-1,其含量水平是不截干处理平均可溶性蛋白含量23.69 mg·g-1的50.79%。同样经多重比较,这4个不同截干强度两两之间均互相差异显著。综上可得出结论,截干强度的增强可显著减少红花玉兰植株的可溶性蛋白含量。可溶性蛋白与POD活性变化规律相一致,同样是随着截干强度的增强而含量减少,原因可能与POD相同,同样说明截干会使植株应对不良环境的能力减弱。
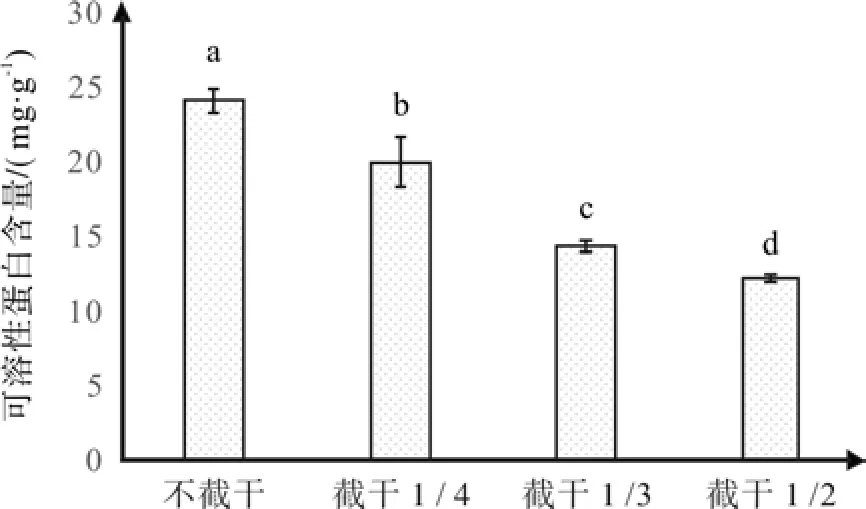
图6 不同截干处理对红花玉兰可溶性蛋白含量的影响Fig. 6 Effects of different cutting strunk treatments on soluble protein content of Magnolia wufengensis
2.2.4 截干对MDA含量的影响
根据图7所示,随着截干强度的逐渐增强,红花玉兰嫁接苗的MDA含量逐渐增多,当截干强度达到1/2时,MDA含量最高,为13.79 umol·g-1,是不截干处理平均MDA含量8.77 umol·g-1的157.28%,同样通过多重比较,这4个处理的MDA含量两两之间均互相差异显著。MDA是植株抗性的重要指标之一[28],代表膜系统受伤程度,其含量越高,膜系统受伤越严重。本次试验中, MDA含量随着截干强度的增强而增多,这说明红花玉兰在截干过后膜系统收到伤害,受伤害程度与截干强度呈正相关,并且1年内该伤害都无法靠植株自身进行恢复。
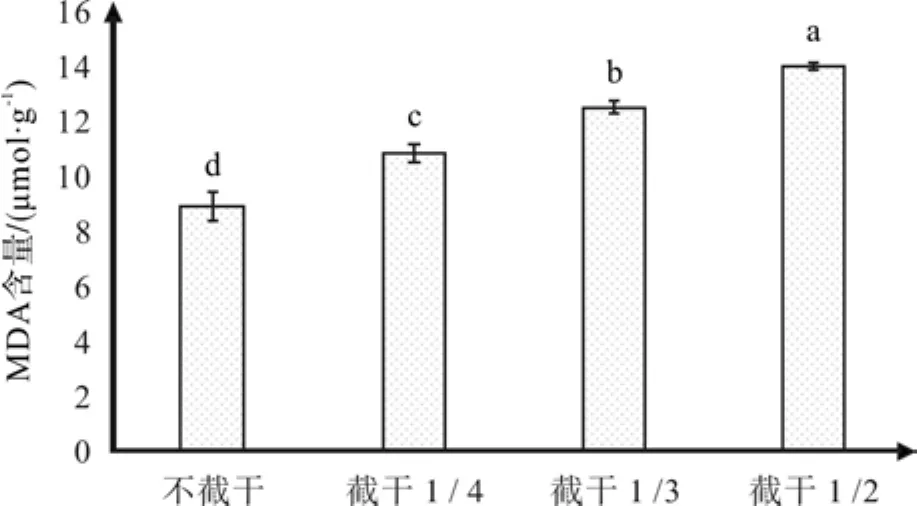
图7 不同截干处理对红花玉兰MDA含量的影响Fig. 7 Effects of different cutting strunk treatments on MDA content of Magnolia wufengensis
2.2.5 截干对可溶性糖含量的影响
根据图8的试验结果,截干强度增强,红花玉兰嫁接苗的可溶性糖含量反而呈现降低的趋向。当截干强度为1/2时,该处理红花玉兰的可溶性糖含量达最低水平,为4.62 mmol·g-1,是不截干处理平均可溶性糖含量6.21 mmol·g-1的74.32%,同时通过多重比较,不截干和截干1/4之间差异显著,而截干1/4、1/3、1/2这3个处理互相差异不显著。可溶性蛋白、可溶性糖对植株具有重要作用,植株在逆境时可通过改变体内二者含量来适应环境。其不同时间在不同植株体内或处于不同环境下,含量均有所差异,二者同样与植株的抗逆性有较为密切的联系[29]。无独有偶,这两种物质与抗性的一般规律是,可溶性蛋白、可溶性糖在植物体内的含量越高,那么植物在一定程度上的抗性越强[30]。而在本次试验中,可溶性蛋白、可溶性糖与POD活性变化规律相一致,随着截干强度的增强而含量减少,这也同样能说明截干会使植株抗性下降。
2.2.6 截干对生理影响小结
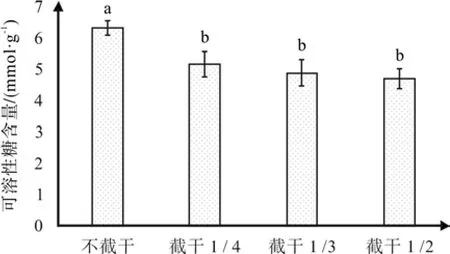
图8 不同截干处理对红花玉兰可溶性糖含量的影响Fig. 8 Effects of different cutting strunk treatments on soluble sugar content of Magnolia wufengensis
截干处理对红花玉兰嫁接苗生理有着显著的影响,具体表现为SOD活性随着截干强度的增强具有先增强后减弱的趋向,同时红花玉兰嫁接苗的POD活性、可溶性糖、可溶性蛋白的含量这3个生理指标则随着截干强度的增强而呈现减少的趋向,MDA含量却是相反,随着截干强度的加强而增多,说明植株在截干后抗性有所下降。对红花玉兰嫁接苗进行截干处理,本质是去除顶端优势,红花玉兰作为乔木树种,直干性较强,若没有人为手段加以控制,红花玉兰在生长初期特别容易长成细高杆树形。虽然同样是去除顶端优势,但是截干的程度不同,植株体内激素水平也会有所差异,对红花玉兰嫁接苗的生理产生不同的影响。
SOD、POD、可溶性蛋白、MDA、可溶性糖都是植株抗性的相关指标,从这些指标的变化来看,截干过后植株普遍出现抗性下降的情况。事实上修剪本身对植株而言就是一种伤害,特别是从主干位置下手截干,虽然截干后有涂抹保护剂和精心养护,在本试验中生理指标的测定是在截干1年后进行,植株恢复时间较短,可能经过更长时间恢复后,植株应对不良环境的能力有所恢复,或者通过其它手段和方式增强嫁接苗抗性,如喷施相关药剂等。
综上所述,虽然截干矮化效果非常理想,但是在矮化过程中要注意红花玉兰嫁接苗应对不良环境能力的变化,注意及时开展苗木养护工作。在截干1年后,截干过的植株抗性从数据上来看普遍低于对照,而后续植株生理的恢复需要进一步的观察。
3 讨 论
本次截干矮化试验只是探讨红花玉兰修剪矮化的第一步,后续将根据红花玉兰嫁接苗的实际生长情况进行进一步的修剪,期望得到合理且美观的红花玉兰矮化树形。除修剪树形外,常用的修剪矮化措施还包括环剥、环刻、拉枝等,后续也将针对这些修剪矮化措施进行相关试验。
本试验虽成功矮化红花玉兰嫁接苗,但在矮化过程中使生理指标发生改变,导致抗性下降,若抗性强则红花玉兰可以适应多变的气候条件,在更多地区生长,能让更多人认识和欣赏红花玉兰这个木兰属中唯一的红色花朵的美丽。因此,在后续的矮化试验中应当考虑在不使植株过于长高的前提下通过一定化学手段来增强红花玉兰嫁接苗的抗性,比如施用植物生长延缓剂,这样不仅能使红花玉兰矮化,更能在一定程度上提高其抗性,这也是一种目前可行的矮化方式。
本次试验所用苗木均为红花玉兰娇红2号1年生嫁接苗,嫁接苗砧木为2年生规格相同的望春玉兰,对红花玉兰而言,嫁接本身就是一种矮化措施。望春玉兰虽然也是乔木,但将红花玉兰嫁接其上能表现出一定的矮化效果,同年的红花玉兰嫁接苗矮于实生苗。因此根据嫁接矮化的特性,可挑选适当的红花玉兰砧木嫁接,实现进一步的矮化。关于嫁接矮化的试验目前也有人员进行研究,相信假以时日必会发现适合红花玉兰的矮化砧。
4 结 论
截干对红花玉兰嫁接苗而言是一种理想的矮化方法,矮化效果显著,耗费人力物力少,成本低,见效快。截干过后的植株经过1年生长以后,最佳矮化处理是截干1/2,该处理株高最矮,接穗直径最小,侧枝数量最少,平均株高为120.71 cm,是不截干处理222.78 cm的54.18%,平均接穗直径14.62 mm,是对照的77.66%,侧枝平均数量为5.07,是不截干的32.49%。然而截干过后,红花玉兰嫁接苗的生理有所改变,植株抗性下降,具体表现为SOD活性随着截干强度的增强具有先增强后减弱的趋势, POD活性、可溶性糖、可溶性蛋白的含量这3个生理指标随着截干强度的增强呈现减少的趋向,MDA含量则相反,随着截干强度的加强而增多,截干1/2处理的SOD、POD活性、可溶性蛋白、MDA、可溶性糖含量分别是对照的122.57%、84.56%、50.79%、157.28%、74.32%。综上所述,截干是一种切实可行的矮化方法,它可有效矮化红花玉兰嫁接苗,最佳矮化处理是截干1/2,截干1/2处理的平均株高在生长1年后是不截干对照的50%左右,但截干过后植株抗性下降,应注意后续养护。

