铬和镁联合补充对糖耐量异常患者miRNA差异表达的研究
张方华 许爱梅 李盈 王晔 高珊 姚民秀
青岛大学医学院第二附属医院1内分泌科;2中心实验室(山东青岛 266042)
糖尿病是世界范围内发病率和病死率最高的疾病之一。2017年全国慢性非传染性疾病预防控制中心发布的调查显示我国糖尿病患病率达10.9%,糖尿病前期患病率为35.7%[1]。糖尿病在世界范围内呈爆发性增长,糖尿病及糖尿病前期的防治刻不容缓。Cr3+是维持正常葡萄糖、胰岛素和脂肪代谢所必需的微量元素。铬摄入量不足可以增加患糖尿病的危险性。镁是细胞内含量最丰富的第二大阳离子,作为高能磷酸化代谢途径酶的必需辅助因子参与能量代谢、蛋白合成和调节细胞膜的葡萄糖转运。微小RNA(microRNA,miRNA)是长度约为22个核苷酸的短链非编码RNA,主要是通过转录抑制作用或者mRNA的降解作用,导致沉默其靶基因的表达,从而实现其对靶基因的表达调控。研究表明,微小RNA可以通过其对靶基因的调控,影响糖耐量[2]。笔者前期的研究表明,补充铬、镁可降低IGT患者血糖,但具体机制不清。本研究通过高通量测序技术(next generation sequencing,NGS)探讨Cr3+和Mg2+联合补充对糖耐量异常患者循环miRNA表达的影响,筛查表达差异miRNA,探讨在糖尿病前期通过微量元素的补充逆转疾病进程的可能的分子机制。
1 对象与方法
1.1 研究对象 选取青岛大学第二临床医学院(青岛市中心医院)2015年1月至2015年12月期间45~59岁的IGT者(符合1999年WHO诊断标准),排除高镁血症、恶性肿瘤及冠心病患者;为治疗疾病而服用各种药物者。本研究经青岛大学第二临床医学院伦理委员会批准,所有受试者均签署知情同意书。自愿参加并签订知情同意书者作为研究对象。本研究分为3组,分别是年龄相匹配的正常对照组(10人)、安慰剂对照组(60人)、铬(120 μg/d)+镁(200 mg/d)干预组(60人),干预时间为3个月。
1.2 实验方法 干预前后测定入组患者的空腹血糖(fasting plasma glucose,FPG)、负荷后2 h血糖(2 hours post glucose⁃load,2 h PG)、空腹胰岛素(fasting insulin,Fins)、血脂水平。按照常规方法进行血压、体重、身高及腰围、臀围的测量。计算体重指数(body mass index,BMI=体重/身高2)。计算腰臀比(waist and hip ratio,WHR=腰围/臀围)。血糖测定采用葡糖糖氧化酶法,电化学发光法测定Fins,全自动生化分析仪检测血脂水平。计算胰岛素抵抗指数(HOMA⁃IR=Fins X FPG/22.5)。
1.3 miRNA测序 循环miRNA的提取采用美国Qiagen公司的miRNeasy血清/血浆提取试剂盒。采用NGS技术,检测3组人群循环miRNA的表达。
1.4 荧光定量PCR(qPCR) miRNA的qPCR引物购于广州市锐博生物科技有限公司(ribobio)。采用SYBR法。采用2⁃ddCT法进行数据分析,内参基因为miR⁃191⁃5p和miR⁃16⁃5p。
1.5 miR⁃182⁃5p和miR⁃96⁃5p功能富集分析 上述预测出的共同靶基因进行gene ontology(GO)与Kyoto Encyclopedia of Genes and Genomes(KEGG)信号通路分析,采用的软件为美国Arraystar公司的分析软件。
1.6 统计学方法 采用GraphPad软件,qPCR的结果以±s表示。临床数据采用±s的形式表示。应用非配对t检验及单因素方差分析进行比较。P<0.05表示差异有统计学意义。
2 结果
2.1 受试者的临床特征 受试者OGTT均符合糖耐量异常诊断标准:FPG≥6.1 mmol/L~<7.0 mmol/L,2 h PG≥ 7.8 mmol/L~<11.1 mmol/L。共入组130人,其中正常对照组10人、安慰剂对照组60人、铬镁干预组60人。脱落2人,其中铬镁干预组1例失访,对照组1例发现肺部恶性肿瘤退出。三组患者年龄匹配(P>0.05)。入组前对照组、铬镁干预组FBG、2hPG、Fins等均无统计学差异(表1)。干预3个月后,铬镁干预组FBG、2 h PG、HOMA⁃IR均较对照组降低,而两组BMI、WHR、Fins及血脂无统计学差异。见表2。
表1 所有入选受试者入组时一般资料Tab.1 General information of all selected subjects before the intervention ±s

表1 所有入选受试者入组时一般资料Tab.1 General information of all selected subjects before the intervention ±s
组别年龄(岁)性别男/女(%)BMI(kg/m2)FPG(mmol/L)2hPG(mmol/L)Fins(uIU/mL)HOMA⁃IR TG(mmol/L)TC(mmol/L)LDL⁃c(mmol/L)HDL⁃c(mmol/L)WHR正常对照组(n=10)52.89±3.14 4/6(40%)23.75±3.13 4.71±0.54 6.28±0.13 7.40±3.86 1.59±0.81 1.35±1.12 5.02±0.67 2.68±0.78 1.46±0.41 0.82±0.05安慰剂对照组(n=60)52.67±2.65 23/26(38%)24.08±2.51 5.62±0.67 9.46±0.68 13.51±8.03 3.36±2.46 1.96±0.61 5.32±1.02 3.24±0.79 1.30±0.39 0.88±0.06铬镁干预组(n=60)53.01±3.11 24/25(40%)24.16±3.08 5.78±0.66 9.47±0.78 13.40±8.17 3.44±1.91 2.01±0.68 5.37±0.97 3.19±1.28 1.29±0.43 0.89±0.06
2.2 miRNA的差异表达 提取血浆miRNA后,应用Illumina测序技术进行测序。在3组血浆样本中,共检测得到了263个miRNA可与人类的参比前体miRNA相匹配。在这些miRNA中,得到了6个差异表达的循环miRNA,分别为miR⁃182⁃5p、miR⁃96⁃5、miR⁃27b、miR⁃21、miR⁃379和miR⁃143,在安慰剂对照组、铬镁干预组差异有显著性,如表3所示。
2.3 qPCR的结果 为了验证Illumina测序的结果,笔者对上述的6个差异表达的循环miRNA,miR⁃182⁃5p、miR⁃96⁃5p、miR⁃27b、miR⁃21、miR⁃379和miR⁃143,在3组样本中进行了qPCR的验证。结果表明,仅有miR⁃182⁃5p、miR⁃96⁃5p和miR⁃27b的表达趋势与测序结果相同,验证了测序结果。结果如图1所示。
2.4 miR⁃182⁃5p与miR⁃96⁃5p的功能富集分析miR⁃182⁃5p靶基因的功能富集分析发现与214个GO条目有关,这214个条目可以分为54个与分子功能相关,67个与细胞组份相关,93个与生物学过程相关。信号通路分析表明,与之相关的信号通路是葡萄糖结合通路(图2)。miR⁃96⁃5p靶基因的功能富集分析发现与184个GO条目有关,这184个条目可以分为41个与分子功能相关,59个与细胞组份相关,84个与生物学过程相关。信号通路分析表明,与之相关的信号通路是phosphati⁃dylinositol signaling pathway(磷脂酰肌醇信号通路)通路(图3)。
表2 干预前后各临床指标变化Tab.2 Changes of clinical data before and after intervention ±s

表2 干预前后各临床指标变化Tab.2 Changes of clinical data before and after intervention ±s
注:与安慰剂对照组相比,*P<0.05
组别安慰剂对照组铬镁干预组t值P值例数59 59 FBG(mmol/L)干预前5.62±0.67 5.78±0.66 1.30 0.19干预后5.57±1.35 5.01±1.52*2.11 0.03 2 h PG(mmol/L)干预前9.46±0.68 9.47±0.78 1.26 0.20干预后9.14±1.78 7.76±2.57*3.39 0.001 Fins(uIU/mL)干预前13.51±8.03 13.40±8.17 0.07 0.91干预后12.49±6.37 12.67±5.41 0.16 0.86组别安慰剂对照组铬镁干预组t值P值例数59 59 HOMA⁃IR干预前3.36±2.46 3.44±1.91 0.19 0.84干预后3.11±2.23 2.32±1.83*2.11 0.03 WHR干预前0.88±0.06 0.89±0.06 0.90 0.36干预后0.86±0.07 0.84±0.08 3.39 0.001 BMI(kg/m2)干预前24.08±2.51 24.16±3.08 0.15 0.87干预后23.51±2.55 24.11±2.87 1.20 0.23组别安慰剂对照组铬镁干预组t值P值例数59 59 TG(mmol/L)干预前1.96±0.61 2.01±0.68 0.42 0.67干预后1.86±1.02 1.57±0.84 1.68 0.09 TC(mmol/L)干预前5.32±1.02 5.37±0.97 0.27 0.78干预后4.91±0.87 4.84±0.81 0.45 0.65 LDL⁃c(mmol/L)干预前3.24±0.79 3.19±1.28 0.25 0.78干预后3.13±0.82 3.01±0.75 0.82 0.40 HDL⁃c(mmol/L)干预前1.30±0.39 1.29±0.43 0.13 0.88干预后1.46±0.31 1.42±0.53 0.50 0.61

表3 NGS测序结果Tab.3 NGS sequencing results
3 讨论

图1 定量PCR的结果Fig.1 Results of quantitative PCR
糖尿病严重影响患者生存质量,甚至危及生命,其病死率大于艾滋病、结核病和疟疾病死率的总和,大约每6秒就有一个糖尿病患者死亡。从早期的代谢异常到糖尿病的过渡,即从空腹血糖受损(impaired fasting glucose,IFG)和IGT到临床糖尿病可能需要很多年;然而,大多数IFG、IGT人群最终发展为糖尿病。IFG和IGT代表糖耐量正常人群与糖尿病之间的中间状态。
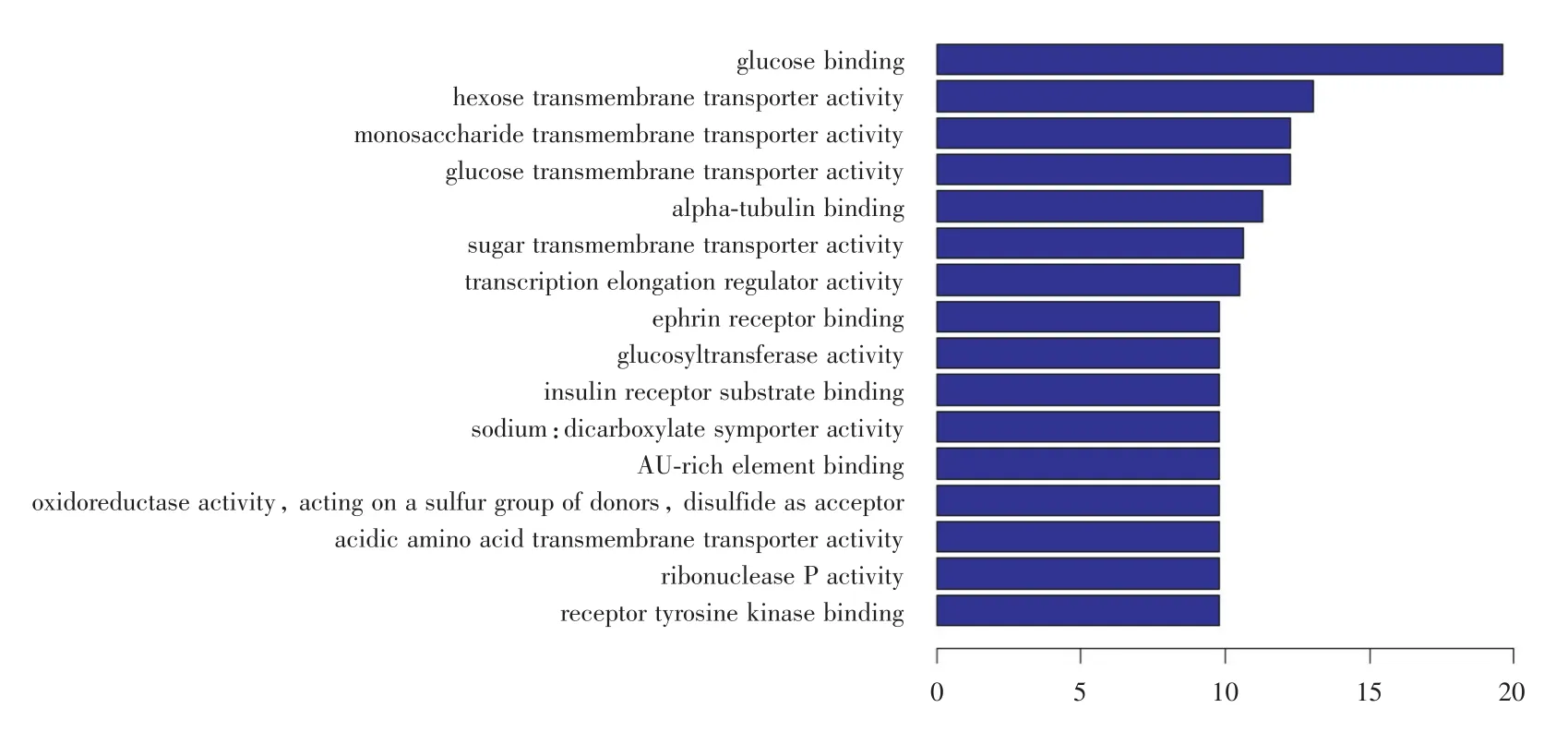
图2 miR⁃182⁃5p的功能富集分析Fig.2 miR⁃182⁃5p′s functional enrichment analysis

图3 miR⁃96⁃5p的功能富集分析Fig.3 miR⁃96⁃5p′s functional enrichment analysis
铬(三价)和镁在能量物质代谢过程中发挥关键作用,是维持正常葡萄糖、胰岛素和脂肪代谢所必需的微量元素,其与胰岛素抵抗的关系一直以来是研究的热点。铬是维持正常葡萄糖、胰岛素和脂肪代谢所必需的微量元素。以往的研究发现,铬可以通过增强胰岛素与细胞结合、增加胰岛素受体数量、提高胰岛β细胞敏感性、增强胰岛素内摄和激活胰岛素受体激酶来增加胰岛素敏感性。铬(三价)在碳水化合物、脂类和蛋白质代谢中起着重要作用;然而,其在分子水平上的作用机制尚不完全清楚。KROL等[3]研究发现Cr3+可以改善由IL⁃6、TNF⁃α、C反应蛋白、单核细胞趋化蛋白-1以及细胞间黏附分子1(ICAM⁃1)诱导的糖尿病大鼠的炎症反应。镁是很多能量代谢酶的辅酶,镁缺乏参与了胰岛素抵抗的形成。本研究发现补充微量元素铬镁后,IGT患者血糖降低,胰岛素抵抗得以改善。
有研究表明,miRNA通过作用于多个通路促进胰岛素分泌或调节胰岛素抵抗,其可能成为治疗糖尿病的新靶点。李伟等[4]发现,妊娠糖尿病患者胎盘组织miRNA表达异常,且与胰岛素信号通路多个靶点有关。目前有很多报道是关于潜在的miRNA作为2型糖尿病的生物标志物的研究。ZAMPETAKI等[5]报道了在患者发生2型糖尿病前的数年,其血浆miR⁃15a,miR⁃28⁃3p,miR⁃29b,miR⁃126和miR⁃223的表达已发生改变。另外的一项研究发现了7种血清来源的miRNAs(miR⁃9,miR⁃29a,miR⁃30d,miR⁃34a,miR⁃124a,miR⁃146a,and miR⁃375),与NGT的人群相比,这7种血清来源的miRNAs的表达在T2DM患者人群显著升高[6]。
本研究中发现微量元素铬镁联合补充降低血糖,改善胰岛素抵抗的同时,可增加血浆中miR⁃182⁃5p和miR⁃96⁃5p的表达。miR⁃182⁃5p和miR⁃96⁃5p属于miR⁃183/96/182基因簇,2003年首先在视网膜中被发现,以后又陆续在成骨细胞、淋巴细胞、视网膜和内耳组织中被相继发现。miR⁃182⁃5p可能通过调控胰岛素的合成参与糖尿病发生。在MIN6胰岛β细胞和原代胰岛细胞中敲除miR⁃182后,将导致胰岛素合成减少,其机制可能是敲除miR⁃182后胰岛素基因的转录抑制因子Bhlhe22(basic helix⁃loophelix family,member 22)表达上调,胰岛素基因启动子转录活性降低。研究表明,miR⁃182与胰岛素抵抗有关,还与胰岛素信号通路(IGF⁃1)相关。miR⁃182通过调节肌肉葡萄糖的利用从而调控糖代谢的平衡[7]。miR⁃96通过InsR与IRS⁃1基因抑制饮食诱导的饱和脂肪酸加重肝脏胰岛素抵抗[8]。
综上所述,联合补充铬镁可降低IGT患者血糖,改善胰岛素抵抗。IGT患者miR⁃182⁃5p和miR⁃96⁃5p表达降低,补充铬镁后可使 miR⁃182⁃5p和miR⁃96⁃5p表达升高。联合补充微量元素铬和镁可能通过增强miR⁃182⁃5p和miR⁃96⁃5p表达,而改善IGT患者的糖耐量。

