沉默结缔组织生长因子对酒精性肝纤维化干预效果的研究
崔小伟 刘晓智
1天津市滨海新区大港医院消化内科(天津 300270);2天津市第五中心医院中心实验室(天津 300450)
过度饮酒已成为世界范围内引起肝脏损害的主要原因,而慢性长期酒精滥用会引起肝脏的炎症、纤维化,甚至进而发展为肝硬化,酒精性肝硬化发病率呈不断上升趋势,严重危害了人们的身体健康,给家庭和国家带来了沉重负担[1-2],在美国和欧洲,酒精性肝硬化是肝移植的第二大适应证[3],酒精性肝硬化发生腹水及发展成肝癌的风险均高于丙肝肝硬化,虽然已经证明戒酒及大量糖皮质激素的应用可以改善酒精性肝纤维化患者的存活率,但仍有40%的严重患者治疗后无效[4]。迄今为止尚没有能够逆转或抑制酒精性肝硬化病情恶化的有效药物,因此抑制酒精性肝纤维化的进展成为了人们十分重视却无法解决的难题。本研究以酒精性肝纤维化发病机制中较具研究价值的分子靶点——结缔组织生长因子(connective tissue growth factor,CTGF)作为药物作用对象,选择当前具有良好应用前景且相对成熟的RNAi(small interfering RNA,siRNA)技术为治疗手段,利用体内、外实验模式,对CTGF被抑制后对酒精性肝纤维化的进展进行实验性研究。
1 材料与方法
1.1 试剂和动物 鼠肝星形细胞HSC⁃T6购自上海肿瘤研究所,胎牛血清(杭州四季青),改良Eagle培养基(dulbecco′s modified Eagle′s medium,DMEM)、青链霉素和胰蛋白酶(Gibco公司),Lipo⁃fectamine 2000(美国Invitrogene公司);靶向CTGF的siRNA由武汉晶赛生物技术有限公司合成;CTGF、Ⅰ和Ⅲ型胶原抗体(美国Chemicon公司)。雄性SD大鼠40只,购自中国军事医学科学院动物中心,饲养于中国协和医科大学血液病研究所实验动物中心,饲养条件为无菌,温度20~25℃,湿度(50±5)%。
1.2 细胞培养与基因转染 肝星形细胞HSC⁃T6培养于含10%胎牛血清的DMEM中,培养条件为37℃、5%CO2,且饱和湿度。隔天换液,每3~4天传代1次。实验分组:(1)脂质体组:仅加入Lipo⁃fectamineTM2000脂质体;(2)无义序列组:加入NS⁃siR⁃CTGF/Lipofectamine⁃2000 脂质体复合物;(3)siR⁃CTGF组:加入siR⁃CTGF/Lipofectamine⁃2000 脂质体复合物。细胞生长至约70%~85%融合时,进行基因转染,G418筛选,获得稳定基因转染的肝星形细胞HSC⁃T6。
1.3 MTT实验 于96孔板中按1×104个细胞/孔进行细胞接种,于培养第1、2、3、4、5、6天行MTT实验,在酶标仪上测定各孔波长570 nm的光吸收值,记录结果并绘制细胞生长曲线;实验过程中设置空白对照组,3个平行孔。
1.4 细胞凋亡检测 消化收集上述3组细胞,PBS重悬,在流式细胞仪上检测。按照AnnexinV/PI染色试剂盒说明加入固定破膜剂和PI染液,室温避光反应30 min,荧光显微镜下随机检测10个高倍视野,比较各组凋亡细胞的比例。
1.5 Western blot方法 提取细胞总蛋白,Brad⁃ford法蛋白定量后,使用8%分离胶电泳,冰浴下 100 V转膜60 min。CTGF(1∶1 000)、Ⅰ型胶原(1∶1 000)和Ⅲ型胶原(1∶2 000),4℃水平摇床孵育过夜,次日使用辣根酶标记的1∶500稀释二抗孵育1 h。凝胶成像系统扫描光密度值,Quantity One软件进行定量分析。
1.6 动物模型的建立 以SD大鼠为实验对象,用蒸馏水配制含40%酒精的白酒,按10 mL/kg每日分2次灌胃造模4周,第5周酒精浓度升至50%,继续每日分2次灌胃8周。8周末,随机选取3只大鼠处死观察肝脏组织病理学变化以确定造模成功,病理分级标准参照王泰龄法[5]。选36只大鼠模型随机分为3组,每组12只。(1)脂质体组,采用门静脉灌注方法注射Lipofectamine⁃2000脂质体,每次注射1 mL,每3天重复注射一次。(2)无义序列组,以 20 μg/mL 的浓度注射NS⁃siR⁃CTGF/Lipo⁃fectamine⁃2000脂质体复合物,每次注射 1 mL,每3天重复注射一次。(3)siR⁃CTGF组:以siR⁃CTGF/Lipofectamine⁃2000脂质体复合物代替NS⁃siR⁃CTGF/Lipofectamine⁃2000脂质体复合物,其他步骤同前。各组于造模起第12周末处死大鼠,采集血清及肝组织标本待测相关指标。
1.7 血清ALT、AST与TBIL含量检测 应用半自动生化分析仪测定血清ALT、AST与TBIL含量。
1.8 肝组织形态学检测与免疫组织化学分析 常规石蜡包埋,切片,行常规苏木精-伊红染色,光镜下观察肝组织病理改变,病理学医师对观察结果进行肝纤维化病理学分级。免疫组织化学方法检测CTGF的表达,CTGF抗体稀释浓度为1∶1 000,DAB法显色。
1.9 统计学方法 应用SPSS 13.0统计软件,计量资料数据以±s表示,采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 MTT结果 接受单纯脂质体转染的肝星形细胞 HSC⁃T6 和接受NS⁃siR⁃CTGF/Lipofectamine⁃2000脂质体复合物转染的细胞生长速度相似,但接受siR⁃CTGF/Lipofectamine⁃2000脂质体复合物转染的HSC⁃T6细胞增殖速度较前两者明显变慢,各时间点比较差异有统计学意义(P<0.05),见图1。
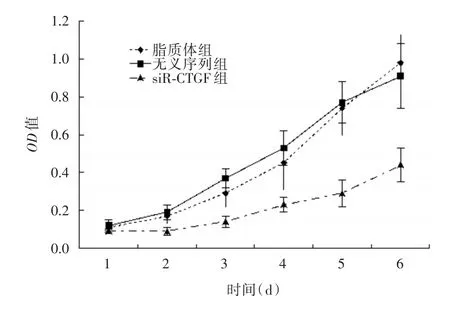
图1 不同实验组细胞生长曲线比较Fig.1 Comparison of growth curve of cells from different groups
2.2 细胞凋亡结果 见图2,红色信号示处于凋亡早期的阳性细胞核,通过10个高倍视野计数比较发现脂质体组细胞凋亡率为(1.73±0.39)%,无义序列组细胞凋亡率为(1.98±0.42)%,二组间比较差异无统计学意义(t=4.17,P> 0.05);siR⁃CT⁃GF组细胞凋亡率为(21.32±6.45)%,与前两组比较差异有统计学意义(F=119.49,P<0.01)。
2.3 Western blot结果 脂质体组和无义序列组间CTGF、Ⅰ型胶原和Ⅲ型胶原的表达无明显差异(P>0.05),在siR⁃CTGF组上述三个检测指标均明显低于脂质体组和无义序列组,其中CTGF和Ⅲ型胶原与前两者比较差异有统计学意义(P<0.01),Ⅰ型胶原与前两者比较差异有统计学意义(P<0.05),见图3。
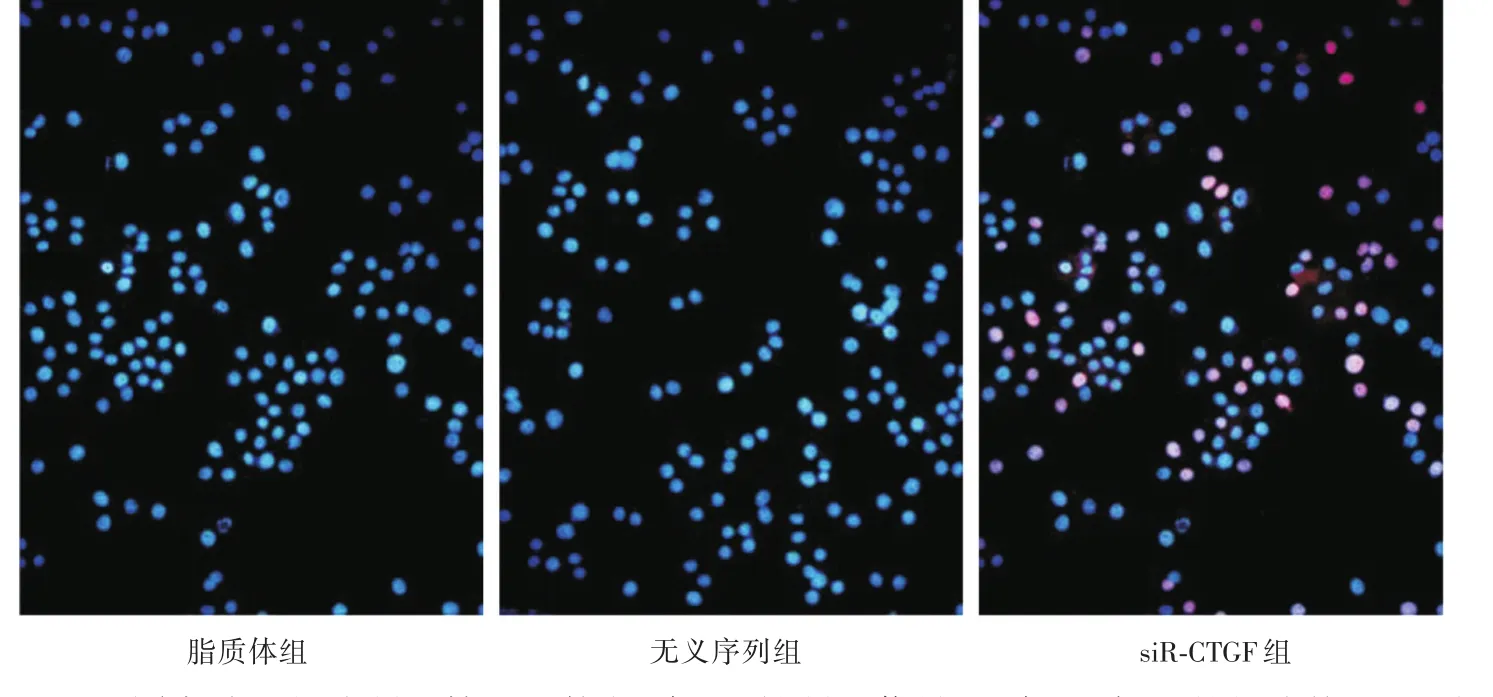
图2 不同实验组细胞凋亡情况比较(红色:阳性凋亡信号,蓝色:PI标记的细胞核,×200)Fig.2 Comparison of apoptosis from different groups(Red:positive apoptotic signals,Blue:nucleus labeled PI,× 200)
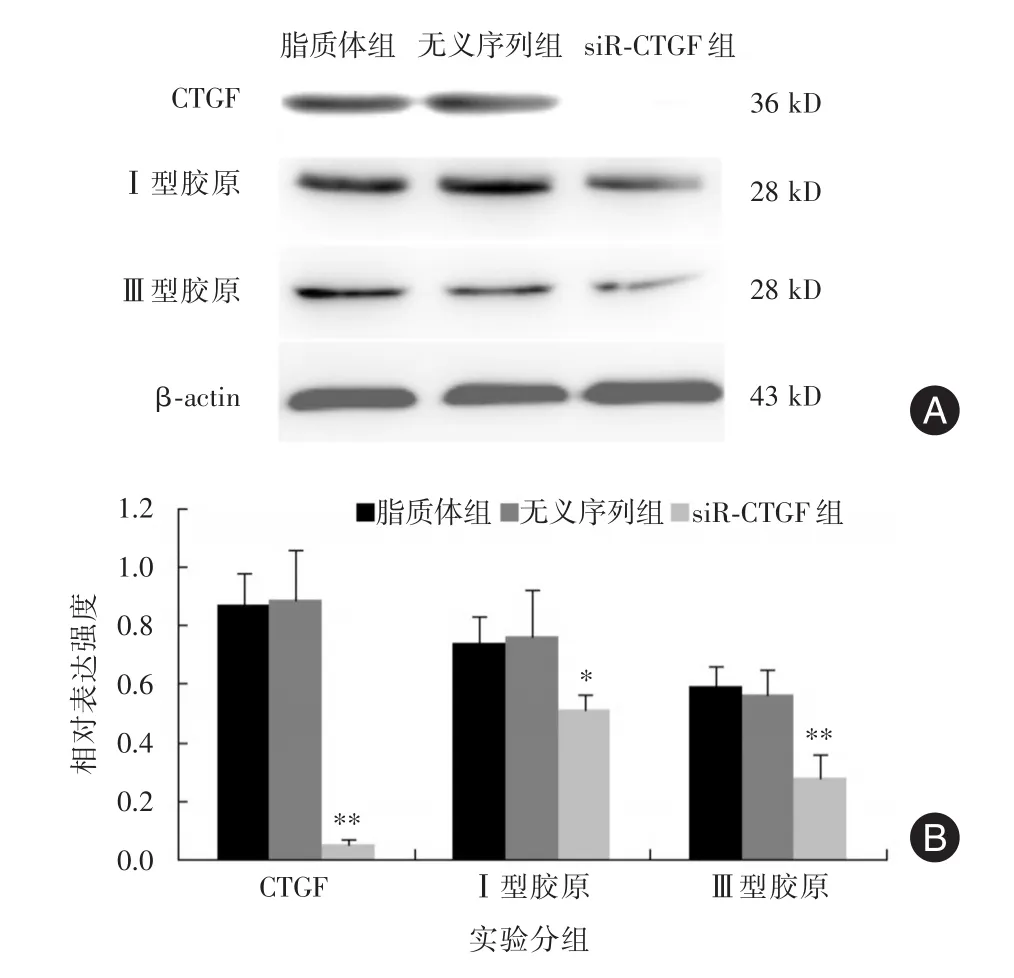
图3 不同实验组中特定蛋白的检测(A,Western blot结果;B,柱形图)Fig.3 Detection of specific proteins in different groups(A,Western blot results;B,Histogram)
2.4 肝功能比较 动物实验检测结果显示脂质体组和无义序列组间三个检测指标ALT、AST和TBIL比较无统计学差异(P>0.05),但siR⁃CTGF组各检测指标均明显低于前两组,提示肝功能有明显恢复,见表1。
2.5 造模结果
2.5.1 大鼠一般情况 大鼠精神萎靡,皮毛干燥、粗糙、无光泽,饮食量减少,体质量下降,大便不成形或干燥。
表1 各组间肝功能指标检测Tab.1 Liver function tests of different groups ±s
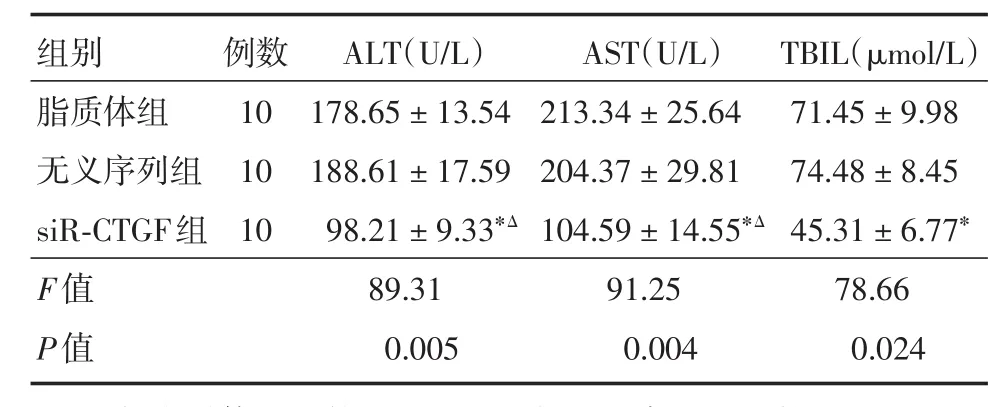
表1 各组间肝功能指标检测Tab.1 Liver function tests of different groups ±s
注:与脂质体组比较,*P<0.05;与无义序列组比较,ΔP<0.05
组别脂质体组无义序列组siR⁃CTGF组F值P值例数10 10 10 ALT(U/L)178.65±13.54 188.61±17.59 98.21 ± 9.33*Δ 89.31 0.005 AST(U/L)213.34±25.64 204.37±29.81 104.59 ± 14.55*Δ 91.25 0.004 TBIL(μmol/L)71.45±9.98 74.48±8.45 45.31±6.77*78.660.024
2.5.2 肝脏形态及病理学改变 造模大鼠肝脏表面凹凸不平,色泽晦暗,边缘变钝,镜下肝小叶结构紊乱,可见点灶状坏死,少数区域肝界板坏死,汇管区有炎症细胞浸润,胶原纤维沿汇管区及中央静脉周围向肝小叶内延伸,纤维间隔形成,为肝纤维化表现。
2.6 不同实验组组织病理学检测结果 见图4,可见在HE染色切片中,脂质体组和无义序列组中有大量直径较宽粗的纤维组织增生,较多的纤维间隔形成,肝小叶结构紊乱,但在siR⁃CTGF组中纤维组织及胶原减少、变细,纤维间隔变少,小叶结构变清晰,炎细胞浸润减轻,小叶间胆管增生减轻。在脂质体组和无义序列组免疫组化切片中可见CTGF表达增多,且主要表达于纤维组织增生部位,而在siR⁃CTGF组中CTGF的表达量要低于前两者。
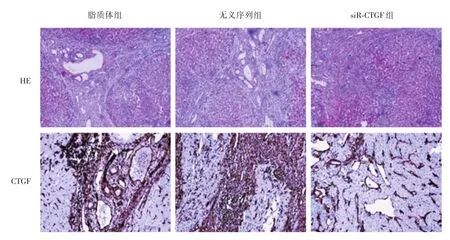
图4 不同实验组动物模型肝组织切片形态学与病理特征比较Fig.4 Comparison of morphological and pathological features of liver tissue slices of animal models from different groups
3 讨论
目前肝硬化作为一种全球性的疾病,居人类主要死因的第6位,而酒精性肝硬化的发病率逐渐升高,且呈年轻化的趋势[6],虽酒精性肝硬化的机制不明确,且不可逆,但其发展的必经阶段肝纤维化却是一个逐渐进展、且可逆的过程[7]。研究表明,肝纤维化发生过程的核心是肝脏星状细胞(hapatic stellate cells,HSC)的活化,活化的HSC有促进增殖、纤维形成、致炎和收缩作用,合成大量的细胞外基质(extracellular matrix,ECM),沉积于肝内,导致肝纤维化。因此抑制HSC活化,被认为是肝纤维化治疗的重要策略[2,8]。无论实验性还是临床肝纤维化都发现CTGF的高表达,且主要是在HSC中的表达上调[9],说明HSC是CTGF的主要来源,在HSC激活过程中CTGF表达增加。CT⁃GF可促进HSC活化、增殖,促进其移行,阻断CT⁃GF的表达可以抑制HSC⁃T6细胞的增殖,CTGF的持续过度表达可以上调Ⅰ型胶原蛋白质的mRNA及蛋白的表达水平,CTGF还可以作为一个独立的因素引起多个脏器的纤维化,因此在肝纤维化发生发展中起着关键作用[10-12]。RNAi是一种转录后基因沉默的强大工具,化学合成siRNA能在哺乳动物体内外介导同源基因沉默,从而具有治疗作用[13]。本研究以在酒精性肝纤维化领域涉及较少的CTGF为研究靶点,通过较成熟的RNAi技术,成功转染鼠肝星形细胞HSC⁃T6,并通过MTT法、细胞凋亡的检测,表明siRNA技术可以成功下调CTGF的表达并进一步抑制HSC的增殖,促进细胞凋亡,通过western blot方法的检测表明CTGF的表达下降可以减少在肝纤维化过程中起重要作用的Ⅰ、Ⅲ型胶原蛋白的表达,进而可以延缓肝纤维化的进展。
目前常用的酒精性肝病动物模型有急性酒精灌胃模型、慢性酒精喂养模型(Lieber⁃DeCarli模型)、胃内喂养模型(Tsukamoto⁃French模型)、“二次打击”或“多次打击”模型、慢性酒精喂养加急性酒精灌胃模型(Gao⁃binge模型)等方法[14-15],由于技术、经济等原因,国内研究者多采用急性酒精灌胃模型。本研究体内研究部分采用酒精灌胃模型建立酒精性肝纤维化的动物模型,模型大鼠的肝功能明显受损,肝小叶结构紊乱,汇管区有炎症细胞浸润,胶原纤维增生,纤维间隔形成,经治疗后,siR⁃CTGF组的ALT、AST、TBIL明显降低,提示肝功能恢复,同时免疫组化结果表明siR⁃CTGF治疗组的纤维组织及胶原减少、纤维间隔变少,小叶结构变清晰,小叶间胆管增生减轻,纤维化程度减轻[5]。表明siRNA技术可能通过抑制CTGF的表达进而抑制肝纤维化的进程。
总之,本研究通过体内、体外实验证明,siRNA干扰技术可以降低HSC⁃T6细胞CTGF的表达,抑制细胞增殖,促进细胞凋亡,促进Ⅰ和Ⅲ型胶原蛋白表达下降,改善肝功能及肝纤维化程度,对于酒精性肝纤维化的发展可能有一定的抑制作用。CTGF可以成为延缓肝纤维化的一个潜在的治疗靶点[16]。但是,本研究也仅是动物实验及体外细胞的研究,目前并不适用于临床,而且也只是能延缓鼠肝纤维化的进展但并不能完全逆转肝硬化,下一步仍然需要大量的实验与临床工作相结合以进一步了解肝硬化的发病机制,进而找到适用于临床的有效的治疗手段。

