优化人脐血间充质干细胞方法的建立
孙海梅 杨 姝 吴 波 孙婷怡 周德山 季凤清
(首都医科大学人体解剖与组织胚胎学系,北京 100069)
人脐带血(human umbilical cord blood, HUCB)是胎儿出生时脐带内及胎盘近胎儿一侧血管内的血液,已有研究[1]证明人脐血中含有丰富的造血干细胞及间充质干细胞(mesenchymal stem cells, MSCs)。人脐血间充质干细胞(cord blood-mesenchymal stem cells,CB-MSCs)其形态和生物学特点与骨髓MSCs极为相似,同样具有自我更新和多向分化的潜能,在一定的实验条件下可以分化为骨、脂肪、肌肉,甚至可以跨胚层分化为神经样细胞[2-3],这就为细胞移植提供了一种新的种子细胞来源。
然而,目前在CB-MSCs过程中,往往出现纯度不高,且常有大量的混杂细胞,因此,建立优化的CB-MSCs分离纯化方法,将有助于获得更高纯度和丰度的CB-MSCs。人羊膜组织是胚胎发育的早期产物,由于人羊膜具有无毒、无菌、无刺激性、抗微生物、分泌多种细胞生长因子、不表达人类白细胞ABC抗原(human leukocyte antigen-ABC,HLA-ABC)和人类白细胞DR抗原(human leukocyte antigen-DR,HLA-DR)抗原、易于获得和处理等特性[4],近十几年来广泛应用于组织工程和临床移植治疗,尤其在眼科应用更多,但是利用羊膜上皮细胞分离纯化CB-MSCs的研究方法仍鲜有报道。
本研究利用插入式培养皿共培养人羊膜上皮细胞和分离出的人脐血单个核细胞,观察培养细胞的生长状况;通过免疫荧光染色观察 CB-MSCs表达干细胞特异性抗原神经巢蛋白Nestin和反映细胞增生的核抗原Ki67的情况;应用流式细胞技术检测CB-MSCs表面标志物CD166的表达。探讨利用羊膜上皮细胞共培养法优化CB-MSCs的培养条件,提高CB-MSCs的纯度的可行性,为纯化CB-MSCs提供一种新方法。
1 材料与方法
1.1 材料
1.1.1 标本材料
脐带血取自首都医科大学宣武医院产科健康育龄产妇足月正常产或剖宫产产妇,同时采集分娩的羊膜组织,获得所有患者的知情同意(伦理号:2013-X-036)。
1.1.2 试剂材料
HG-DMEM培养基和胰蛋白酶(trypsin)(美国Gibco公司);肝素(Heparin,粉剂,140 U/mg,北京双螺旋生物培养基制品厂);羊血清、胎牛血清(fetal bovine serum,FBS)(美国Hyclone公司);甲基纤维素(美国Sigma公司);人淋巴细胞分离液(d=1.077 g/mL,天津TBD公司);兔抗神经巢蛋白(Nestin)和增生细胞相关抗原Ki67多克隆抗体(美国Abcam公司);小鼠抗人CD166-PE(美国BD PharMingen公司);FITC标记山羊抗兔IgG(美国Chemicon公司);Hoechst33342(美国Sigma公司),6孔插入式培养皿(美国Millicell公司);荧光显微镜(日本Nikon公司)。
1.2 试验方法
1.2.1 羊膜上皮细胞的分离及培养
从健康产妇分娩的胎盘组织胎儿面小心剥离羊膜全层,剪取0.5 cm×0.5 cm组织块行常规石蜡包埋和HE染色。其余羊膜组织置入预冷的PBS中彻底清洗干净后,自羊膜与绒毛膜间的潜在空隙钝性分离出羊膜上皮层,浸于PBS中清洗2次,用眼科剪剪成糜状,移至含0.2%(质量分数)胰蛋白酶的HG-DMEM培养液中,置于37 ℃水浴摇床消化30 min,用等体积的HG-DMEM完全培养基[含10%(质量分数)FBS、105 U/L青霉素和105 U/L链霉素]终止消化,150目筛网过滤2次,收集细胞,PBS重悬,离心洗涤2次,弃上清,用HG-DMEM完全培养基重悬细胞,台盼蓝计数细胞后,以5×105/mL的密度接种于插入式培养皿中,置于37 ℃、5%(体积分数) CO2的培养箱中培养。2~3 d细胞完全贴壁后全量换液。
1.2.2 脐血单个核细胞的分离及培养
无菌条件下采集健康新生儿的脐血40~60 mL,20 U/mL肝素抗凝,无菌PBS等体积稀释,按 1∶4比例加入0.5%(质量分数)甲基纤维素PBS溶液,混匀,静置40~60 min后,红细胞沉于底部,吸取血浆层离心,弃上清,PBS重悬,制备成单细胞悬液,轻柔叠加至装有等体积人淋巴细胞分离液的离心管中,离心20 min(1 800 r/min,慢起慢降),离心后用吸管小心吸取中间的白膜细胞层至另一离心管中,PBS离心洗涤3次,再用HG-DMEM完全培养基重悬细胞,以3×106/mL的密度接种在6孔板中(孔中预置盖玻片),置于37 ℃、5%(体积分数) CO2的培养箱中培养。根据细胞生长情况,每2~3 d半量换液1次,待细胞完全贴壁后全量换液。
1.2.3 脐血单个核细胞与羊膜上皮细胞共培养
脐血单个核细胞于6孔板中生长3 d完全贴壁,全量换液后分2组进行培养:(1)常规培养组:加入4 mL HG-DMEM完全培养基培养;(2)羊膜共培养组:将培养羊膜上皮细胞(60%~70%融合度)的插入式培养皿放入培养脐血单个核细胞的6孔板内,内外各加入2 mL HG-DMEM完全培养基。倒置显微镜下观察CB-MSCs生长情况和形态变化。
1.2.4 免疫荧光染色检测CB-MSCs表面标志物Nestin和增生细胞相关抗原Ki67
培养5 d后,取出生长有CB-MSCs的盖玻片,4%(质量分数)多聚甲醛溶液固定,PBS洗3次,3%(体积分数) H2O2-甲醇溶液室温孵育30 min,阻断内源性过氧化物酶,PBS洗3次,羊血清封闭,室温孵育30 min,弃去羊血清,分别滴加兔抗Nestin抗体(浓度1∶200)、兔抗Ki67抗体(浓度1∶100),4 ℃过夜,PBS洗3遍,滴加FITC标记的山羊抗兔荧光二抗(浓度1∶200),37 ℃避光孵育30 min,PBS洗3遍,滴加Hoechst 33342(0.05 g/L)复染细胞核,室温避光孵育3 min,荧光封片剂封片后在荧光显微镜下观察染色结果。
1.2.5 流式细胞仪检测CB-MSCs表面标志物CD166
培养5 d后,胰酶消化CB-MSCs,PBS洗3次,取细胞浓度为1×106/mL的细胞悬液100 μL,加入20 μL小鼠抗CD166抗体标记细胞,室温避光孵育30 min,离心弃去染液,PBS洗2次,制备成500 μL单细胞悬液,上机检测。阴性对照组采用同型对照抗体。
2 结果
2.1 人羊膜组织 HE染色及培养羊膜上皮细胞的形态学观察
对人羊膜组织石蜡切片进行HE染色可见人羊膜分为5层:上皮细胞层、基底膜层、致密层、纤维细胞层及海绵层(图1A);羊膜上皮细胞层由无纤毛的立方上皮细胞或低柱状细胞组成(图1B)。分离培养的羊膜上皮细胞2 d后可贴壁生长,3~5d可达到60%~70%融合状态(图2A);羊膜上皮细胞呈多角形或不规则形,边界清晰,形态大小基本一致,胞核较大,呈圆形,位于细胞中央(图2B)。
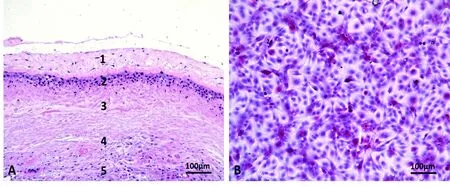
图1 人羊膜组织HE染色Fig.1 HE staining shows human amniotic tissue
A: five layers of amniotic tissue;1: amnion endothelial cell layer;2: basal membrane layer;3: compact layer;4: fibrocyte layer;5: spongy layer;B: amniotic epithelial cells.
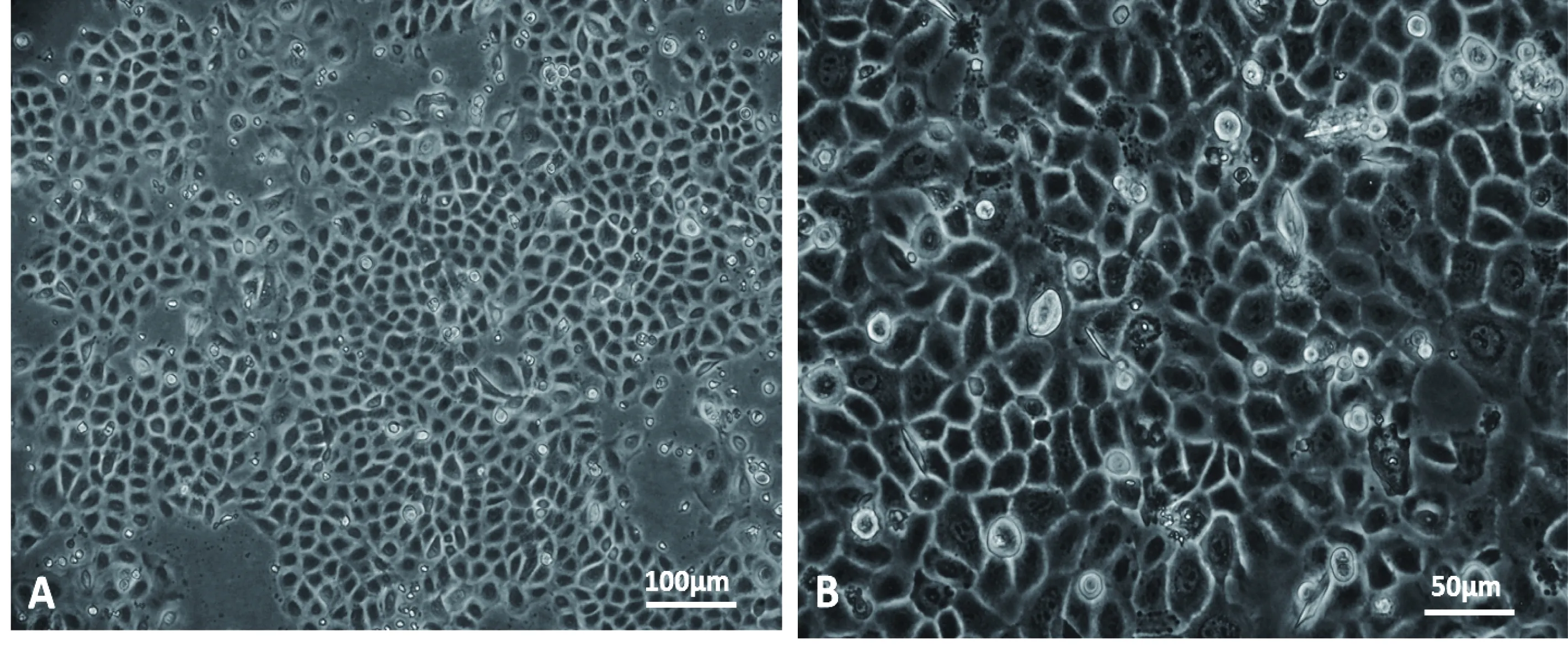
图2 培养人羊膜上皮细胞Fig.2 Cultured human amniotic epithelial cells
2.2 不同培养条件下CB-MSCs的形态学观察和比较
刚接种时的脐血单个核细胞呈悬浮状态,24 h后细胞开始逐渐贴壁;接种3 d左右大量细胞贴壁,细胞聚集生长,形成较多的岛状或巢样的细胞团(图3)。此时将脐血单个核细胞分成常规培养组和与人羊膜上皮细胞共培养组,继续培养5 d后可见两组细胞均增大,形态饱满,由圆形向卵圆形、纺锤形、梭形变化,大量细胞伸出较长突起,逐渐出现典型的MSCs样形态特点(图4)。共培养组(图4A)较常规培养组(图4B)的CB-MSCs细胞密度更大,带有突起,呈纺锤形或梭形的细胞数量更多,细胞状态更佳。

图3 人脐血单个核细胞培养3 d时的巢样细胞团Fig.3 Typical nest of cultured mononuclear cells fromumbilical cord blood on day 3

图4 不同培养条件下的CB-MSCsFig.4 CB-MSCs cultured under different conditions
2.3 Nestin和Ki67免疫荧光染色
两组细胞均可见阳性细胞:Nestin表达在细胞质内(图5绿色),而Ki67表达在细胞核内(图5绿色),与复染蓝色荧光的细胞核叠加而呈淡蓝色(图6)。经比较发现:共培养组(图5A)Nestin阳性的CB-MSCs数量和比例均明显高于常规培养组(图5B);此外,共培养组(图6A)Ki67阳性的CB-MSCs数量亦明显多于常规培养组(图6B)。

图5 免疫荧光显示Nestin在CB-MSCs的表达Fig.5 Immunofluorescence staining shows Nestin expression in CB-MSCsA: co-cultured with human amniotic epithelial cells; B: regular cultured;CB-MSCs:cord blood-mesenchymal stem cells.

图6 免疫荧光显示Ki67在CB-MSCs的表达Fig.6 Immunofluorescence staining shows Ki67 expression in CB-MSCsA: co-cultured with human amniotic epithelial cells; B: regular cultured;CB-MSCs:cord blood-mesenchymal stem cells.
2.4 流式细胞术检测CB-MSCs表面标志物CD166的表达
共培养组CB-MSCs中表达CD166的阳性细胞率约为79.8%(图7),显著高于常规培养组,其CD166的阳性细胞率约为50.2%(图8)。

图7 流式细胞术检测CD166在共培养组CB-MSCs的表达Fig.7 Flow cytometry shows CD166 expression in CB-MSCs co-cultured with human amniotic epithelial cells
A: isotype antibody control;B: co-cultured with human amniotic epithelial cells;CB-MSCs: cord blood-mesenchymal stem cells.

图8 流式细胞术检测CD166在常规培养组CB-MSCs的表达Fig.8 Flow cytometry shows CD166 expression in CB-MSCs regularly culturedA: isotype antibody control; B: regular cultured; CB-MSCs: cord blood-mesenchymal stem cells.
3 讨论
有文献[5-6]报道,为了获取更多高纯度的MSCs,采用了多种方法:如单纯使用某种细胞生长因子或加入富含多种生长因子的细胞上清液,以促进其增生和定向诱导分化。目前已证实羊膜上皮细胞可分泌多种细胞生长因子,这些生长因子能够促进MSCs的生长和诱导分化[7-8]。本实验应用插入式培养皿将羊膜上皮细胞与人脐血单个核细胞共培养,结果表明,与常规培养方法相比,共培养法可获得更多的CB-MSCs,且CB-MSCs的增生能力更强。从方法上看,共培养法具有以下优势:(1) 人羊膜组织来源丰富,易于取材,免疫原性低,羊膜上皮细胞与脐血干细胞的来源同属一人,更具有组织相容性,不会引起免疫排斥反应,不涉及伦理道德等优点; (2)共培养法不仅克服了单纯使用营养因子的用量和比例不易掌握的问题,也比使用羊膜上皮细胞上清液处理CB-MSCs更新鲜、更动态和更持续;(3) 生长状态下的羊膜上皮细胞可持续分泌多种促进CB-MSCs生长、增生和定向分化的营养因子,如多效生长因子PTN,更有利于模拟CB-MSCs细胞生长的微环境。综上,利用插入式培养皿将人羊膜上皮细胞与人CB-MSCs共培养,可以较大地提高CB-MSCs的纯度和数量,为纯化CB-MSCs提供一种新途径。

