脑特异性血管抑制因子-1在宫颈鳞癌中的表达及其与人乳头瘤病毒感染的关系
张俊俊 王 焱 杜趁香 晋熙梦
(1.河南科技大学临床医学院,河南洛阳 471003;2.河南科技大学第一附属医院妇科,河南洛阳 471003; 3.郑州大学人民医院产科,郑州 450003)
子宫颈癌(cervical cancer)在中国发生率居女性生殖器恶性肿瘤的首位,以鳞癌为主,其发病率、病死率近年均有升高趋势,且发病年龄年轻化[1-2],严重威胁着我国女性的健康及生命安全[3]。子宫颈癌的发生及进展是一个多因素、多步骤参与的复杂过程,目前研究[4-5]已证实高危型人乳头瘤病毒(human papillomavirus,HPV)持续感染是导致宫颈癌发生的最主要原因,99.7%的宫颈癌患者中能检测到HPV-DNA的存在[6]。目前虽然宫颈癌筛查技术有所提高及预防性HPV疫苗的应用,但仍存在假阴性的问题且预防性疫苗对已经存在的HPV感染和HPV相关的病变没有治疗作用[7];在临床治疗中,宫颈癌的治疗主要依赖于手术根治及结合放射治疗和化学药物治疗(以下简称放化疗)的综合治疗等,但对于临床上大多数宫颈癌晚期及复发的患者,仍缺乏行之有效的治疗手段,因此寻找新的且确切的防治方法仍是我国面临的巨大难题。近年研究[8]显示,脑特异性血管抑制因子-1(brain-specific angiogenesis inhibitor-1,BAI-1)主要通过抑制由成纤维细胞生长因子(fibroblast growth factor,FGF)诱发的血管新生生成起作用,并且与多种恶性肿瘤关系密切;而且研究[9-11]表明BAI-1及HPV16E6/E7均与P53及FGF关系密切,猜测两者之间可能存在某种联系,而且目前尚无关于BAI-1在宫颈鳞癌方面的研究及与HPV感染关系的探讨。本研究通过SP法观察BAI-1因子在正常宫颈组织、宫颈癌前病变组织及宫颈鳞癌组织中的表达情况及与HPV感染的关系,探讨其与HPV导致的宫颈鳞癌发生、进展的关系。为宫颈鳞癌的防治及评估预后提供新的方向。
1 材料与方法
1.1 材料
宫颈标本来源于2014年10月至2016年10月河南科技大学第一附属新区医院中病例保存较完整,且患者术前均未行新辅助放化疗治疗的经宫颈活检及手术切除的宫颈组织,所有取材患者均在无其他治疗的情况下进行PCR反向点杂交法分型检测宫颈HPV-DNA感染情况,经 HE染色(图1)证实为宫颈鳞癌54例(经手术及活检术),宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)Ⅰ27例(经宫颈活检术),CINⅡ~Ⅲ34例(经宫颈锥切术),并收集同时间段30例来源于河南科技大学第一附属新区医院因患子宫肌瘤行子宫全切的正常宫颈组织作为对照;所有标本取材均通过医院伦理委员会许可。对54例宫颈鳞癌分组:临床分期(按2009年国际妇产科协会分期标准[12]):Ⅰ~Ⅱ期的34例,Ⅲ~Ⅳ期的有20例;分化程度:高分化28例,中~低分化26例;淋巴结有无转移(Ⅰ~Ⅱ期进行手术的34例经病理学诊断明确指出有无淋巴结移转的宫颈鳞癌患者):无淋巴结转移有15例,有转移则有19例。所有标本均经过通用常规的10%(体积分数)中性甲醛预先固定、常规石蜡包埋、4 μm厚连续切片处理,本实验的所有病理切片均经本院病理科的两到三位高年资主任医师相互印证后以明确诊断。
1.2 免疫组织化学检测
本实验的标本均经石蜡包埋,严格切片后经脱蜡、脱水、加热等处理,后滴加一抗,进行免疫组织化学染色(Envision法),实验步骤严格按试剂盒要求规范操作,本实验所用的BAI-1兔抗人多克隆抗体 (1∶100)购于美国Santa Cruz公司;二抗购于北京中杉金桥技术有限公司。以PBS替代一抗作为阴性对照。

图1 不同病变宫颈组织HE染色Fig.1 HE staining of different cervical lesions tissues(200×)
A: positive expression of BAI-1 in cervical intraepithelial neoplasia I tissue;B: positive expression of BAI-1 in cervical intraepithelial neoplasia Ⅲ tissue;C:positive expression of BAI-1 in cervical squamous cell carcinoma tissue;BAI-1:brain-specific angiogenesis inhibitor-1.
1.3 结果判断
在宫颈组织中BAI-1的阳性表达主要定位于细胞质及胞膜中,按染色的强弱及阳性细胞计数评分如下:棕褐色、棕黄色、淡黄色和无着色分别计为3、2、1、0分;每个高倍镜视野计数细胞100个,随机观察10个视野,取其平均值,按照0分:≤10%,1分:11% ~50%,2分:51%~80%, 3分:>80%;将两项得分结果相乘的结果作为最终评分,>3为阳性,≤3为阴性[13]。
1.4 统计学方法
采用SPSS 21.0进行统计学分析。计数资料用频数和百分数表示,组间比较采用χ2检验或Fisher 确切概率法。采用Spearman 相关系数表示两变量的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 BAI-1在宫颈不同病变组织中的表达
BAI-1的阳性表达主要定位于胞质和胞膜 (图2)。BAI-1 在正常宫颈组织、CIN Ⅰ、CINⅡ~Ⅲ及宫颈鳞癌组织中的阳性率逐步降低,分别为 96. 67%、74. 07%、44.11%、18.52.%,BAI-1在4组间的表达差异有统计学意义(χ2=54.232,P=0.000);且BAI-1在正常宫颈组织中的阳性表达(96. 67%)显著高于CIN Ⅰ(74. 07%)、CINⅡ~Ⅲ(44.11%)及宫颈鳞癌组(18.52.%),任意两组间比较差异均具有统计学意义(P<0.01),详见表1。
2.1 BAI-1的表达及与宫颈鳞癌各项临床病理指标的相关性
BAI-1在宫颈鳞癌中阳性表达与患者年龄、分化程度及有无淋巴结转移无关(P>0.05),而与临床分期有关(χ2=7.219,P=0.007),详见表2。
2.3 高危HPV-DNA在不同宫颈组织中的感染情况
高危HPV-DNA在正常宫颈组织、CIN Ⅰ、CINⅡ~Ⅲ及宫颈鳞癌中的感染率逐步升高,分别为6.67%、37.04 %、76.47%、100%,在4组间的表达差异有统计学意义(χ2=83.423,P=0.000);且高危HPV-DNA在宫颈鳞癌组织中的阳性感染率(100%)显著高于正常宫颈(6.67%)、CIN Ⅰ(37.04%)及CINⅡ~Ⅲ组(76.47%),任意两组间比较,差异均具有统计学意义(P<0.01),详见表3。
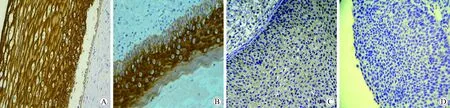
图2 BAI-1在宫颈不同病变组织中的免疫组织化学检测结果Fig.2 BAI-1 immunohistochemical results of different cervical lesions tissues(200×)
A: positive expression of BAI-1 in normal cervical tissue;B: positive expression of BAI-1 in intraepithelial neoplasia I tissue;C:positive expression of BAI-1 in cervical intraepithelial neoplasia Ⅲ tissue;D: positive expression of BAI-1 in cervical squamous cell carcinoma tissue;BAI-1:brain-specific angiogenesis inhibitor-1.

表1 BAI-1在宫颈不同病变组织中的表达Tab.1 The staining of BAI-1 in the different degree of cervical lesions tissues
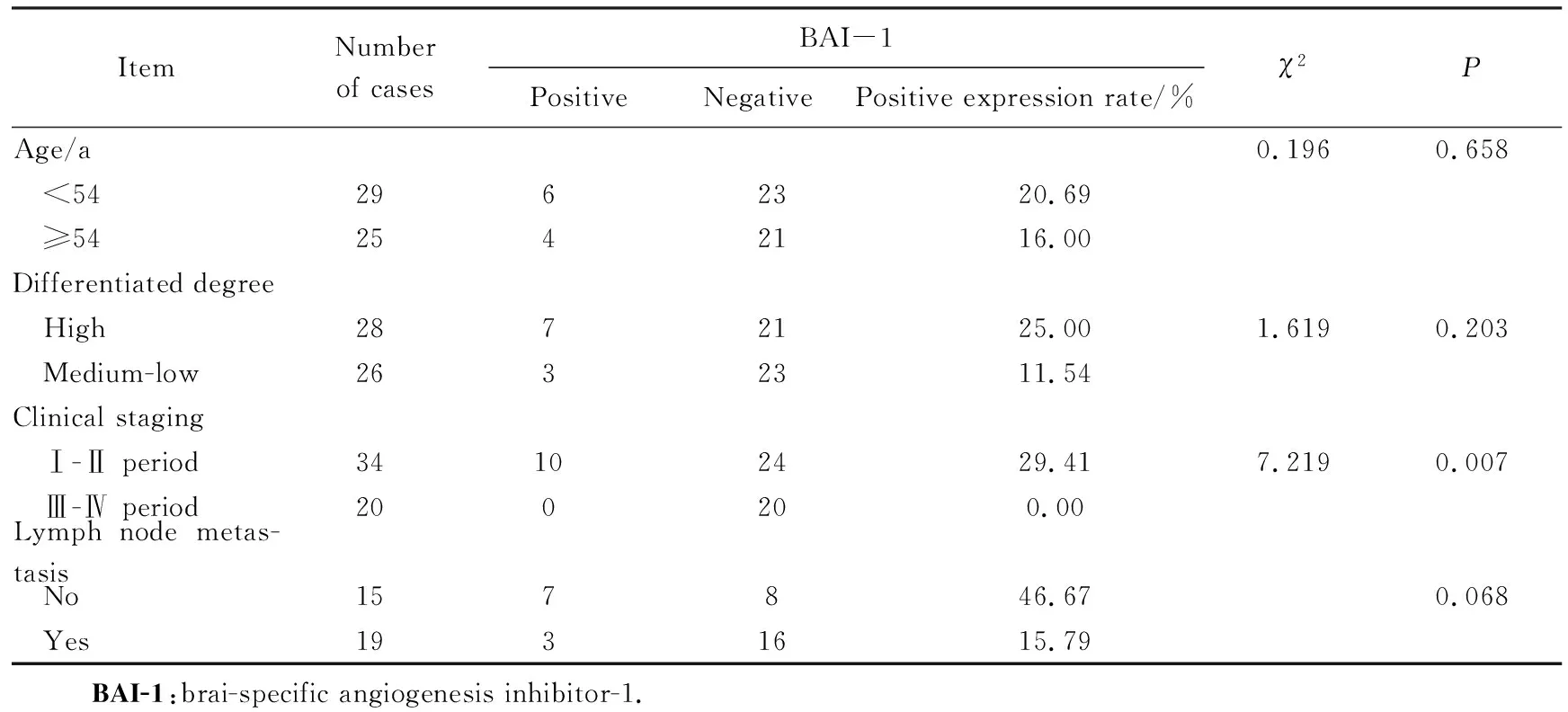
表2 BAI-1的表达情况及与宫颈鳞癌临床病理特征的相关性Tab.2 Correlation between BAI-1 expression and clinicopathologic characteristics ofcervical squamous cell carcinoma

表3 高危HPV-DNA在不同宫颈组织中的结果Tab.3 Staining of HPV-DNA in the different cervical tissues
2.4 HPV感染与BAI-1表达的相关性分析
实验研究得出在正常的宫颈组织、CIN Ⅰ、CIN Ⅱ~Ⅲ到宫颈鳞癌癌变的过程中,通过Spearman相关性分析, BAI-1在不同宫颈组织中的表达与HPV感染呈负相关(rs=-0.486,P=0.000),差异有统计学意义(表4)。

表4 BAI-1表达与HPV感染的相关性分析Tab.4 Correlation analysis between the expression ofBAI-1 and HPV infection
BAI-1: brai-specific angiogenesis inhibitor-1;HPV:human papillomavirus.
3 讨论
细胞生长的能量主要来源于血液供应,而不断新生的血管则为恶性肿瘤的生长、侵袭提供必备的条件,如能阻碍肿瘤内血管的生成则能有效遏制肿瘤的生长[14]。在细胞癌变过程中,肿瘤新生血管能够为肿瘤细胞的增生、转移提供有利条件,研究[15]显示其在宫颈病变逐步进展的过程中发挥至关重要的作用。近年来,随着宫颈癌防治及预后的进一步研究,肿瘤血管相关因子逐渐成为研究热点。肿瘤新生血管生成是一个多因素影响的复杂过程,在已知的血管相关因子中,目前尚无宫颈癌中BAI-1血管相关因子及与HPV感染的相关性研究,本文通过检测BAI-1在不同宫颈病变中的表达及与HPV感染的情况,探讨BAI-1与HPV感染所致的宫颈癌发生、发展的关系。
作为一种新型靶基因,BAI-1是G蛋白偶联受体的分泌素受体家族中的一种多重跨膜蛋白,在1997年研究P53时被发现[16],属于P53的下游分子,主要受野生型P53的调控而发生作用,因能够遏制血管再生而开始被关注。在大多数正常组织如乳腺、肾脏、胰腺等中也发现了BAI-1的存在,而在相应的恶性肿瘤中发现其表达明显下调甚至缺如[17-19]。2003年研究发现在结直肠癌组织中BAI-1多数不表达或表达极低,几乎不表达于转移的淋巴结中,同时可以抑制肿瘤新生血管生成,有效的减缓肿瘤的生长[20]。BAI-1是具有5个血小板敏感蛋白-1(thrombospondin-1,TSP-1)重复序列的血管生成抑制因子,一方面其可通过TSP1抑制由FGF诱发的血管生成,从而发挥抑癌作用[21];另一方面其属于P53的下游分子,分子结构内至少含有一个功能性的P53结合序列位点,并且只受野生型P53的表达调控,而在变异P53组织中无表达;通过该功能位点与P53结合,可激活P53/BAI-1通路从而发挥抑癌作用[22-23]。本研究结果显示,在正常宫颈组织、CIN Ⅰ、CINⅡ~Ⅲ及宫颈鳞癌组织中BAI-1的阳性表达逐渐降低,组间差异均有统计学意义 (P<0.01),并且BAI-1与宫颈鳞癌临床分期密切相关,分期越早,其阳性表达率越高,且在有转移淋巴结中表达明显偏低,提示其可能参与宫颈鳞癌病变的早期事件。
研究[24]证实高危HPV的持续感染导致宫颈癌的发生,其中最常见的为HPV16,其HPV-DNA中与致癌性密切相关的主要是早期转录基因中的E6、E7。 E6蛋白通过特异性绑合p53蛋白,使其失去活性并快速降解或表达下调,致细胞原有周期失去控制,细胞增生失控。E7蛋白通过作用于E2F和pRB形成的复合物,使其发生降解,致细胞周期失控并永生化; 同时HPVE7 基因下游的核糖核苷酸还原酶亚基M2 基因能与E7 和RB 蛋白结合释放的转录因子 E2F结合刺激活性氧的生成,而活性氧能激活ERK1/2 信号通路,使低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)和FGF 表达上调来促进血管新生,最终导致癌症的发生[10-11]。考虑BAI-1及HPV 16 E6/E7均与P53及FGF关系密切,推测两者之间在宫颈鳞癌发生发展中可能存在某种关系,而本实验结果显示BAI-1的表达与HPV的感染呈负相关,考虑其可能的机制为:①HPVE6蛋白通过与P53结合诱导P53降解或表达下调,从而抑制P53对BAI-1的调控,导致BAI-1表达下调;②HPV E7蛋白和RB 蛋白结合激活ERK1/2 信号通路从而诱导FGF 的表达上调,而过表达的FGF可能被含有5个TSP-1结构的BAI-1抑制,刺激更多活性氧的生成,从而抑制HPVE7蛋白的表达。
综上所述,BAI-1在正常宫颈组织、CINⅠ、CINⅡ~Ⅲ及宫颈鳞癌组织中的阳性表达率逐渐降低,且与宫颈鳞癌的临床分期密切相关,同时与高危HPV的阳性感染率呈负相关;由此可推测 BAI-1可能参与HPV导致的宫颈鳞癌的早期病变过程,有望成为宫颈鳞癌靶向基因治疗的新方向,为宫颈鳞癌的早期防治及预后评估提供新的思路。

