乳腺癌患者血液中PGRMC1浓度与临床相关性
赵 越 阮祥燕,2* 张泉东 王虎生 李 雪 蔡桂举 谷牧青 Alfred O. Mueck,2
(1.首都医科大学附属北京妇产医院内分泌科,北京 100026;2.德国图宾根大学妇产医院妇女健康部与妇女健康研究中心, 图宾根 D-72076,德国;3. 解放军263医院外科,北京 101149)
在全球女性群体中,乳腺癌已经成为最常见的浸润性癌症之一,女性一生中罹患乳腺癌的概率为1/8。2015年中国肿瘤新发病例数为429.2万,其中女性乳腺癌发病人数为26.86万,占到女性新发肿瘤的15%,其中45~59岁的发病率为23%[1]。这个年龄阶段正是女性的围绝经或绝经阶段。激素治疗是目前治疗绝经相关症状最有效的方法,它对维持绝经妇女身体健康、提高生活质量具有其他任何单一药物不能取代的作用。但是目前有研究[2]认为,激素治疗会使乳腺癌发生风险增加。妇女经过5年以上的雌/孕激素联合治疗,乳腺癌风险将增加(HR=1.24,95%CI:1.01~1.54)[3]。此外,也有大部分的临床研究[2-5]显示,激素治疗超过5年,乳腺癌的发病风险增加。
有研究[3]发现,健康女性乳腺内存在恶性细胞的概率是40%,有一部分女性即使在内源性雌激素、孕激素的刺激下,乳腺恶性细胞也可能会发生快速增生而发展为临床乳腺癌。如能早期检测雌激素孕、激素、相关乳腺癌风险,筛选出乳腺癌高危患者并采取相应措施,对减少激素治疗的乳腺癌风险具有重要指导意义,但是直到现在,临床上关于乳腺癌风险血清学标志物均缺乏一定的敏感度、特异度。在最近十几年,发现了一些新的孕激素受体膜组分,其中孕激素受体膜组分1(progesterone receptor membrane components 1, PGRMC1),雌激素、孕激素联合治疗可以明显促进PGRMC1表达阳性的乳腺癌细胞的增生,体外研究[4-6]显示,体外雌激素、孕激素对MCF7/PGRMC1与未转染PGRMC1的乳腺癌细胞(MCF7)增生作用有明显不同,雌激素和某些孕激素明显增加了转染了PGRMC1的乳腺癌细胞的增生,并可能参与了肿瘤发生。近几年陆续有关于PGRMC1在实体瘤中表达情况的报道[7-8],但研究结果不一致,同时这些临床数据比较零散,研究样本量小,绝大部分研究集中于评估乳腺癌组织中特定的细胞结构而无法对患者血液中PGRMC1的表达进行检测和评估,而后者对于激素治疗前的常规风险筛查十分必要。本课题组[4]在前期的预实验研究中已经发现乳腺癌患者血液中PGRMC1表达与乳腺正常参照人群血液中PGRMC1表达差异有统计学意义,发现PGRMC1的表达与乳腺癌发生相关,本研究将进一步通过酶联免疫吸附剂测定法(enzyme linked immunosorbent assay,ELISA)法检测血液中PGRMC1浓度,这对预测MHT乳腺癌风险,为激素治疗的安全临床应用具有重要意义。
1 对象与方法
1.1 研究对象
1.1.1 基本情况与分组
按照总体率估计公式[5],以前期有关研究为参考值[6],以容许误差为10%,α=0.05,单侧 μα=1.64,来估计要测试的样本,选取2016年9月至2018年1月期间,因乳腺疾病就诊于首都医科大学附属北京妇产医院乳腺外科、中国医学科学院肿瘤医院乳腺外科以及解放军263医院乳腺外科患者140例,检测其血清及全血标本。本研究经首都医科大学附属北京妇产医院伦理委员会批准(伦理审批号:IEC-C-18-V04-FJ1),所有血液来源者均已签署知情同意书。(1)乳腺癌组:90例,均为女性,年龄23~70岁,年龄中位数为49岁,均经术后临床病理确诊。依据世界卫生组织(World Health Organization,WHO)肿瘤组织学分类(2003版)[9]为乳腺浸润性癌90例。根据美国癌症分析联合委员会(American Joint Committee on Cancer, AJCC)[10]临床分期,Ⅰ期24例,Ⅱ期26例,Ⅲ期20例,Ⅳ期20例。(2)乳腺良性疾病组:50例,均为女性,年龄24~64岁,年龄中位数42岁,均经乳腺影像学或乳腺穿刺活检确诊。(3)正常对照组:采用数字表法随机抽取同期门诊健康体检者30例,均为女性,年龄25~68岁,年龄中位数为40岁。
1.1.2 纳入标准
1)乳腺癌:①病理诊断乳腺癌(无论有无淋巴结转移);②无其他恶性肿瘤治疗史;③所有患者均未经过任何术前针对性治疗;④足够可利用的组织标本。
2)乳腺良性疾病:①乳腺纤维腺瘤;②乳腺导管内乳头状瘤;③乳腺囊性增生病。
1.1.3 排除标准
①男性乳腺癌;②术前接受任何形式新辅助化学药物治疗;③靶向治疗等的患者;④近3个月内接受激素替代治疗者。
1.2 标本采集
患者入院待检清晨空腹静脉血10 mL,其中5 mL离心分离血清后置于-80 ℃超低温冰箱保存,待测血清CA153、CEA、CA125;另外5 mL至于EDTA-K3抗凝管中,50 μL/管分装保存于-80 ℃超低温冰箱,待测全血PGRMC1。
1.3 测定血清CA153、CEA、CA125
化学发光免疫分析法(chemiluminescence immunoassay, CLIA),采用双抗体夹心法,分析过程全自动化,仪器自动吸样品50 μL,液相试剂50 μL,固相试剂250 μL,37 ℃温浴7.5 min,冲洗后,加入反应试剂(碱性过氧化氢)激发反应,其发光强度与样品浓度成正比。按药盒说明,以CA125>35 U/mL,CA153>25 U/mL,CEA>5 μg/L为阳性值。
1.4 ELISA法测定全血PGRMC1
取新鲜抗凝血,400~500 g离心5 min,离心弃上清。取900 μL(分2管各450 μL)每管加入9倍体积的红细胞裂解液,轻轻吹打混匀,裂解时间8~10 min,400~500 g 4 ℃离心5 min,弃红色上清。加入 3~4 mL PBS洗涤1次,400~500 g离心2~3 min,弃上清。1 mL RIPA 加入10 μL PMSF,使 PMSF的最终浓度为1 mmol/L,混匀备用。将裂解后的样品10 000~14 000 g 离心3~5 min,取上清。加液器在微孔板每孔分别加标准品或待测样本100 μL,轻轻晃动混匀,覆上板贴,37 ℃温育2 h。弃去液体,甩干,不用洗涤。每孔加生物素标记抗体工作液100 μL,覆上新的板贴,37 ℃恒育1 h。弃去孔内液体,甩干,洗板3次。每次浸泡2 min,200 μL/孔,甩干。每孔加辣根过氧物酶标记亲和素工作液100 μL,覆上新的板贴, 37 ℃恒育1 h。弃去孔内液体,甩干,吸去或甩掉酶标板内的液体;在实验台上铺垫几层吸水纸,酶标板朝下用力拍几次;将推荐的洗涤缓冲液按200 μL/孔注入孔内,浸泡2 min;洗板5次,每次浸泡2 min,200 μL/孔,甩干。依序每孔加底物溶液90 μL。当肉眼可见标准品前3~4孔有明显梯度蓝色,后3~4孔显色不明显时,即可加入终止液终止反应;37 ℃避光显色15~30 min。依序每孔加终止溶液50 μL,终止反应。在反应终止后5 min内用酶标仪在450 nm波长依次测量各孔的吸光度(A值)。
1.5 数据处理
PGRMC1检测将标准品及样本值减去S0孔数值后绘制曲线,设置复孔则取其平均值计算。以标准品的浓度为纵坐标,A值为横坐标,绘出标准曲线。根据样本A值,用标准品的浓度与A值计算出标准曲线的回归方程式,将样本的A值代入方程式,计算出样本浓度。
1.6 统计学方法
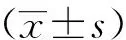
2 结果
2.1 PGRMC1浓度在乳腺癌、乳腺良性疾病及正常对照组间比较
血PGRMC1浓度在各组间分布如图1所示。对照组中,PGRMC1浓度为(39.36±25.10)ng/L;乳腺良性疾病组中,PGRMC1浓度为(42.77±29.81)ng/L;乳腺癌组中,PGRMC1浓度为(74.06±28.76)ng/L,其中Ⅰ期(56.14±15.65)ng/L,Ⅱ期(60.89±16.86)ng/L,Ⅲ期(95.54±16.79)ng/L,Ⅳ期(113.78±41.20)ng/L,各组间PGRMC1浓度差异有统计学意义(P<0.05)。正常对照组与乳腺良性疾病组间差异无统计学意义(P>0.05);乳腺癌早期(Ⅰ期)与乳腺良性疾病组及正常组相比,差异无统计学意义(P>0.05)。乳腺癌Ⅱ、Ⅲ、Ⅳ期患者血液PGRMC1浓度随期别的增加而逐渐升高,显著高于乳腺良性疾病组及正常对照组(P<0.05)(表1)。

图1 PGRMC1在组间的分布Fig.1 Blood PGRMC1 level among groups
PGRMC1: progesterone receptor membrane components 1;0: control group;1: benign breast disease group;2: stage Ⅰ of breast cancer;3:stage Ⅱ of breast cancer;4:stage Ⅲ of breast cancer;5:stage Ⅳ of breast cancer.

表1 乳腺良恶性肿瘤血液PGRMC1浓度比较Tab.1 Blood PGRMC1 level in benign and malignant breast tumors
*P<0.05vsbreast benign disease group and control group;PGRMC1: progesterone receptor membrane components 1.
2.2 乳腺良、恶性肿瘤血液中肿瘤标志物水平比较
血清肿瘤标志物(CA125、CA153、CEA)阳性率在3组间表达差异有统计学意义 (P<0.001)。两两比较结果显示,乳腺癌早期患者(Ⅰ期、Ⅱ期)与乳腺良性疾病组及正常对照组相比,CA125、CA153和CEA阳性率差异无统计学意义 (P>0.05)。乳腺癌晚期(Ⅲ、Ⅳ期)患者3种血清肿瘤标志物阳性率均显著升高,与对照组和乳腺良性疾病组差异有统计学意义(CA125:χ2=12.26,P=0.000; CA153:χ2=28.19,P=0.000; CEA:χ2=6.52,P=0.011;CA125:χ2=16.46,P=0.000; CA153:χ2=42.19,P=0.000; CEA:χ2=14.29,P=0.000)(表2)。
2.3 PGRMC1对乳腺癌的诊断及早期预测价值
以组织病理学诊断为金标准,鉴于CA125、CA153和CEA血清含量在早期(Ⅰ期和Ⅱ期)乳腺癌中无显著性变化,故将乳腺癌患者分为早期(Ⅰ期和Ⅱ期)50例和晚期(Ⅲ期和Ⅳ期)40例,分别以正常组作为对照绘制PGRMC1、CA125、CA153、CEA的ROC曲线进行诊断试验诊断效果的比较(图2、3)。

表2 不同组别CA125、CA153、CEA表达比较Tab.2 Serum CA125, CA153 and CEA level in different groups n(%)
PGRMC1:progesterone receptor membrane components 1;CA125: carbohydrate antigen 125;CA153: carbohydrate antigen 153;CEA: carcino-embryonic antigen;*P<0.05vsbreast benign disease group and control group.

图2 晚期乳腺癌中各指标的ROC曲线Fig.2 CA125,CA153,CEA, PGRMC1 diagnosisadvanced breast cancer by ROC curve analysis
ROC:receiver operating characteristic1;CA125: carbohydrate antigen 125;CA153: carbohydrate antigen 153;CEA: carcino-embryonic antigen;PGRMC1:progesterone receptor membrane components 1.

图3 早期乳腺癌中各指标的ROC曲线Fig.3 CA125,CA153,CEA, PGRMC1 diagnosisearly breast cancer by ROC curve analysis
ROC:receiver operating characteristic;CA125: carbohydrate antigen 125;CA153: carbohydrate antigen 153;CEA: carcino-embryonic antigen;PGRMC1:progesterone receptor membrane components 1.
在乳腺癌晚期诊断中,PGRMC1的AUC为82.7%(P<0.05,95%CI: 0.731~0.923),CA125的AUC为78.3%(P<0.05,95%CI: 0.677 ~ 0.890),CA153的AUC为86.8%(P<0.05,95%CI: 0.853 ~ 0.918),CEA的AUC为77.3%(P<0.05,95%CI: 0.853 ~ 0.918),在诊断晚期乳腺癌中PGRMC1及3种肿瘤标志物均有一定的参考意义。其中CEA的AUC最大,敏感度为86.8%,特异度为75.0%,对晚期乳腺癌的诊断最有价值,其次为PGRMC1,利用PGRMC1诊断晚期乳腺癌患者的准确性较高(表3)。
在早期乳腺癌的ROC曲线分析中,CA125、CA153和CEA的AUC均小于60%,且对早期乳腺癌的诊断没有参考意义(P>0.05)。而PGRMC1的AUC为0.688,差异有统计学意义(P<0.05,95%CI:0.853~0.918),敏感度为94.0%,特异度为50.0%,利用血PGRMC1检测有助于提高对乳腺癌的诊断性能和早期检出率(表4)。
3 讨论
乳腺癌是危及妇女健康乃至生命的首要原因,2014年Lancet最新数据显示中国每年乳腺癌新发数量和死亡数量分别占全世界的12.2%和9.6%[1]。随着经济发展、生活方式的改变及人口老龄化增加,在北京、上海等大城市乳腺癌发病率已位居女性所有恶性肿瘤的首位。我国诊断为乳腺癌的高发年龄为45~55岁,其中62.9%的女性被诊断为乳腺癌时还未绝经[11]。由于乳腺癌初期症状不明显,多数患者就诊时病情已发展到中晚期,因此提高乳腺癌早期诊断水平,探索良好的早期诊断指标具有重要意义。肿瘤标志物在协助临床诊断肿瘤、分析病情、指导治疗、监测复发或转移、判断预后方面有着重要的意义[12]。血清CA153是目前公认的诊断乳腺癌较为特异的肿瘤标志物,最早发现于乳腺癌上皮细胞,是乳腺细胞上皮表面糖蛋白的变异体,细胞癌变时,由于糖基化转移酶被激活,引起细胞表面糖类的变化,由癌细胞向血循环中释放。血清CA153常在乳腺癌中过度表达,是监测浸润性或转移性乳腺癌的重要标志物。但CA153对诊断早期乳腺癌的敏感度和特异度欠佳,在乳腺癌Ⅰ期、Ⅱ期诊断的敏感度仅有10%~15%、20%~25%,在部分乳腺癌患者中呈阴性表达,并且其浓度与乳腺癌的临床分期、肿瘤直径、腋窝淋巴结状况、雌激素受体密切相关[13-14]。进行性疾病如乳腺癌如果得到早期诊断后,那么启动治疗对患者的生存或生活质量有积极影响。此外,公认或临床确认的有重要临床意义的肿瘤标志物目前并无增加。而已证实至少25%的增加,才被解释为有临床重要意义。因此CA153在乳腺癌诊断中存在一定的局限性。

表3 PGRMC1、CA125、CA153、CEA表达浓度对晚期乳腺癌诊断效果评价Tab.3 Evaluation of PGRMC1, CA125, CA153 and CEA on diagnosis of advanced breast cancer
PGRMC1:progesterone receptor membrane components 1;CA125: carbohydrate antigen 125;CA153: carbohydrate antigen 153;CEA: carcino-embryonic antigen;AUC: area under the ROC curve;ROC:receiver operating characteristic.
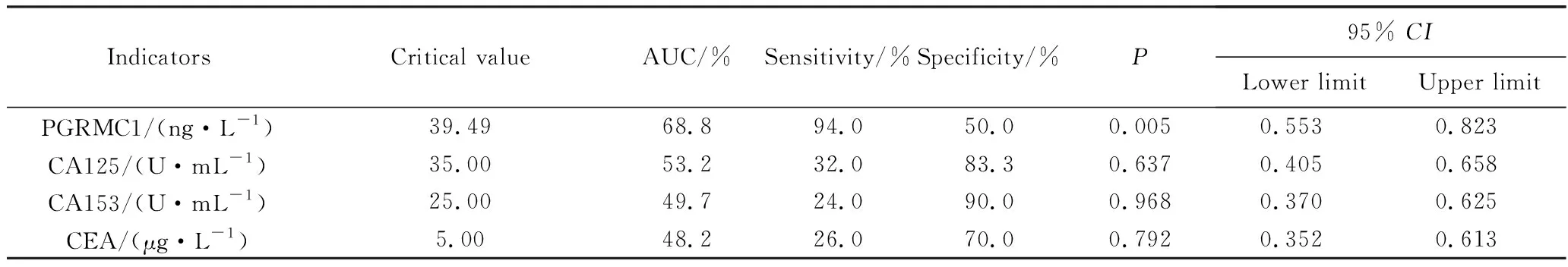
表4 PGRMC1、CA125、CA153、CEA表达对早期乳腺癌诊断效果评价Tab.4 Evaluation of PGRMC1, CA125, CA153 and CEA on diagnosis of early breast
PGRMC1:progesterone receptor membrane components 1;CA125: carbohydrate antigen 125;CA153: carbohydrate antigen 153;CEA: carcino-embryonic antigen;AUC: area under the ROC curve;ROC:receiver operating characteristic.
CA125是一种细胞表面的糖蛋白,最初由乳头状浆液囊性卵巢癌中提出。健康成人CA125的上限为35 U/mL,在乳腺癌中有20%血清CA125超过35 U/mL。CA125是上皮性卵巢癌的主要标志物,在非卵巢癌的一些恶性肿瘤中,如肺癌、肝癌、和乳腺癌等,CA125也会出现不同程度的升高[15]。但CA125在乳腺癌的诊断价值方面也稍显不足,在乳腺癌诊断中的敏感度仅为24.6%~38%[16]。因此,研究[17]表明CA125不能单独用于乳腺癌的早期诊断和病程反应。
CEA是目前临床上应用最广泛的肿瘤标志物之一,但其主要存在于胎儿组织和胃肠道肿瘤中,同时在肺肿瘤疾病中如肝炎、肝硬化中也存在[17]。CEA与CA153一样,作为一个乳腺癌标志物,CEA的敏感性通常低于CA153,由于CEA的非特异性,常与其他肿瘤标志物联合应用。综上,现在的血液学生物标志物在乳腺癌的早期诊断中并无价值,因此,迫切需要一种新型、具有较高敏感度和特异度的血液生物学标志物。
在最近几十年,人们发现了一种新的乳腺癌细胞膜受体-PGRMC1,此受体为跨膜受体,具有跨膜域和胞质域。前期体外实验、初步动物实验及临床研究[18-20]均说明了PGRMC1与激素诱导的乳腺癌发生、发展有重要的相关性,如果能在应用激素治疗前对女性进行PGRMC1的检测,对表达阳性的女性采取措施,则可以减少激素治疗中乳腺癌的风险。但目前的测定方法仅限于组织标本,这种检测方法是有创的,不利于大规模筛查。
在本研究中,取代蛋白印迹半定量方法,采用ELISA检测乳腺癌、乳腺良性疾病患者及正常人群全血PGRMC1浓度,并比较了乳腺癌患者组与乳腺良性疾病组和正常组PGRMC1血液阳性检出率、阳性水平的差异情况,发现不同组别中PGRMC1均有不同程度的表达,乳腺癌组与对照组和良性疾病组相比,PGRMC1浓度明显升高,且在不同期别中表达水平明显不同。而临床常用的肿瘤标志物CA125、CA153、CEA虽在Ⅲ、Ⅳ期表达显著升高,但在I、Ⅱ期乳腺癌中虽然表达水平有所升高,但与正常组和乳腺良性疾病组比较,差异无统计学意义(P>0.05),提示CA125、CA153和CEA在乳腺癌早期诊断中意义不大,这与以往报道[21-23]基本一致。
本研究应用ROC曲线评价CA153、CEA、CA125诊断晚期乳腺癌(Ⅲ、Ⅳ期)ROC曲线下面积均>70%,表明其作为晚期乳腺癌临床诊断标志物具有一定的参考价值,而早期乳腺癌中3种肿瘤标志ROC曲线下面积在几乎在0.5以下,敏感度、特异度均较低,对早期乳腺癌诊断几乎没有意义。而PGRMC1在早晚期乳腺癌中ROC曲线下面积分别为68.8%和82.7%,这与乳腺癌组织中PGRMC1表达情况具有较高的一致性[5]。当截取值为39.49 ng/L和75.35 ng/L时,PGRMC1预测乳腺癌的敏感度及特异度最高,有望成为激素治疗前常规筛查的乳腺癌风险标志物。
本研究的局限性在于:①本研究只是对PGRMC1及肿瘤标志物检测在乳腺癌诊断中的临床价值进行评价,而未进行乳腺癌术后随访,从而未能将PGRMC1对乳腺癌术后监测中复发、转移中的评价指标进行分析,在接下来的实验中,本课题组将对乳腺癌患者进行术后随访12~36个月,并定期对乳腺癌复发转移患者监测PGRMC1及相关肿瘤标志物,ROC曲线下面积评价PGRMC1在监测乳腺癌术后复发或转移中的应用价值,为PGRMC1成为乳腺癌血液生物学标志物奠定基础;②本研究虽然找到了PGRMC1的最佳诊断分界点,但样本量较少,如果要在临床上应用,需要通过庞大的样本量来确定。
综上所述,PGRMC1在不同期别尤其是早期乳腺癌患者中的诊断价值优于临床常规肿瘤标志物CA125、CA153和CEA,可以尽早筛选出激素用药前存在乳腺癌发生风险的患者并及时做出评估和干预,同时对提高乳腺癌的早期诊断、早期治疗具有重要的参考价值。如果能将PGRMC1作为早期、快速检测的指标,可以在未来建立一套关于PGRMC1对乳腺癌风险早期评估的预测系统,这将为指导临床激素治疗的安全应用奠定基础。

