乌司他丁在脂多糖/尼日利亚菌素诱导的巨噬细胞焦亡中的作用
周俊杰,吴实正,段鹏凯,袁媛,何璇,童华生
脓毒症是由感染导致的脏器功能不全,在ICU中具有较高病死率[1],其病理机制不仅限于病原微生物对机体细胞的损伤,同时也是机体的一种“失控的自主反应”[2-3]。巨噬细胞是机体重要的天然免疫细胞,在病原菌的吞噬和消化过程中具有重要作用。目前一些研究认为,巨噬细胞释放的大量炎症介质是脓毒症状态下造成脏器损伤的重要原因[4]。2001年被首次提出的细胞焦亡[5](pyroptosis)是一种半胱天冬酶1(cysteinyl aspartate specific proteinase 1,caspase-1)依赖性细胞死亡方式[6],是主要发生于巨噬细胞和树突状细胞等免疫细胞的炎症性细胞死亡,伴随有大量炎症介质的释放。这种大量炎症介质释放的表现提示其可能与脓毒症过程中的过度炎症反应相关。乌司他丁(ulinastatin,UTI)是一种蛋白酶抑制剂[7],动物实验及临床研究均提示其可降低脓毒症动物/患者循环血液中炎症介质的水平,具有良好的抗炎作用[8-10],但具体机制尚不完全明确。本研究以脂多糖(lipopolysaccharide,LPS)/尼日利亚菌素(nigericin)联合刺激骨髓源性巨噬细胞构建体外巨噬细胞焦亡模型,探讨乌司他丁对巨噬细胞焦亡的作用及其可能的抗炎机制。
1 材料与方法
1.1 实验材料 噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)购自美国MP公司,白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α检测试剂盒及乳酸脱氢酶(lactic dehydrogenase,LDH)检测试剂盒购自碧云天生物技术公司,IL-18检测试剂盒购自美国赛默飞世尔科技有限公司。抗半胱天冬酶-1(caspase-1)及Gasdermin D蛋白(GSDMD)一抗购自英国Abcam公司,二抗购自上海Absin公司。UTI购自广东天普公司,RT-qPCR引物由上海英潍捷基贸易有限公司合成。
1.2 骨髓源性巨噬细胞分离及培养 C57BL/6小鼠购自南方医科大学实验动物中心,8~10周龄,体重20~25g。颈椎脱臼法处死小鼠,沿股骨上段和胫骨下端关节处将股骨和胫骨剪断取出;在距离骨髓腔末2mm处切除股骨和胫骨的两端,使骨髓腔充分暴露;将1ml注射器针头插入暴露的骨髓腔内,完全培养基冲洗骨髓腔至白色状态,收集骨髓冲洗液,离心去上清,用含有10ng/ml小鼠巨噬细胞集落刺激因子(macrophage colony stimulating factor,MCSF)的完全培养基重悬细胞,铺于6孔板,置于37℃含5%CO2细胞培养箱中培养,隔天换液,每次换液时MCSF浓度加倍。小鼠巨噬细胞在第6天分化完毕,第7天进行实验。
1.3 细胞焦亡模型的建立及UTI预处理 按照文献[11]方法采用LPS/尼日利亚菌素诱导巨噬细胞构建巨噬细胞焦亡模型。将细胞分为对照组、UTI组、模型组和模型+UTI组,其中,UTI组和模型+UTI组在建模前给予1000U/ml UTI预处理,其余两组给予等量PBS。模型组和模型+UTI组先用LPS 100ng/ml刺激培养的巨噬细胞4h,再加入10μmol/L尼日利亚菌素继续刺激2h,进行相关检测;对照组及UTI组在此期间仅给予等体积PBS,在相同时间点进行检测。
1.4 MTT法检测细胞活力 将细胞接种于96孔板中,按上述方法刺激后,弃去原培养基,每孔加入0.5mg/ml的MTT溶液150μl,37℃避光孵育4h,去上清,每孔加入DMSO溶液150μl,结晶物充分溶解后应用酶标仪于490nm处测量各孔吸光度(OD)值。细胞存活率=各组OD值/对照组OD值×100%。
1.5 分光光度法检测细胞LDH释放率 收集各组细胞上清,按照试剂盒说明书检测释放出的LDH,裂解剩余的贴壁细胞检测LDH,两者之和即为总LDH。LDH释放率=上清LDH含量/总LDH含量×100%。
1.6 Western blotting检测caspase-1和GSDMD蛋白表达 提取各组细胞蛋白,按常规步骤进行Western blotting分析,检测细胞caspase-1、GSDMD表达及活化情况,结果图采用Image J进行灰度分析。
1.7 细胞上清IL-1β、IL-18、TNF-α、IL-6蛋白水平检测 收集细胞上清,采用ELISA测定各因子水平,显色反应终止后,使用酶标仪在450nm处检测各孔OD值,根据绘制的标准曲线,计算各孔IL-1β、IL-18、TNF-α、IL-6浓度。
1.8 细胞IL-1β、IL-18 mRNA水平检测 采用RT-qPCR检测各组细胞IL-1β、IL-18 mRNA水平,各目的基因引物序列见表1。按照文献[12]方法通过2–ΔΔCt法进行相对定量分析。
1.9 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料以表示,在满足方差齐性的条件下,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。

表1 RT-qPCR分析所用引物序列Tab.1 Sequences of the primers (RT-qPCR analysis)
2 结 果
2.1 UTI预处理对LPS/尼日利亚菌素作用下巨噬细胞存活率及LDH释放率的影响 MTT结果显示,与对照组比较,经LPS/尼日利亚菌素作用后,模型组巨噬细胞存活率下降至73.40%,给予UTI预处理后,存活率上升(73.40%vs.86.30%),差异均有统计学意义(P<0.05,图1A)。经LPS/尼日利亚菌素联合刺激后,LDH释放明显增加。给予UTI预处理后,LDH释放率明显下降(22.45%vs.14.80%,P<0.05,图1B)。
2.2 UTI预处理对LPS/尼日利亚菌素作用后巨噬细胞caspase-1活化、GSDMD片段化的影响 Western blotting结果显示,LPS/尼日利亚菌素作用下,巨噬细胞caspase-1(图2A)和GSDMD(图2B)的活性形式即片段化条带明显增强,UTI的干预有效减弱了该作用。灰度分析表明,UTI预处理降低了LPS/尼日利亚菌素刺激所致的caspase-1活化,且GSDMD片段化水平增加,差异有统计学意义(P<0.05)。
2.3 UTI预处理对LPS/尼日利亚菌素作用下巨噬细胞IL-1β、IL-18 mRNA及蛋白表达的影响RT-qPCR结果显示,LPS/尼日利亚菌素联合刺激后,细胞中IL-1β及IL-18 mRNA水平上升,两者在细胞上清中的释放明显增加。UTI预处理明显降低了LPS/尼日利亚菌素作用下细胞上清中IL-1β(403.50±92.63pg/mlvs.253.50±62.93pg/ml,P=0.015)和IL-18的释放水平(325.32±23.33pg/mlvs.216.02±38.18pg/ml,P=0.009,图3)。
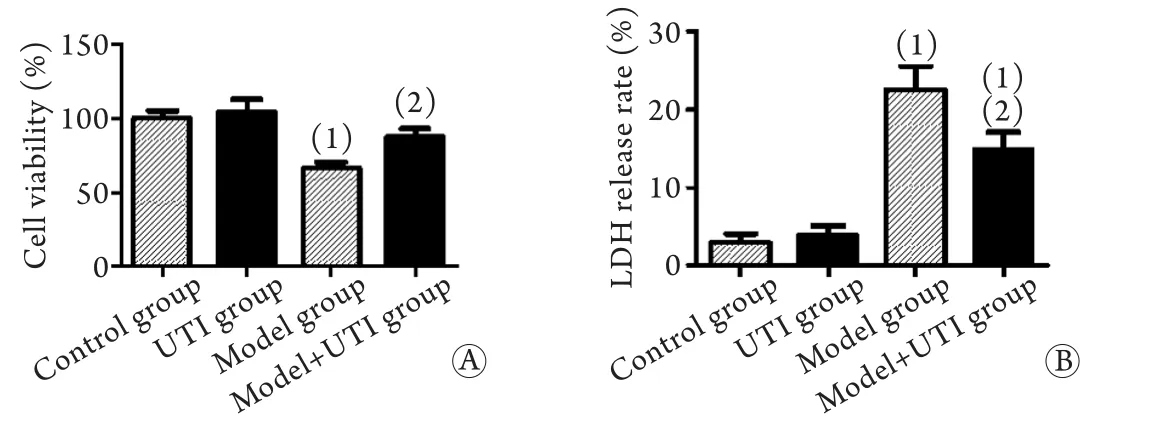
图1 UTI对LPS/尼日利亚菌素作用下巨噬细胞存活率(A)及LDH释放率(B)的影响(n=3)Fig.1 Effects of ulinastatin on cell viability (A) and LDH release rate (B) of LPS/Nigericin-treated macrophages (n=3)
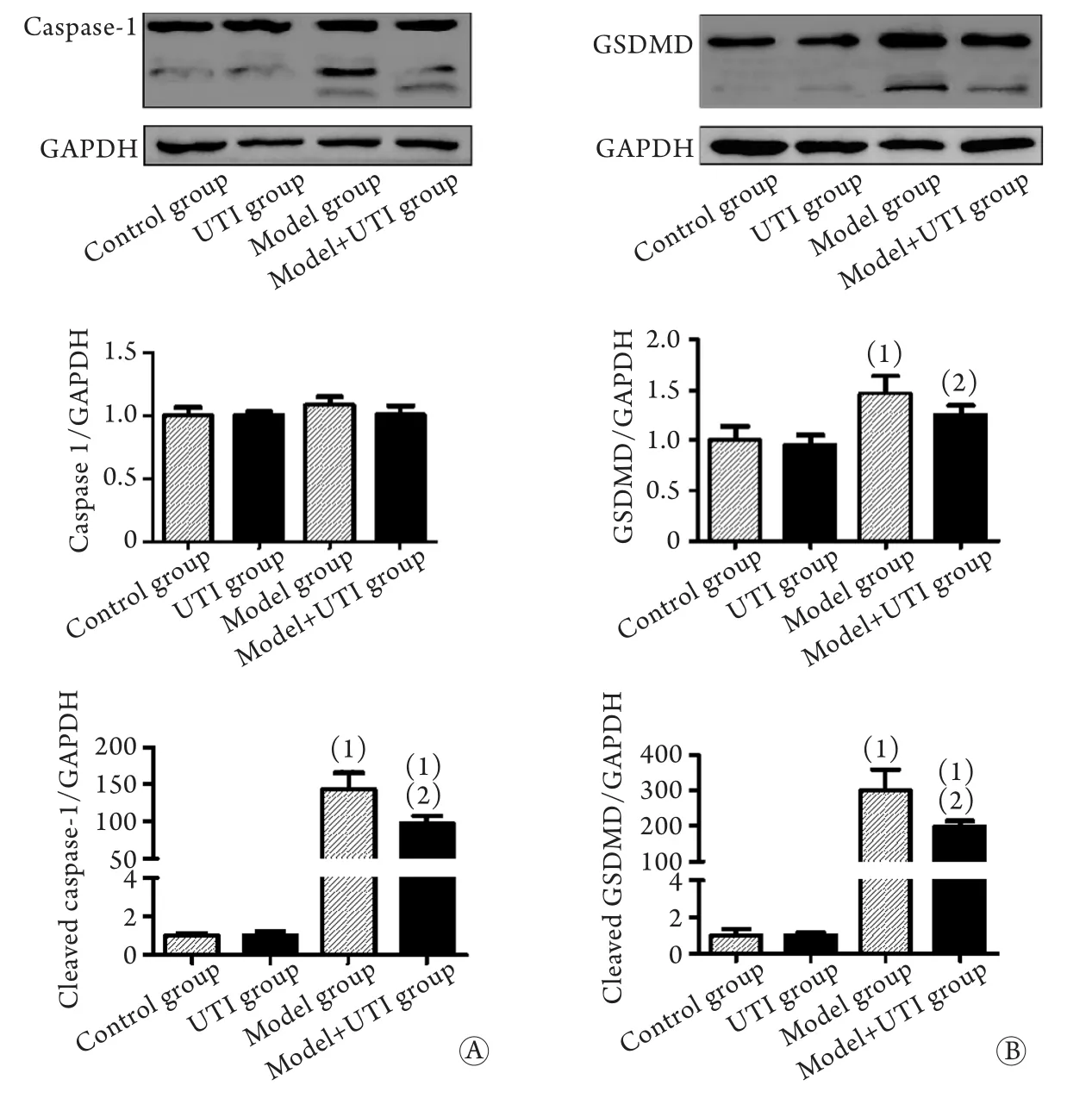
图2 UTI对LPS/尼日利亚菌素作用下巨噬细胞caspase-1活化(A)与GSDMD片段化(B)的影响(n=3)Fig.2 Influence of ulinastatin on caspase-1 activity (A) and GSDMD gragmentation (B) in LPS/Nigericin-treated macrophages (n=3)
2.4 UTI预处理对LPS/尼日利亚菌素作用下巨噬细胞上清TNF-α和IL-6水平的影响 在LPS/尼日利亚菌素作用下,巨噬细胞释放的重要炎症介质TNF-α和IL-6的水平明显升高(P<0.05)。在相同LPS/尼日利亚菌素条件刺激下,经UTI预处理后,细胞上清TNF-α(311.30±33.02pg/mlvs.206.10±28.84pg/ml,P<0.05)和IL-6(212.60±32.72pg/mlvs.143.77±6.36pg/ml,P<0.05,图4)水平明显下降。
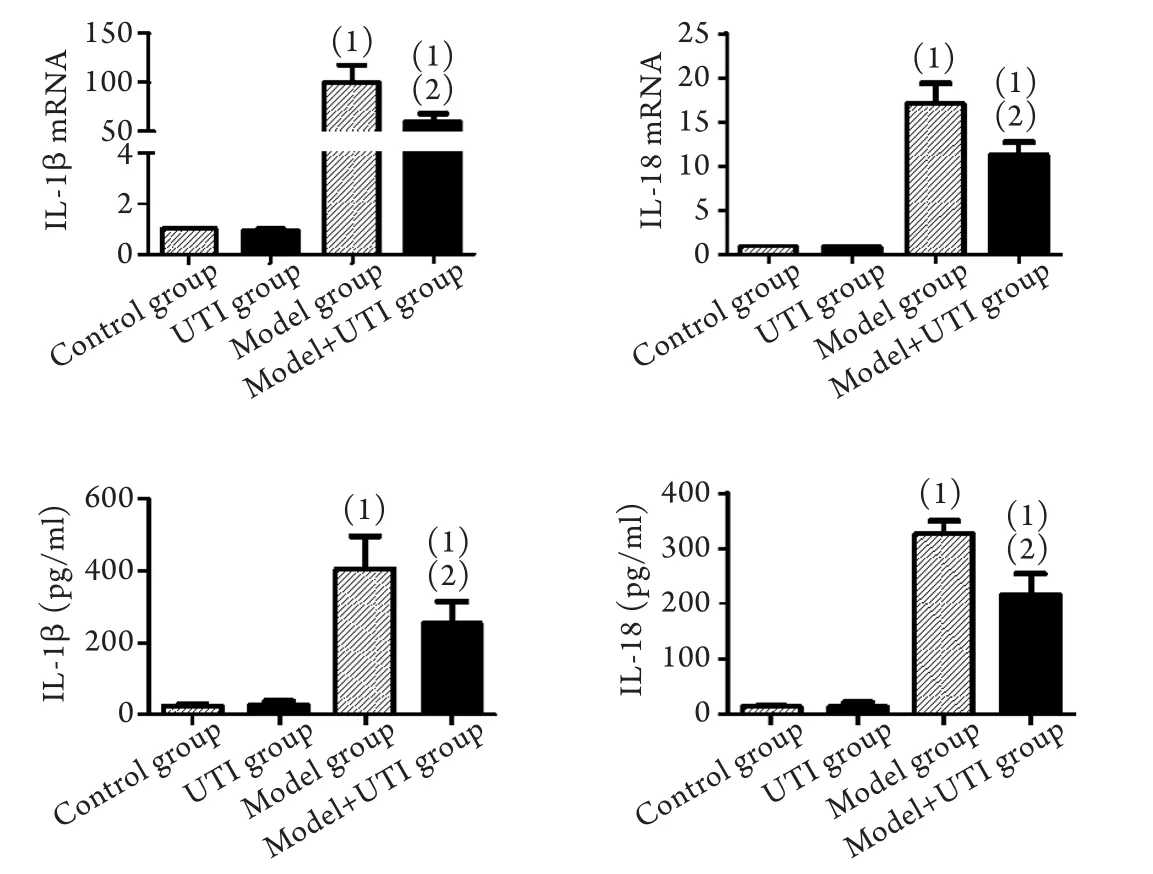
图3 UTI对LPS/尼日利亚菌素作用下巨噬细胞IL-1β、IL-18 mRNA表达及蛋白释放的影响(n=3)Fig.3 Effects of ulinastatin on mRNA expression and protein release of IL-1β and IL-18 in LPS/Nigericin-treated macrophages (n=3)
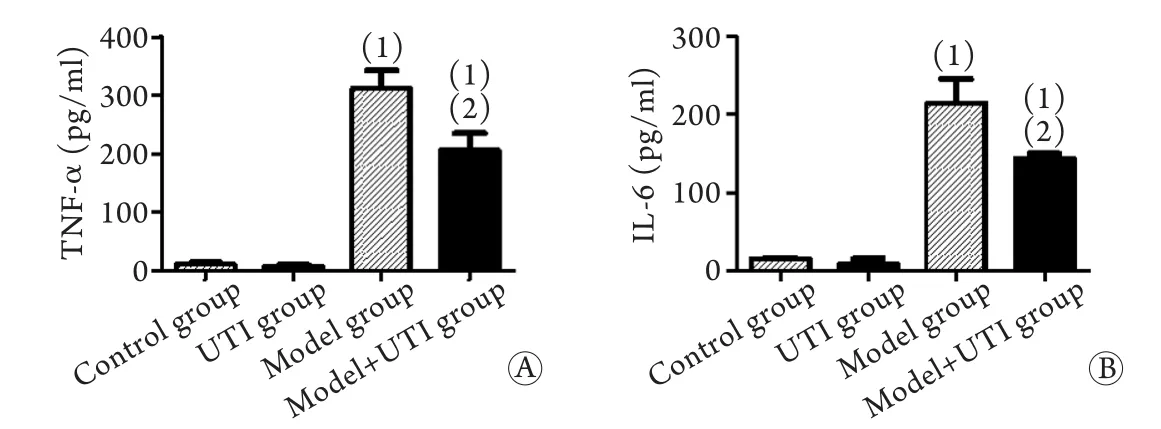
图4 UTI对LPS/尼日利亚菌素作用下巨噬细胞TNF-α(A)和IL-6(B)释放的影响(n=3)Fig.4 Effects of ulinastatin on TNF-α (A) and IL-6 (B) release from LPS/Nigericin-treated macrophages (n=3)
3 讨 论
脓毒症的病理生理机制之一是过度的炎症反应,在脓毒症的发生发展过程中,循环系统中的炎症瀑布是导致多脏器功能衰竭的重要因素。近年来越来越多的研究发现,在感染状态下发生的细胞焦亡与机体的炎症反应密切相关。在LPS/尼日利亚菌素诱导的细胞焦亡中,LPS可与Toll样受体4(Toll-like receptor 4,TLR4)结合,促进炎症介质转录增加;尼日利亚菌素则可通过活化炎性小体,募集caspase-1并使其发生自身剪切,进而活化,活化的caspase-1可剪切IL-1β和IL-18的前体,使其成为活化形式[13]。同时,炎性小体的组成成分GSDMD发生剪切,参与形成细胞膜小孔,一方面,炎性介质IL-1β、IL-18可通过小孔释放至细胞外[14];另一方面,小孔的形成导致细胞内外渗透压改变,进而肿胀,最终导致细胞破裂。可见,细胞焦亡在感染状态下可通过诱导被感染细胞死亡,清除细胞内的病原菌,限制其生长。然而,大量的细胞焦亡可导致过度的炎症反应,IL-1β、IL-18的释放又可激活其他免疫细胞向感染部位聚集,大量炎性细胞浸润,再次加剧炎症因子释放,导致发热、低血压等表现[15-16]。
巨噬细胞焦亡在感染状态下放大炎症反应的特征提示其可能是导致脓毒症过度炎症反应的原因。因此,本研究通过分离小鼠骨髓细胞,并诱导分化为巨噬细胞,以LPS/尼日利亚菌素联合刺激构建体外巨噬细胞焦亡模型,探讨UTI在巨噬细胞焦亡中的作用。结果显示,应用UTI预处理后,巨噬细胞片段化caspase-1和GSDMD水平均明显下降,同时IL-1β、IL-18 mRNA水平及上清中的分泌量均明显降低,提示UTI可抑制巨噬细胞焦亡。
UTI最初是从尿液中分离出的一种尿胰蛋白酶抑制剂,可抑制胰蛋白酶、糜蛋白酶等多种蛋白酶的活性[17]。UTI结构中的糖肽结构域具有稳定细胞膜的作用,是发挥蛋白酶释放抑制作用的主要区域[18]。本研究显示,UTI一方面可抑制焦亡关键蛋白caspase-1及GSDMD的片段化,阻抑焦亡信号通路的传导;另一方面,细胞焦亡最终是由于细胞膜上形成GSDMD小孔,导致细胞破裂而死亡,UTI具有稳定细胞膜作用的糖肽结构域可能是其减缓巨噬细胞焦亡的另一机制。
细胞焦亡是一种极为剧烈的细胞炎症反应,也是一种细胞死亡方式。本研究显示,UTI除可抑制巨噬细胞死亡外,还可抑制LPS/尼日利亚菌素刺激后巨噬细胞炎症介质的转录和释放水平。一方面,UTI可抑制LPS刺激后的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族磷酸化及NF-κB活化[19–21],降低炎症介质的转录水平;另一方面,目前认为IL-1β/IL-18激活和分泌主要依赖于caspase-1,而UTI抑制caspase-1活化,可抑制IL-1β及IL-18的剪切成熟。同时,UTI可稳定细胞膜,抑制GSDMD小孔形成,降低促炎症因子的释放。尽管IL-1β及IL-18不是细胞死亡程序中所必须的,但它们的产生有助于焦亡细胞炎症反应的发生,同时与机体强烈炎症反应导致的发热、低血压相关[22]。本研究初步揭示了UTI降低炎症反应的作用机制,为其在脓毒症治疗中的应用提供了依据。

