酶促酰化对锦葵啶葡萄糖苷呈色及热降解规律的影响
彭非,邓洁红,*,刘永红
(1.湖南农业大学食品科技学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128;3.湖南生物机电职业技术学院,湖南长沙410127)
刺葡萄(Vitis davidii Foëx.),植物学分类上是东亚种群葡萄属(Vitis)[1],果皮为紫色,湖南省西北以及湘南地区分布广泛。刺葡萄皮中蕴含丰富的花色苷,以锦葵色素为主,是制备花色苷单体的理想原料[2]。在自然条件下,花色苷通常由花色苷配基(花色素)与糖通过糖苷键相结合,仅有少部分以有机酸酰化的形式存在。酰化反应通常发生在与花色素相连的糖基上的羟基上,如Saito N等[3]从紫罗兰花中分离出了5种酰基化花色苷,并发现是咖啡酸与其在3位和5位上的葡萄糖发生的酰化。植物中部分花色苷含酰基,是由于酰基转移酶的作用,在植物生长过程中累积而成,但天然含酰基的花色苷数量较少。王维茜等[4]在分离纯化刺葡萄花色素时,发现分离的4种刺葡萄花色苷单体仅有1种具有酰基结构。现有研究已证明花色苷稳定性与其酰基结构存在密切关系,由于内源酰基的辅色作用,单个花色苷依赖自身芳香酰基的存在,加强分子间的键合,使花色苷母核免遭水分子的攻击,进而提高其稳定性[5]。Cevallos-Casals B A[6]的研究结果表明,紫甘薯酰化花色苷含量较丰富,因此其稳定性要优于非酰化的紫玉米花色苷。
花色苷的稳定性会受到温度的影响,而热处理是食品加工中的必要步骤,比如浓缩、干燥、灭菌等。因此,提高花色苷自身热稳定性是扩大花色苷系列产品应用的关键。外源酰基的引入是改善花色苷稳定性的新思路。利用酶促反应实现花色苷糖苷酰化是提高花色苷结构稳定性的新方法。酶法对催化底物具有良好的专一性和选择性,反应条件温和,催化效率高,弥补了化学法酰化区域选择性差、副产物多、产率低、需要基团保护和脱保护等诸多缺点[7],而且是不可逆反应,反应产物稳定,优于单纯使用有机酸或酚酸酰化辅色。
花色苷在保存条件下的含量变化可以反映其结构稳定性,另外,花色苷呈色与含量也是息息相关[8]。结合花色苷的含量变化及测色指标,可以较为全面地反映花色苷的稳定特性。如González等[9]通过色差指标探究花色苷自聚反应及其辅色素对新鲜红葡萄酒颜色的改变。
本文以锦葵啶-3,5-O-双葡萄糖苷(分子式如图1所示)单体为原料,对其进行酶促酰化反应。研究对比分析酶促酰化处理前后花色苷的热稳定性及呈色特征,探究外源酰基对花色苷结构稳定性的影响。研究结果可为花色苷结构稳定化提供借鉴,为刺葡萄花色苷色素的扩大应用奠定基础。
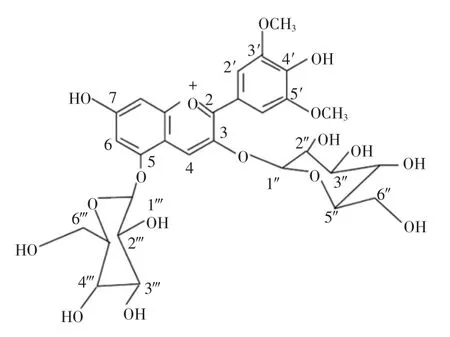
图1 锦葵啶-3,5-O-双葡萄糖苷分子式Fig.1 The molecular structure of malvidin-3,5-diglucose
1 材料与方法
1.1 材料
1.1.1 原料
刺葡萄:采于湖南省中方县刺葡萄果园,自来水淋洗、晾干表面水分后手工剥皮,-24℃冷冻贮藏备用。
1.1.2 试剂
盐酸、无水乙醇、乙酸乙酯、乙醚、甲醇(分析纯)、三氟醋酸[trifluoric acetic acid,TFA,(色谱纯)]、聚酰胺树脂(100目~200目)、分子筛4A型(钠-A型分子筛):国药集团化学试剂有限公司;大孔吸附树脂HP-20:日本三菱公司;2-甲基四氢呋喃[2-Methyltetrahydrofuran,2-MeTHF,(色谱纯)]:上海阿拉丁生化科技股份有限公司;肉桂酸乙烯酯:梯希爱化成工业发展有限公司;南极假丝酵母脂肪酶B(candila antarctica,CAL-B 5万U/g):诺维信生物技术有限公司。
1.1.3 主要仪器与设备
AEY-220电子分析天平:湘仪天平仪器设备有限公司;SX-4-10型箱式电阻炉:天津市泰斯特仪器有限公司;TDZ5台式低速离心机:湖南赫西仪器装备有限公司;UV-2450紫外分光光度计:日本岛津;THZ-92A气浴恒温振荡器:上海浦东物理光学仪器厂;RE-2000B旋转蒸发仪:巩义市予华仪器有限责任公司;HH-8数显恒温水浴锅:上海浦东物理光学仪器厂;PHSJ-3F pH计:上海仪电科学仪器股份有限公司;层析柱(φ1.6×30 cm,B224/29):上海达丰玻璃仪器厂;SMY-2000测色色差计:北京天创尚邦仪器设备有限公司;KQ5200B超声波清洗器:昆山市超声仪器有限公司。
1.2 试验方法
1.2.1 刺葡萄花色苷单体的制备
以刺葡萄皮为原料,以料液比1∶6(g/mL)加入80%乙醇(含0.03%盐酸)提取,避光浸提24 h,抽滤。滤液于0.1 MPa真空度下40℃条件下浓缩回收乙醇,取色素浓缩液分别经过无水乙醚,无水乙酸乙酯萃取2次,脱除有机溶剂,真空蒸发得到花色苷粗提液。
锦葵花色苷的纯化:HP-20树脂预处理后湿法装柱,花色苷粗提液进样至吸附饱和(流出液吸光度值为上样液的1/10时。)首先用2BV蒸馏水冲洗,再用酸化乙醇(体积分数80%、含0.05%盐酸,8BV)洗脱,收集洗脱液于40℃真空浓缩,脱除乙醇。
锦葵花色苷的单体分离:Sephadex LH-20凝胶经预处理后湿法装柱,脱除乙醇后的洗脱液经0.22 μm微孔滤膜过滤后进柱上样,然后用酸化甲醇(体积分数50%、含0.1%的TFA)洗脱,分别收集得到3种色素,真空冻干,结构鉴定后,选取其一锦葵素-3,5-O-双葡萄糖苷(malvidin-3,5-O-diglucoside)为试验单体,纯度为99.54%。
1.2.2 酶促酰化花色苷样品制备
1.2.2.1 有机溶剂分子筛预处理
在350℃条件下活化4A分子筛8 h。冷却后置于干燥器中,添加有机溶剂2-MeTHF过夜脱水12 h,取液体部分备用。
1.2.2.2 脂肪酶活性的测定
参考国家标准GB/T23535-2009《脂肪酶制剂》测定CAL-B435的活性。测得CAL-B435的酶活为0.25 U/mg。
1.2.2.3 酶促酰化花色苷制备
准确称取锦葵素-3,5-O-双葡萄糖苷单体13.10 mg,吸取肉桂酸乙烯酯36 μL,4 mL脱水后2-MeTHF、0.3 g分子筛,加入10 mL带塞小瓶中,超声波助溶。将带筛小瓶置于45℃恒温振荡器中,加入80 U脂肪酶(CAL-B)启动反应。避光振荡反应2.5 h后中止反应。将滤液抽滤后置于0.1 MPa真空度下悬蒸1 h,回收2-MeTHF以及残留的肉桂酸乙烯酯,备用。
1.2.3 酶促酰化对锦葵啶葡萄苷热稳定性影响
称取已制备的酶促锦葵啶花色苷粉末1.25 mg,用pH3.0磷酸盐缓冲液溶解,稀释摇匀,定容至25 mL。20℃条件下避光静置1 h。于波长530 nm处测定初始吸光度值A0,然后将样品分别置于3个不同温度(60、80、100℃)的恒温水浴锅中,每隔1小时取样,用自来水迅速冷却至室温后,在530 nm波长处测定其吸光度值At。以未酰化的锦葵素-3,5-O-双葡萄糖苷单体进行对照。
1.2.4 花色苷保存率值计算
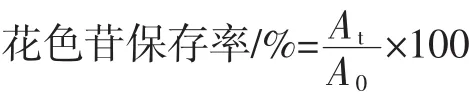
式中:A0为热处理前溶液的吸光度;At为热处理t h后溶液的吸光度。
1.2.5 色差值的测定
色泽以亮度L*值、红绿a*值、黄蓝b*值表示。取热处理后的酶促酰化花色苷溶液5mL,用测色色差计测定其色泽。记录L*、a*、b*数值。以未酰化的花色苷样品为对照。
1.2.6 刺葡萄花色苷的测定
参照邓洁红[2]的方法,采用pH示差法测定花色苷含量。
1.2.7 酶促花色苷热降解动力学参数
花色苷的降解动力学反应基本上符合零级或一级动力学模型[10]。花色苷溶液的吸光度与浓度成正比例关系,,得到花色苷含量的变化与处理时间的关系为:

1.2.7.1 花色苷半衰期
花色苷半衰期公式如下:

式中:t为热处理时间,h;A0为热处理前溶液的吸光度;At为热处理t h后溶液的吸光度;k为反应速率常数;Ct为花色苷初始浓度;C0为花色苷最终浓度。
1.2.7.2 活化能Ea
Arrhenius证明热降解反应速率常数与反应温度T之间存在联系。活化能Ea计算公式如下:
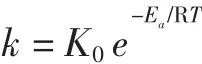
建立得到花色苷热降解动力学模型:

式中:K0为频率常数,对于指定的反应,A与反应物的浓度和温度无关;R为气体常数,8.314×10-3kJ/(mol·K);Ea为活化能,kJ/mol;T 为绝对温度,K;k 为反应速率常数。
1.2.7.3 温度系数Q10
温度系数Q10,表示温度每升高10℃,反应速率变化的量比,见公式:

式中:Q10为温度系数;k1、k2为分别为当温度为T1、T2时的反应速率;T1、T2为热处理前、后的温度,℃。
1.2.8 数据处理分析
试验设置2次重复,结果表示为平均值±标准差。试验数据采用SPSS 17.0软件进行分析(差异显著性水平设置为 p<0.05)。
2 结果与分析
2.1 酶促酰化对锦葵啶葡萄糖苷溶液热稳定性的影响
酶促酰化处理对锦葵啶葡萄糖苷保存率的影响如图2所示。

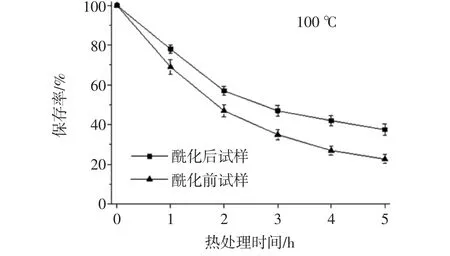
图2 酶促酰化对锦葵啶葡萄糖苷热稳定性的影响Fig.2 Effects of enzymatic acylation on the thermal stability of malvidin glucoside
由图2可见,无论是酰化还是未酰化的样品,花色苷保存率随着加热温度的升高和加热时间的延长均呈下降趋势,但酶促酰化样品下降较为迟缓。经过CAL-B酶促酰化后的锦葵啶葡萄糖苷溶液,在加热条件为60、80、100℃的处理过程中,花色苷保存率显著高于酶处理前(p<0.05)。100℃热处理5 h,其花色苷保留率为37%,而未酰化样品仅为20%,这表明在加热条件下,酶促酰化使锦葵花色苷单体的热稳定显著提高,提高了花色苷单体的热稳定性。
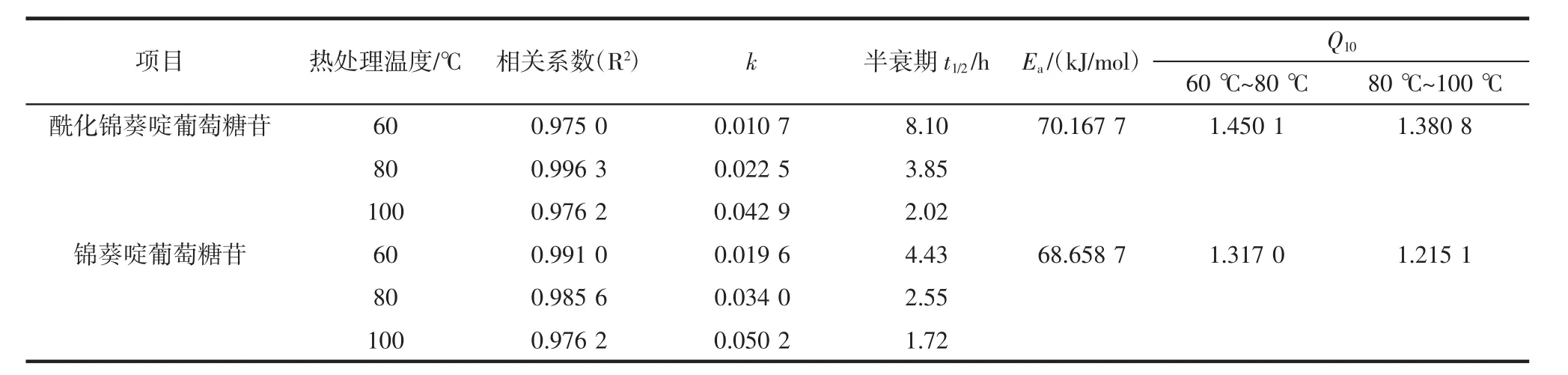
表1 酶促酰化对锦葵啶葡萄糖苷热降解动力学参数的影响Table1 Effects of enzymatic acylation on the thermal degradation kinetics parameters of malvidin glucoside
2.2 酶促酰化对刺葡萄花色苷单体热降解动力学参数的影响
2.2.1 酶促酰化锦葵啶葡萄糖苷单体热降解动力学特征及热降解动力学参数
分别用锦葵啶刺葡萄花色苷单体以及酶促酰化锦葵啶刺葡萄花色苷单体样品,以-ln(Ct/C0)为纵坐标,热处理时间t为横坐标作图线性回归得到相关系数R2,两者一级反应模型下的相关系数均R2>0.97,锦葵啶葡萄糖苷及其酶促酰化产物热降解规律线性关系良好,符合热降解动力学特征。酶促酰化对锦葵啶葡萄糖苷热降解动力学参数的影响见表1。
由表1可知,酶促酰化处理锦葵啶刺葡萄花色苷单体前后两者一级降解常数k数值均随着温度的升高均增大;半衰期t1/2随着热处理温度升高急剧下降,符合花色苷一般热降解规律。其次,酶促酰化能减少温度对花色苷自聚合稳定作用的干扰,提高分子内辅色效应和提高溶液体系的耐热性。在不同加热温度条件下,经酶促酰化处理的锦葵啶刺葡萄花色苷单体k值均小于未经处理的花色苷单体;同样,经酶促处理的花色苷单体溶液半衰期时间也均大于未经处理的。当处理温度为60℃时尤为明显,经过酶促处理花色苷单体半衰期为8.10 h远大于未经酶促处理花色苷单体溶液的4.43 h。
3个温度(60,80,100℃)热处理下酶促酰化锦葵啶葡萄糖苷半衰期比未酰化的样品分别延长3.67、1.3、0.3 h。最后,在发生自聚合的花色苷溶液中,Ea(酶促酰化锦葵啶葡萄苷单体溶液)>Ea(锦葵啶葡萄苷单体溶液),Ea值分别为 70.167 7、68.658 7 kJ/mol。
Q10值反映了样品热反应速率常数k值对温度升高的敏感程度。当加热温度从60℃提高至80℃、80℃提高至100℃时,花色苷的降解速度总体加快。酶促酰化后锦葵啶葡萄糖苷的Q10值相比未酰化样品稍大,说明酶促酰化处理能提高花色苷在特定加热温度下的热稳定性,但对钝化其对加热温度变化的敏感性没有明显作用。
2.2.2 锦葵啶葡萄糖苷热降解动力学方程的建立
根据表1的参数建立酶促前后锦葵啶葡萄糖苷自聚合热降解动力学方程,即锦葵啶葡萄糖苷及酶促酰化产物热降解动力学预测模型见表2。

表2 锦葵啶葡萄糖苷热降解动力学方程式Table2 Thermal degradation kinetic equations of malvidin glucoside
2.3 酶促酰化对锦葵啶葡萄糖苷加热条件下色差的影响
多数研究只对分子修饰后的花色苷的最大吸光度值进行检测。要全面了解花色苷的热稳定特性,对其呈色变化进行分析非常必要。研究选取80℃热处理的样品,进行色差指标的检测,对比分析酶促酰化对锦葵啶葡萄糖苷呈色的影响。
2.3.1 酶促酰化对锦葵啶葡萄糖苷加热条件下亮度L*的影响
80℃热处理5 h内,锦葵啶葡萄糖苷样品的亮度L*值如图3所示。
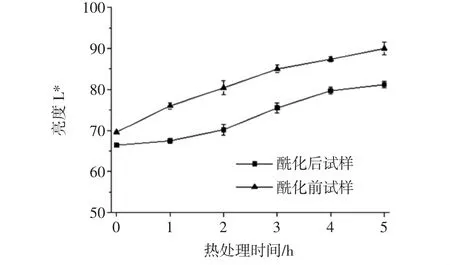
图3 酶促酰化对锦葵啶葡萄糖苷样品亮度L*的影响Fig.3 Effects of enzymatic acylation on L*of malvidin glucoside samples
由图3可知,在热处理条件下,酶促酰化前后的锦葵啶葡萄糖苷L*变化略有不同,但基本呈现相同规律。即随着热处理时间延长,亮度增加,花色苷颜色变淡。这与热处理花色苷单体变化的规律结果相同,花色苷含量与L*值呈负相关性。其中,酶促酰化提高花色苷单体稳定性,锦葵啶刺葡萄花色苷单体亮度L*变化率(29.3%)远大于酶促酰化处理的花色苷单体(22.3%)。
2.3.2 酶促酰化对锦葵啶葡萄糖苷酶热处理条件下红绿色调a*的影响
80℃热处理5 h内,锦葵啶葡萄糖苷样品的红-绿色调a*值如图4所示。

图4 酶促酰化处理对锦葵啶葡萄糖苷样品a*的影响Fig.4 Effects of enzymatic acylation on a*of malvidin glucoside samples
由图4可知,随着热处理时间延长,锦葵啶花色苷a*变化规律与L*相反,即随着热处理时间延长,a*值降低,花色苷红色色调变淡。但经酶促酰化引入外源酰基基团后,酰化锦葵啶花色苷a*值增加到19.02(未酰化锦葵啶花色苷a*值为17.21),与糖苷化与酰化能增强花色苷红色色调研究结论相符[11]。并且,经酶促酰化后的锦葵啶葡萄糖苷热稳定性更好。虽然a*值均随着时间增长而减少,与未经酶促酰化的锦葵啶葡萄糖苷相比,变化幅度较小,下降速率更慢。
2.3.3 酶促酰化对锦葵啶葡萄糖苷热处理条件下黄蓝色调b*的影响
80℃热处理5 h内,锦葵啶葡萄糖苷样品的黄-蓝色调b*值如图5所示。

图5 酶促酰化处理对锦葵啶葡萄糖苷样品b*的影响Fig.5 Effect of enzymatic acylation on b*of malvidin glucoside samples
由图5可知,随着热处理时间延长,锦葵啶葡萄糖苷以及经过酶促酰化葡萄糖苷溶液b*值变化均呈上升趋势,蓝色色调减弱,黄色色调增加,总体变化量酶促酰化后试样整体变化量b*(3.22)小于酰化前试样变化量b*(4.80);其次,经酶促酰化后锦葵啶葡萄糖苷b*值由(-2.57)变化到(-1.89),蓝色色调增加。
3 讨论
酰化前后锦葵啶葡萄糖苷热降解反应仍符合一级反应动力学模型,与文献报道的黑莓汁、桑葚等中的花色苷热降解规律相一致[12-13]。无论是酰化还是未酰化的花色苷,随着加热温度升高,花色苷溶液的稳定性呈下降趋势,降解速率加快。有研究解释说明花色苷发生热降解失色,是由于花色苷母核结构受温度影响,水解变成甲醇假碱形式,花色苷结构平衡被打破转化成无色查尔酮结构[14-15]。研究表明,花色苷含量与a*值呈正相关性,与L*值呈负相关性,所以加热条件下花色苷样品的呈色指标发生相应变化,本文研究与相关文献结论相符[16]。研究还发现,酶促酰化提高了锦葵啶葡萄糖苷的热稳定性,可能是引入的外源酰基基团能降低花色苷分子的极性,而且由自身立体构型产生阻碍作用,降低花色苷对亲核攻击的敏感度。
4 结论
锦葵啶葡萄糖苷以及酶促酰化产物在热处理条件下,降解规律均符合一级反应动力学模型,但酶促酰化反应提高了锦葵啶葡萄糖苷的热稳定性。在中等温度条件下,酰化锦葵啶葡萄糖苷自聚合效应使其耐热性提高,但长时间处于高温条件下,花色苷仍易分解。但酶促酰化处理延长花色苷的半衰期,且酰化样品活化能Ea(70.167 7 kJ/mol)大于未酰化样品Ea(68.658 7 kJ/mol);但高温处理条件下,酶促酰化降低花色苷对温度变化敏感度较未酰化锦葵啶葡萄糖苷不明显。热处理后锦葵啶葡萄糖苷受热分解,花色苷含量降低,亮度L*值升高,a*值降低,b*值上升,经酶促酰化处理后的花色苷单体总体色差变化幅度较小。

