新疆黑果小檗根皮和根木质部提取物的体外抑菌活性比较研究
朱慧敏,李 莉
(新疆医科大学药学院,乌鲁木齐 830000)
新疆黑果小檗(BerberisheteropodaSchrenk)是小檗科(Berberisheteropoda)小檗属(Berberisheteropoda.L.)灌木植物[1-2],又名刺黄连、刺黄柏和则热克(维吾尔药名)。小檗根气微,味苦,小檗根皮性凉,有清热泻火的作用[3-4]。近年来研究发现,黑果小檗主要含有生物碱[5-6]、黄酮[7]、色素[8]、花色苷[9-10]和脂肪酸等[11]物质。现代药理学研究表明,黑果小檗具有抗菌[12]、抗肿瘤[13]、抗氧化[14]、诱变[15]和抗肝损伤[16]等广泛的药理作用。资源分布广泛,开发潜力很大[17]。在民间,本属植物根皮常代替黄柏、黄连药用。维吾尔医、哈萨克医常用其治疗胃肠炎、痢疾、痔疮、急性结膜炎和泌尿系统感染等,具有抗菌消炎的作用[18]。研究发现[19],新疆黑果小檗中的小檗碱和小檗胺对金黄色葡萄球菌等肠道致病菌具有抑制作用。因此,本实验结合牛津杯法与倍比稀释法[20-21]对新疆黑果小檗对肠道致病菌的抑菌作用进行研究,为药用植物资源的开发利用提供科学依据。
1 仪器与材料
1.1仪器 ES-315高压灭菌锅(日本TOM Y Seiko有限公司);HH-S4恒温水浴锅(金坛市医疗仪器厂);DHP-9082电热恒温培养(上海一恒科技有限公司);TS-2102C恒温培养振荡器(上海天呈实验仪器制造有限公司);SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司);TB-114电子分析天平(北京赛多利斯天平有限公司);内径Φ6.0 mm×10.0 mm牛津杯(上海仪翀科技发展有限公司)。
1.2试药 新疆黑果小檗根于2015年9月采自乌鲁木齐市东白杨沟,由新疆医科大学药学院生药学教研室帕丽达·阿布利孜教授鉴定为小檗科小檗属植物黑果小檗(BerberisheteropodaSchrenk)的根。室温阴干,粉碎,备用。阿莫西林胶囊(中诺药业有限公司,批号06107627);金黄色葡萄球菌(批号CMCC 16412)、大肠杆菌(批号CMCC 44102)、铜绿假单胞菌(批号MCCCB 10104)和粪肠球菌(批号ATCC 2912),均由新疆维吾尔自治区药品检验所提供。
1.3材料 M-H琼脂培养基(批号20160217),M-H肉汤培养基(批号20161107),青海高科园海博生物技术有限公司;注射用生理盐水(国药集团新疆制药有限公司,批号150303);水为自制蒸馏水。
2 方法与结果
2.1方法
2.1.1样品溶液的制备 分别称取50 g黑果小檗根皮、根木质部,置于1 000 mL圆底烧瓶中,分别加入10倍量甲醇溶液,70 ℃回流提取2次,每次提取2 h,取出,再称定质量,用甲醇补足减失的质量,滤过,合并滤液,60 ℃减压回收甲醇,得甲醇提取物浸膏。将所得甲醇提取物浸膏置于100 mL量瓶中,加水溶解,稀释至刻度。分别用石油醚、二氯甲烷、乙酸乙酯、正丁醇和丙酮依次萃取,得不同溶剂萃取液,挥干溶剂,得不同溶剂萃取物浸膏,称定质量。精密称取一定量不同溶剂萃取物浸膏,分别置于5 mL量瓶中,加水溶解并稀释至刻度,摇匀,得一定质量浓度的样品溶液,0.22 μm滤膜过滤除菌,4 ℃冰箱中冷藏,备用。见表1。
表1各样品称样量及质量浓度
Tab.1 Samples weight and concentration

提取部位有效部位名称称样量/mg质量浓度/mg·mL-1回流法提取根皮石油醚部位(A)112.25022.450二氯甲烷部位(B)144.87528.975乙酸乙酯部位(C)320.25064.050正丁醇部位(D)350.00070.000丙酮部位(E)262.00052.400 回流法提取根木质部石油醚部位(K)339.62567.925二氯甲烷部位(L)137.87527.575乙酸乙酯部位(M)55.75011.150正丁醇部位(N)142.37528.475丙酮部位(O)303.75060.750
2.1.2抗菌药物储存液的制备 精密称取阿莫西林10.8 mg,置于5 mL量瓶中,加水溶解并稀释至刻度,摇匀,得质量浓度为2.16 mg·mL-1的对照品溶液,0.22 μm滤膜过滤除菌,将配制好的抗菌药物贮存液贮存于4 ℃冰箱中,备用。
2.1.3培养基的制备 使用NCCLS推荐使用Mueller-hinton(M-H)琼脂培养基以及Mueller-hinton(M-H)肉汤培养基,pH值为7.2~7.4。需氧菌及兼性厌氧菌在此培养基中生长良好。
2.1.3.1M-H琼脂培养基的配制 将41.2 g M-H琼脂培养基,缓慢搅拌加入盛有1 000 mL热水的具塞锥形瓶中,待培养基全部融化,封住瓶口,置于121 ℃灭菌锅中湿热灭菌30 min。
2.1.3.2M-H肉汤培养基的配制 将21.0 g M-H肉汤培养基,缓慢搅拌加入盛有1 000 mL热水的具塞锥形瓶中,待培养基全部融化,封住瓶口,置于121 ℃灭菌锅中湿热灭菌30 min。
2.1.4细菌生长法制备菌悬液 分别将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌和粪肠球菌的冻存菌室温融化后,在超净工作台中,用经高压湿热灭菌的接种环挑取适量细菌培养物,以划线方法将细菌涂布于M-H平面培养基上,置于35~37 ℃、5%~10% CO2的电热恒温培养箱中,培养18~24 h。用接种环分别挑取上述4种菌的单个菌落,接种于M-H液体培养基内,置于35~37 ℃恒温培养振荡器中培养24 h,用注射用生理盐水调节菌液浓度至0.5麦氏标准浓度(1×108cfu·mL-1),备用。
2.1.5抑菌活性研究
2.1.5.1平板制备 将直径90 mm、高16~17 mm的平底双碟置于超净工作台上,用经高压湿热灭菌的棉签蘸取一定量2.1.4项下制备的0.5麦氏标准浓度的细菌悬液均匀涂抹于碟底,注入融化状态的2.1.3.1项下制备的M-H琼脂培养基4 mm,使其在碟底均匀摊布,待其凝固,作为底层。另取2.1.3.1项下的M-H琼脂培养基10 mL,放冷至48~50 ℃,加入2.1.4项下制备的菌悬液100 μL,摇匀,在底层均匀摊布,作为菌层。
2.1.5.2牛津杯法测定抑菌活性 待2.1.5.1项下制备的的平板冷却后,在各平板中以等距离均匀放置已灭菌的牛津杯3个,分别加入100 μL的供试品溶液和抗菌药物贮存液,同时以相同体积的蒸馏水作为空白对照,将平板置于35~37 ℃恒温培养箱中,培养24 h后观察并测量抑菌圈大小,平行3次实验。
2.1.5.3常量肉汤稀释法的最小抑菌质量浓度(Minimum Inhibitory Concentration,MIC)测定 取无菌试管(13 mm×100 mm)13支,排成一排,每管加入2.1.3.2项下制备的M-H肉汤培养基1 mL以及2.1.4项下制备的菌悬液20 μL,在第1管中加入供试品原液1 mL,混匀,吸取1 mL加入第2管,混匀,再吸取1 mL加入第3管,如此连续倍比稀释至第11管,并从第11管中吸取1 mL弃去,第12管为不含供试品的生长对照,第13管为加等体积蒸馏水的生长对照。将接种好的稀释管密塞,置于35~37 ℃恒温培养振荡器中培养24 h,观察各试管的澄清度。若试管显示澄清,说明试药对实验菌有抑菌作用;若试管显示浑浊,则说明试药对实验菌无抑菌作用。澄清试管的最低质量浓度为最小抑菌质量浓度。

2.2结果
2.2.1抑菌活性 用毫米尺测量抑菌圈的大小。若试药对实验菌有抑菌活性,则牛津杯/药敏片周围的培养基上出现肉眼可见的透明圈,反之则无。抑菌圈越大,说明该菌对此药敏感性越大,反之越小;若无抑菌圈,说明此药对该菌无抑菌效果。结果见表2。
表2牛津杯法测定黑果小檗根皮、根木质部不同萃取部位浸膏的抑菌活性结果
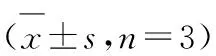
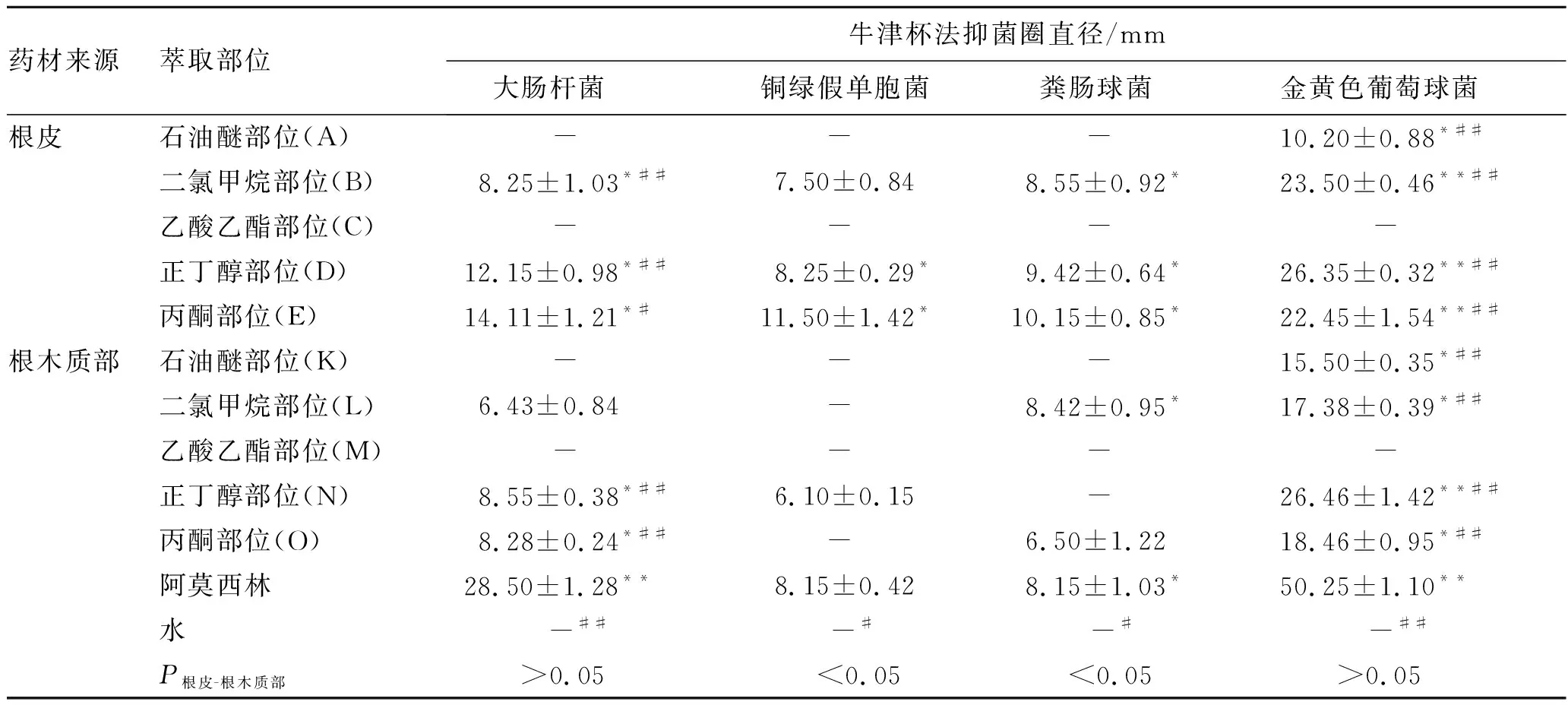
药材来源萃取部位牛津杯法抑菌圈直径/mm 大肠杆菌铜绿假单胞菌 粪肠球菌金黄色葡萄球菌根皮石油醚部位(A)- - - 10.20±0.88*##二氯甲烷部位(B) 8.25±1.03*## 7.50±0.84 8.55±0.92*23.50±0.46**##乙酸乙酯部位(C)- - - - 正丁醇部位(D)12.15±0.98*## 8.25±0.29* 9.42±0.64*26.35±0.32**##丙酮部位(E)14.11±1.21*#11.50±1.42*10.15±0.85*22.45±1.54**##根木质部石油醚部位(K)- - - 15.50±0.35*##二氯甲烷部位(L) 6.43±0.84- 8.42±0.95*17.38±0.39*##乙酸乙酯部位(M)- - - - 正丁醇部位(N) 8.55±0.38*## 6.10±0.15- 26.46±1.42**##丙酮部位(O) 8.28±0.24*##- 6.50±1.2218.46±0.95*##阿莫西林28.50±1.28** 8.15±0.42 8.15±1.03*50.25±1.10**水-## -# -# -## P根皮-根木质部 >0.05 <0.05 <0.05 >0.05
注:与空白组比较*P<0.05,**P<0.01;与阿莫西林比较#P<0.05,##P<0.01。-表示无抑菌作用。
由表2可知,供试品对大肠杆菌产生的抑菌圈大小为:阿莫西林>E>D>N>B=O>L;对铜绿假单胞菌产生的抑菌圈大小为:E>D>B>阿莫西林>N;对粪肠球菌产生的抑菌圈大小为:E>D>B>L>阿莫西林>O;对金黄色葡萄球菌产生的抑菌圈大小为:阿莫西林>D=N>B>E>O>L>K>A。
与空白组比较,提取物B、D和E对大肠杆菌的抑制作用高于空白组(P<0.05),阿莫西林对大肠杆菌的抑制作用显著高于空白组(P<0.01),提取物D、E和阿莫西林对铜绿假单胞菌的抑制作用高于空白组(P<0.05),提取物B、D、E、L和阿莫西林对粪肠球菌的抑制作用高于空白组(P<0.05),提取物A、K、L和O对金黄色葡萄球菌的抑制作用高于空白组(P<0.05),提取物B、D、E、N和阿莫西林对金黄色葡萄球菌的抑制作用显著高于空白组(P<0.05)。
通过两样本独立t检验对比根皮、根木质部的抑菌活性可知,对于4种肠道致病菌而言,根皮与根木质部的抑菌活性相当(P>0.05)。
综上所述,培养24 h后,黑果小檗萃取物对大肠杆菌、铜绿假单胞菌、粪肠球菌和金黄色葡萄球菌的抑菌圈直径分别在6.43~14.11,6.10~11.50,6.50~10.15和10.20~26.46 mm范围内。
2.2.2最小抑菌质量浓度测定结果 在2.2.1实验结果基础上,研究浸膏A、B、D、E、K、L、N和O的MIC。结果见表3。
由表3可知,浸膏A对金黄色葡萄球菌的MIC为5.613 mg·mL-1;浸膏B对大肠杆菌、粪肠球菌、铜绿假单胞菌和金黄色葡萄球菌的MIC分别为1.811,7.244,14.488和0.453 mg·mL-1;浸膏D对大肠杆菌、粪肠球菌、铜绿假单胞菌和金黄色葡萄球菌的MIC分别为4.375,17.50,8.75和0.547 mg·mL-1;浸膏E对大肠杆菌、粪肠球菌、铜绿假单胞菌和金黄色葡萄球菌的MIC分别为3.275,13.1,13.1和0.409 mg·mL-1;浸膏K对金黄色葡萄球菌的MIC为1.061 mg·mL-1;浸膏L对大肠杆菌、粪肠球菌和金黄色葡萄球菌的MIC分别为6.894,13.788和1.723 mg·mL-1;浸膏N对大肠杆菌、铜绿假单胞菌和金黄色葡萄球菌的MIC分别为7.119,14.238和0.445 mg·mL-1;浸膏O对大肠杆菌、粪肠球菌和金黄色葡萄球菌的MIC分别为15.188,30.375和1.898 mg·mL-1。
表3浸膏对4种致病菌的最小抑菌质量浓度(MIC)测定结果
Tab.3 The determination results of minimum inhibitory concentration (MIC) of the extracts on 4 kinds of test bacteria(mg·mL-1)

萃取部位大肠杆菌粪肠球菌铜绿假单胞菌金黄色葡萄球菌A- - - 5.613B1.8117.24414.4880.453D4.37517.5008.7500.547E3.27513.10013.1000.409K- - - 1.061L6.89413.788- 1.723N7.119- 14.2380.445O15.18830.375- 1.898
注:-表示无抑菌作用。
综上所述,浸膏A、B、D、E、K、L、N和O对4种致病菌均有不同程度的抑制作用,培养24 h后,黑果小檗萃取物对大肠杆菌、铜绿假单胞菌、粪肠球菌和金黄色葡萄球菌的最小抑菌质量浓度分别为1.811~15.188,8.750~14.488,7.244~30.375和0.409~5.613 mg·mL-1。
3 讨论
由实验结果可知,新疆黑果小檗根部对4种致病菌均有不同程度的抑制作用,本实验通过不同溶剂萃取根皮与根木质部甲醇提取物水溶液中所得不同有效部位进行抗菌实验,同时对比根皮与根木质部对抑菌效果的影响,结果表明,根皮与根木质部对4种致病菌的抑菌效果无差别(P>0.05),根皮与根木质部抑菌活性相当。维吾尔医常以根皮入药,通过实验研究发现,黑果小檗根木质部也具有一定的抑菌活性,其中根皮与根木质部对于金黄色葡萄球菌的抑菌作用最强,对铜绿假单胞菌具有抑菌作用的部位较少,由此可见,黑果小檗根部不同有效部位对不同肠道致病菌的抑菌效果不一,根木质部也可作为用药部位,且具有调节肠道菌群平衡的作用。
黑果小檗是我国较为重要的药用植物资源之一,目前对黑果小檗的研究主要集中于种类差异、成分分析等,针对黑果小檗抑菌作用的研究较少。本文采用牛津杯法和试管倍比稀释法对新疆黑果小檗根皮及根木质部的体外抑菌活性做了较全面的探究。实验结果表明,黑果小檗根皮及根木质部萃取液对肠道革兰氏阴性菌以及革兰氏阳性菌等致病菌均有一定的抑制作用。本文验证了黑果小檗根皮及根木质部确切有效的抑菌活性,对于开发广谱新型中药抗菌药物具有一定的指导意义,为黑果小檗用药部位的选择及研究黑果小檗治疗由菌群紊乱引起的肠道疾病奠定基础。

