低温及贮藏年份对芍药种子生根及其生理特性的影响
张梅娟,谢 军, ,孙辑凯,沙 伟, ,张 捷,马天意*
(1 齐齐哈尔大学 生命科学与农林学院, 黑龙江齐齐哈尔 161006; 2 东北林业大学 园林学院, 哈尔滨 150040; 3 齐齐哈尔医学院 药学院, 黑龙江齐齐哈尔 161005)
芍药(PaeonialactifloraPall.)属于芍药科(Paeoniaceae)芍药属,是中国传统名花,观赏价值极高且耐粗放管理,常被应用于园林、医药等方面[1-2]。芍药在园林应用中需求量大,但由于芍药种子具有特殊的上、下胚轴双重休眠特性,导致其萌发率低,严重影响芍药的产量,也对芍药的栽培育种等工作产生阻碍[3-5]。虽然可采用其他方法对芍药进行营养繁殖,但播种繁殖是获得实生苗的唯一途径,且具有其他方法不可替代的重要地位,仍然是芍药繁殖的主要方法[6]。
芍药原产于俄罗斯的西伯利亚地区和中国北部[2],很多原产温带和寒带的植物种子都具有休眠特性[7],芍药也不例外。种子休眠是个对植物有利的特性,受到内部和外部环境等因素的共同控制[7-8]。国内外对芍药种子休眠的原因与机理还没有形成统一的认识,但在前人的研究中发现,芍药种子休眠的内部原因大体可以归结为两种,一是种子内萌发抑制物质的作用,二是种皮及其附属物造成了萌发障碍[9]。而芍药种子萌发时,根系生长与幼苗生长所需要的外界环境条件是不同的[3],这是因为芍药种子具有上下胚轴双重休眠的特性,打破上下胚轴休眠所需的外部环境条件不同,因此需要分别进行研究。
芍药种子休眠的解除是其播种繁殖的基础,因此,打破芍药种子的休眠使其尽快萌发,对提高芍药播种繁殖效率的意义重大。在打破芍药种子休眠的过程中,必须先打破下胚轴休眠再打破上胚轴休眠,打破下胚轴休眠是解除芍药休眠的第一步,是芍药播种繁殖工作的重中之重[10]。在前人的研究中,打破芍药种子下胚轴休眠的方法主要有:使用机械打磨或化学试剂对种皮进行处理,降低种皮厚度;使用植物激素对芍药种子进行萌发诱导;改变萌发介质条件等[11-13],而关于不同温度处理对芍药种子下胚轴萌发影响的研究较少。岳桦等[13]曾采用先高温再低温的变温处理方法,对沙藏生根过程中的芍药种子进行了温度处理,发现25 ℃恒温处理30 d后、15 ℃恒温处理90 d的综合变温处理能够显著提高芍药下胚轴破眠效果。然而,关于在沙藏前对芍药种子进行低温处理的研究较少,沙藏前低温处理对芍药种子萌发生根的影响尚不明确。
种子在不同萌发阶段的生理生化变化可以反映种子萌发过程中的内在机制,对萌发过程中生理生化变化的研究有利于探索芍药种子破眠的条件。关雪莲等[14]以沙藏过程中新疆块根芍药(Paeoniaanomala)种子为实验材料,采用5种不同的沙藏和赤霉素(gibberellic acid 3, GA3)处理,发现在不同处理中可溶性糖、可溶性蛋白含量均呈现先增加后减少的趋势,且GA3与沙藏相结合处理种子的可溶性糖、可溶性蛋白增加量明显高于单独沙藏处理。孙晓梅等[15]着重分析了超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)在芍药种子吸胀及沙藏过程中的动态变化,发现在吸胀12 h时芍药种子开始萌发,SOD发挥作用时期较早,SOD和POD的活性与种子萌发呈负相关,CAT活性与萌发呈正相关。李敏[16]报道,GA3处理芍药种子生根过程中SOD、POD、CAT的活性随着芍药种子沙藏时间的延长而增强,而丙二醛(malondialdehyde, MDA)含量下降,苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)和蔗糖转化酶活性先增强后减弱。这些研究为不同条件下芍药种子萌发过程中的内在变化机制的解释提供了支撑,但芍药种子生根不同阶段中更详细完备的生理生化信息还需要大量的工作来补充完善。
因此,本研究对芍药种子先后进行了低温和沙藏处理,在低温处理中设置了-20 ℃和-40 ℃2种温度梯度,以及15、30、45、60 d的处理时间梯度,以更加细致地探讨低温对解除芍药种子下胚轴休眠的作用;同时,本研究还采用3个不同贮藏年份的芍药种子作为实验材料,考察了芍药种子在存放不同年份时低温处理对其生根的影响,并对不同贮藏年份芍药种子生根不同阶段的生理生化变化进行了测定,以期更好地解释贮藏年份对芍药种子下胚轴休眠解除的影响机制。本研究结果将为芍药种子的采收、栽培、育种奠定理论基础和方法学指导,以加速芍药种子萌发,增加芍药的产量,促进芍药更好地在园林观赏中应用。
1 材料和方法
1.1 实验材料
选取当年采收和采后存放1年、2年的芍药种子为实验材料。当年采收的芍药种子采收时间为2016年8月;贮藏1年和2年的芍药种子采收时间分别为2015年8月和2014年8月,采集地点均为齐齐哈尔医学院芍药圃。芍药种子采收后放入密封容器置于4 ℃冰箱中,低温密闭贮存,从贮存之日起1年或2年后取出用于试验分析。种子用清水冲洗后,取大小均匀,下沉的饱满种子用于生根实验。
1.2 种子萌发过程观察
选取整齐度一致的新鲜芍药种子,在室温条件下同时对不同贮藏年份的芍药种子先分别于清水中浸泡30 min,选取下沉的种子20粒,用0.5%高锰酸钾溶液浸泡20 min消毒后冲洗净,然后进行室温沙藏。沙藏时将高温灭菌20 min的河沙与种子按3∶1的体积比混匀,沙子湿度为沙子最大持水量的50%。在芍药种子室温沙藏过程中,对萌发不同天数的芍药种子进行形态观察,观察时将种子从沙中取出洗净后进行图像采集,设置3次生物学重复。
1.3 持续低温处理下种子生根指标测定
为研究不同贮藏年份芍药种子在不同程度和时长低温处理下的生根情况,将不同贮藏年份的芍药种子于清水中浸泡30 min,分别取下沉的种子各20粒,使用0.5%高锰酸钾溶液浸泡20 min消毒后冲洗净,于-20 ℃或-40 ℃冰箱中分别处理15、30、45和60 d,以室温(20~25 ℃)条件下生长的芍药种子作为对照,每种处理分别进行3次独立的重复试验。所有处理后的种子同时在室温条件下进行沙藏。在芍药种子低温处理后室温沙藏期间,每7 d观察并记录一次种子的生根情况,实验总天数为84 d。生根实验结束后比较生根结果,计算不同处理下芍药种子的首粒生根时间、生根指数、生根率。生根率和生根指数的计算方法分别为:
生根率=(正常生根种子数/供试种子数)×100%[17]
生根指数(GI)=∑(Gt/Dt),
式中Gt为第t天生根种子数,Dt为相应的种子生根天数[14]。
1.4 不同贮藏年份种子生理指标测定
根据芍药种子生根过程中的形态变化,将芍药种子的生根过程划分为3个阶段,分别为萌前阶段、露白至生根阶段和生根3~5 cm阶段,各贮藏年份的种子分别在此3个阶段取样进行生理指标测定。
1.4.1种子含水量采用低恒温烘干法进行含水量测定[18],含水量(%)=(M2-M3)/(M2-M1)。M1为培养皿重量(g),M2为培养皿和样品的烘前重量(g),M3为培养皿和样品的烘后重量(g)。将不同贮藏年份种子横切后放入培养皿中,放入(103±2)℃的烘箱内18 h,冷却30 min后进行测定,每组样品进行独立的3次生物学重复。
1.4.2可溶性糖含量采用改良的蒽酮比色法[19]进行种子可溶性糖含量测定。将不同贮藏年份芍药种子研磨成粉,取50~100 mg种子粉末,加入4 mL 80%乙醇溶液后,80 ℃水浴加热40 min,3 500 r/min离心10 min后收集上清液,将对沉淀进行第2次提取,合并上清液,定容至25 mL,即得样品提取液。取1 mL样品提取液,加入0.5 mL 2%蒽酮试剂,缓慢加入5 mL浓硫酸,充分摇勾,沸水浴10 min。加热后投入清水中冷却,20 min后使用分光光度计测定620 nm处吸光度(OD)值,使用事先绘制的标准曲线[19]进行可溶性糖含量的计算。每组样品进行独立的3次生物学重复。
1.4.3淀粉含量采用高氯酸蒽酮比色法进行种子淀粉含量测定。标准曲线绘制后[20],进行提取液制备:向提取过可溶性糖的材料沉淀中加入5 mL 9.2 mol/L高氯酸,快速振荡摇匀后静置反应5 min,10 000 r/min离心3 min,将上清移液入100 mL容量瓶,重复3次,用5 mL蒸馏水洗涤沉淀2次,离心3 min,将上清液移入容量瓶定容,摇匀后得到供试液。使用紫外分光光度计测定淀粉含量,测定方法同1.4.2。
1.4.4可溶性蛋白含量采用考马斯亮蓝法[21]进行测定。称取0.3 g种子粉末,加入5 mL蒸馏水研磨均匀后并转移至离心管中,6 000 r/min离心20 min,所得上清液置于50 mL容量瓶中。向离心管中沉淀加入5 mL蒸馏水,进行二次提取,离心后合并上清液,使用蒸馏水定容至50 mL,得到待测液。吸取1 mL待测液于试管中,加入5 mL考马斯亮蓝染液,充分混合后静置3 min,使用分光光度计测定595 nm处OD值,使用事先绘制的标准曲线[21]进行可溶性蛋白质含量的计算。每组样品进行独立的3次生物学重复。
1.4.5过氧化物酶和过氧化氢酶活性不同贮藏年份种子切碎后加入适量的磷酸缓冲液[22]冰浴下研磨成匀浆,3000 r/min离心10 min后将上清液转入25 mL容量瓶中。使用5 mL磷酸缓冲液对沉淀再次提取两次,将上清液并入容量瓶中,定容至刻度后获得待测酶液,4 ℃低温下保存备用,进行过氧化物酶(POD)和过氧化氢酶(CAT)活性测定。
(1) POD活性。采用愈创木酚法[22]测定。将2.9 mL 0.05 mol/L磷酸缓冲液、1.0 mL 2% H2O2、1.0 mL 0.05 mol/L愈创木酚和0.1 mL待测酶液作为实验组,用加热煮沸5 min的待测酶液为对照,立即对实验组和对照组样品进行15 min 37 ℃水浴,然后迅速转入冰浴,并加入2.0 mL 20%三氯乙酸终止反应,离心10 min后适当稀释,使用分光光度计测定4 nm处OD值,使用事先绘制的标准曲线[22]计算POD活性。每组样品进行独立的3次生物学重复实验。
(2)CAT活性。取2支10 mL试管,其中一支为对照组,另一支为待测组。分别向待测组试管内先后加入0.2 mL待测酶液、1.5 mL 0.2 mol/L (pH 7.8)的磷酸缓冲液和1 mL的蒸馏水;同时在对照组试管中加入煮沸的待测酶液。25 ℃预热后,向每个试管中加入0.3 mL 0.1 mol/L的H2O2,每次加入后立即计时,并迅速倒入石英比色杯中,测定240 nm波长下的OD值,每隔1 min读数1次,共测4 min。每组样品进行独立的3次生物学重复,使用事先绘制的标准曲线[22]计算CAT活性。
1.5 数据分析
数据分析方法采用SPSS 17.0进行差异性分析和标准误差分析,采用LSD方法进行多重比较(a=0.05);使用Excel 2007进行数据统计和图表制作。
2 结果与分析
2.1 低温和贮藏年份对芍药种子生根的影响
单因素方差分析结果(表1)显示,贮藏年份、处理温度和处理天数3个因素对芍药首粒种子生根时间、生根指数、生根率均有极显著的主效应,说明3因素单独对各生根指标都有极显著的影响,其中贮藏年份F值最大,对种子生根的影响力最大;主体间效应的多因素方差分析结果表明,3个因素的交互作用对芍药首粒种子生根时间有显著影响,但对其他指标的影响均不显著;同时任意2个因素的交互作用对芍药种子生根的3个参数均无明显影响(表1)。因此,以后着重分析贮藏年份对芍药种子生根及生理指标的影响。
2种低温(-20 ℃和-40 ℃)对芍药种子进行不同天数处理后,不同贮藏年份芍药种子的生根情况如表2所显示。首先,各个贮藏年份芍药种子在2种低温处理15~60 d后,其首粒种子生根时间比室温对照组明显缩短,生根指数和生根率均比室温对照组明显提高,说明各贮藏年份芍药种子在沙藏前进行-20 ℃和-40 ℃低温处理均有助于打破下胚轴休眠,促进种子萌发。但不同的低温处理温度、低温处理时间和贮藏年份对打破下胚轴休眠的效果不同,其中贮藏一年种子在沙藏前进行-40 ℃、30 d的处理效果最佳,首粒种子生根时间最短,只需21d,生根指数最高(1.482),生根率最高(88.33%),而对照组的生根率仅45.00%,最佳处理组生根率比对照组高43.33%(表2)。其次,在相同低温温度和处理时间条件下,贮藏1年的芍药种子首粒种子生根时间、生根指数和生根率等指标均优于当年采收的芍药种子,当年采收种子又优于贮藏2年的芍药种子,说明采收后存放1年的芍药种子最容易萌发生根。同时,相同低温处理温度和种子贮藏年份条件下,随着低温处理时间的延长,首粒种子生根时间呈现先减小后增加的趋势,最小值出现在低温处理30 d;其生根指数和生根率呈现先增加后减小的趋势,最大值都出现在低温处理30 d,说明低温处理的最佳时间是30 d。此外,在控制低温处理时间和种子贮藏年份不变时,芍药种子生根数据指标在-40 ℃低温环境下均优于-20 ℃低温环境。
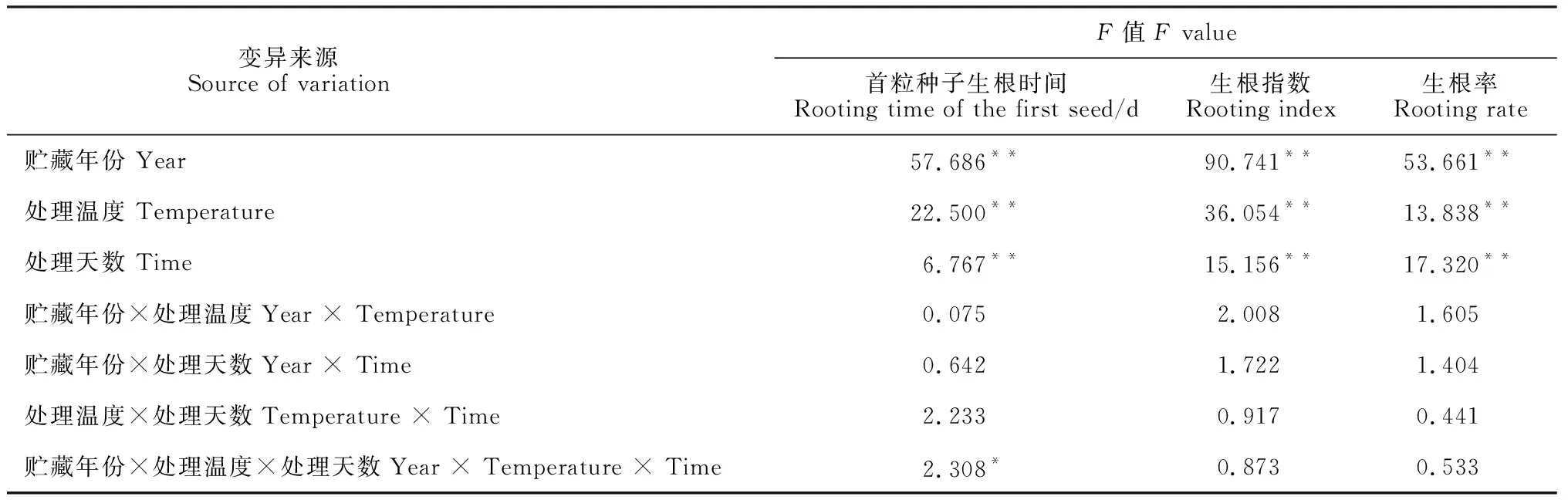
表1 不同低温处理下芍药种子生根影响因素的主体间效应检验
注:**和*表示分别达到0.01和0.05差异显著性水平Note: ** and * mean significant difference at 0.01 and 0.05 level,respectively
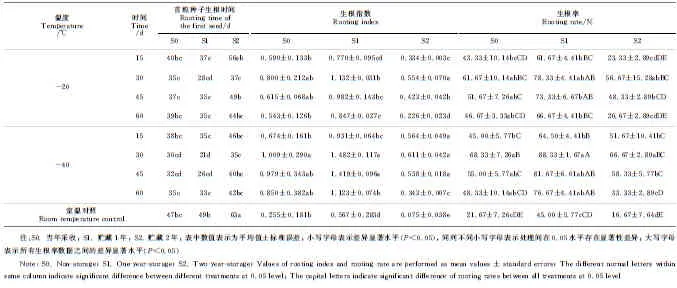
表2 不同低温和处理时间下各贮藏年份芍药种子生根情况
2.2 芍药种子生根过程
为确定生理实验测定的具体取材时间,我们对芍药种子生根过程中的形态变化进行了观察分析,将芍药种子的生根过程划分为3个阶段,分别为萌前阶段、露白至生根阶段和生根3~5 cm阶段。当胚根伸长到种子长度的1/2以后,可以确定种子已萌发生根[23],在时长为84 d的生根实验中,我们观察到沙藏处理后的芍药种子在一段时间后,下胚轴休眠可以被打破,种皮在种脐处开裂,之后胚根不断生长伸长,此时芍药种子进入露白至生根阶段,在此之前为萌前阶段。随后胚根继续不断伸长,达到平均根长为3~5 cm,此时为芍药种子生根3~5 cm阶段(图1),此时我们认为芍药种子下胚轴的休眠被完全打破,根进入正常生长阶段。
2.3 各贮藏年份芍药种子在不同生根阶段生理生化指标分析
本试验发现,尽管不同的低温处理可以促进芍药种子的生根效率,但最显著的影响因素却是芍药种子贮藏年份,即种子采收后的存放时长。为能初步解释不通贮藏年份对芍药种子生根的机制,我们对不同贮藏年份芍药种子在生根不同阶段的生理生化指标进行了检测分析。
2.3.1含水量在种子生根过程中,各贮藏年份的芍药种子含水量均呈现出相同的逐渐上升趋势,且始终表现为当年采收种子>贮藏1年的种子>贮藏2年种子(图2)。其中,当年采收、贮藏1年和贮藏2年芍药种子含水量在萌前阶段至露白生根阶段均上升幅度较大,增幅分别为28.74%、36.06%和38.14%;在随后生根过程中种子含水量缓慢上升,变化幅度较小,三者分别上升了2.29%、2.40%和7.70%。可见,采收后贮藏时间越长的芍药种子在生根时含水量越低,但上升幅度越大。
2.3.2可溶性糖和可溶性蛋白含量不同贮藏年份芍药种子可溶性糖含量在其生根过程中都呈现先上升再下降的变化趋势,并均在露白生根阶段达到峰值,而当根系不断伸长时可溶性糖含量又逐渐减少(图3)。其中,在种子生根过程中,当年采收、贮藏1年和贮藏2年的芍药种子可溶性糖含量先从萌前阶段的10.35%、16.91%和9.29%分别上升至露白生根阶段的12.30%、19.17%和16.40%,然后它们又分别下降至生根3~5 cm阶段的7.91%、14.59%和10.69%;芍药种子可溶性糖含量基本表现为贮藏1年最高,贮藏2年居中,当年采收最低。可见,芍药种子可溶性糖含量在贮藏1年时最高,且其在生根过程中的变化幅度随贮藏年份延长而增加。
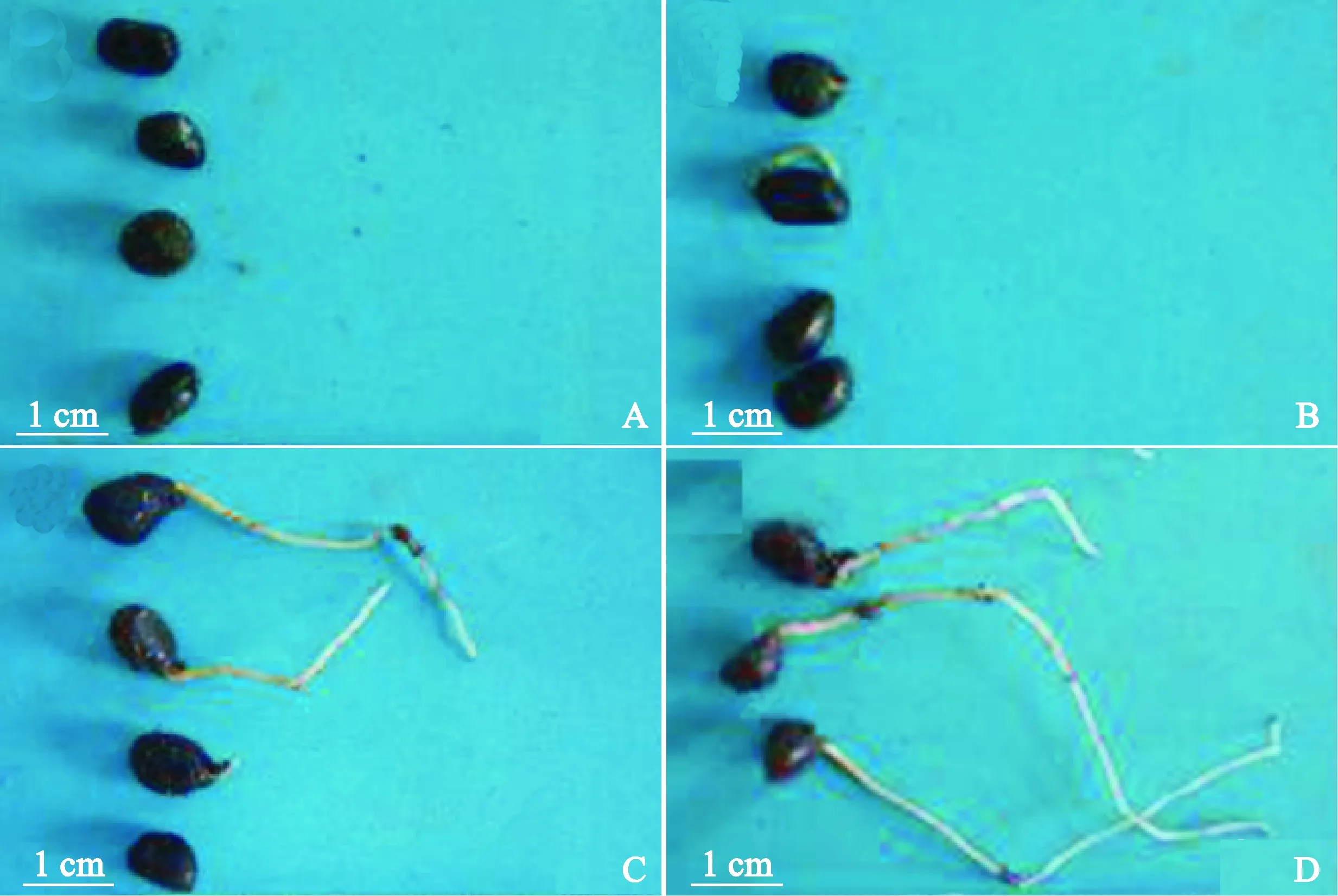
A. 萌前阶段; B、C. 露白至生根阶段; D. 生根3~5 cm阶段图1 芍药种子生根过程的不同阶段A. Before germination; B, C. Exposing stage to rooting stage; D. Rooting to 3-5 cm stage.Fig.1 Different stages of peony seed rooting process
另外,不同贮藏年份的芍药种子可溶性蛋白含量在生根过程中均呈现先下降之后上升的趋势,并均在露白生根阶段可溶性蛋白含量达到最低点(图3)。其中,在种子生根过程中,当年采收、贮藏1年和贮藏2年的芍药种子可溶性蛋白含量从萌前到露白生根阶段分别下降了23.57%、30.06%和16.18%,之后到生根3~5 cm阶段它们又分别上升了16.49%、14.04%和17.93%。贮藏2年的芍药种子可溶性蛋白含量降幅最小,而增幅最大,始终高于其余贮藏年份种子;而贮藏1年种子降幅最大,升幅最小,变化较大,生根后处于较低水平。

误差线表示标准差; 小写字母表示差异显著水平(P<0.05);下同图2 不同贮藏年份芍药种子不同生根阶段中的含水量变化Error bars indicate standard deviations, the normal letters indicate different significant levels (P<0.05);The same as belowFig.2 The changes in water content of peony seeds harvested in different years at different rooting stages
2.3.3淀粉含量当年采收、贮藏1年、贮藏2年的芍药种子在生根阶段的淀粉含量和变化趋势相似,均呈现逐渐迅速下降的趋势(图4)。其中,它们先从萌前阶段的12.97%、13.00%和13.73%分别下降到露白生根阶段的9.75%、10.64%和10.12%,然后继续下降至生根3~5 cm阶段的6.78%、6.98%和5.59%,最终比萌前阶段分别下降了47.73%、46.31%和59.29%,即贮藏2年的芍药种子降幅最大。
2.3.4过氧化物酶和过氧化氢酶活性如图5所示,各贮藏年份芍药种子POD在生根过程中均先升后降,而其CAT活性均先降后升,并分别在露白生根阶段达到最大值和最低值。其中,当年采收、贮藏1年、贮藏2年的芍药种子POD活性从萌前到露白生根阶段分别大幅上升了85.89%、76.19%和112.24%,后从露白生根到生根3~5 cm阶段又分别大幅下降了52.85%、92.57%和85.10%,且最终均低于萌前水平期间种子POD活性始终表现为贮藏1年<当年采收<贮藏2年;同时,当年采收、贮藏1年、贮藏2年的芍药种子CAT活性从萌前到露白生根过程中分别下降了51.35%、24.24%和31.25%,从露白生根到生根3~5 cm过程中又分别上升了72.22%、27.27%和18.18%,期间种子CAT活性始终表现为贮藏1年>当年采收>贮藏2年。可见,在芍药种子生根过程中,各贮藏年份种子中POD活性变化趋势与其CAT活性在某种程度上正好相反,可能在发挥共同的生理作用时表现出互补的功能。
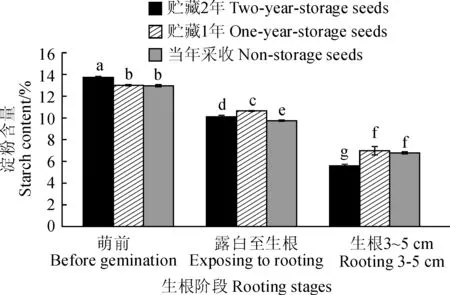
图4 不同贮藏年份芍药种子不同生根阶段中的淀粉含量变化Fig.4 The changes in starch content of peony seeds harvested in different years at different rooting stages

图3 不同贮藏年份芍药种子不同生根阶段中的可溶性糖和可溶性蛋白含量变化Fig.3 The changes in soluble sugar and protein contents of peony seeds harvested in different years at different rooting stages
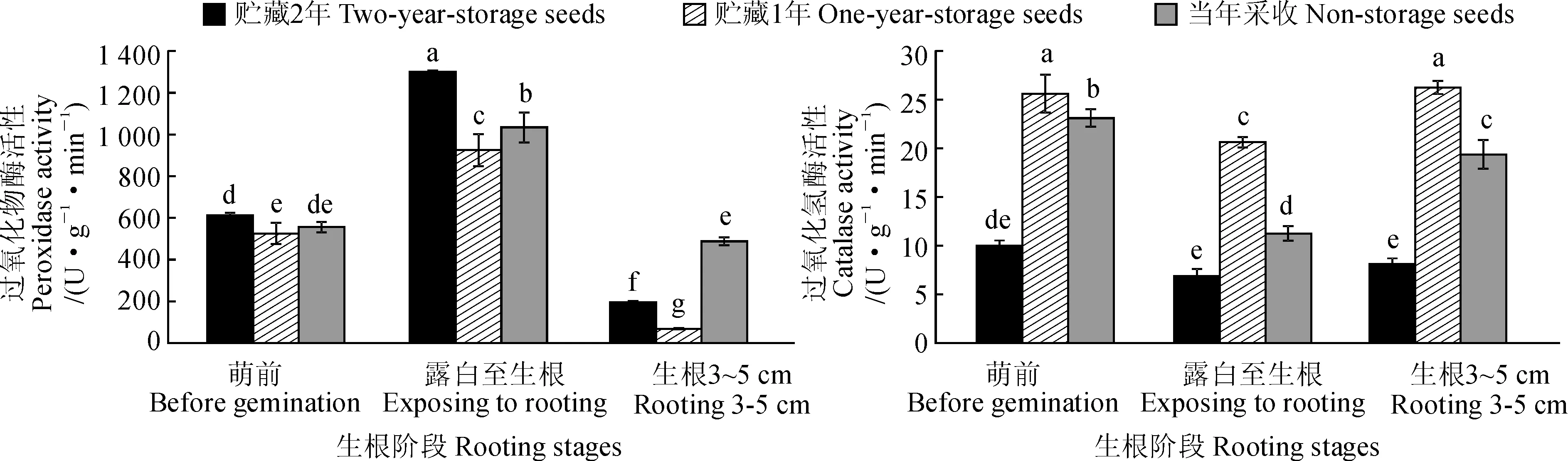
图5 不同贮藏年份芍药种子不同生根阶段中过氧化物酶和过氧化氢酶活性变化Fig.5 The changes in peroxidase and catalase activities of peony seeds harvested in different years at different rooting stages
3 讨 论
3.1 芍药种子的生根过程
在前人的研究中发现,芍药种子的萌发与牡丹相似,可分为萌前期、生根期和发芽期3个阶段,其中芍药种子的生根期又能分为露白和根长3~4 cm 2个阶段[14]。芍药种子的生根过程是连续的,当下胚轴的休眠被打破,胚开始萌动,白色胚根从种脐处伸出,并不断伸长。在本研究中,为便于生理生化指标分析取材时间掌控及种子萌发过程中不同阶段的详细描述,将芍药种子的生根过程分为萌前阶段、露白至生根阶段和生根3~5 cm阶段,以避免芍药种子生根过程中具有争议的过渡阶段。
3.2 低温处理下不同贮藏年份芍药种子生根状况
在本研究的8组低温处理和1组对照的芍药种子生根实验中,低温处理组芍药种子的生根指数和生根率均高于对照组,同时低温组的首粒种子生根时间均低于对照组,各种低温处理下芍药种子的生根效果均优于对照,这说明在种子沙藏前进行低温处理有助于解除芍药种子的下胚轴休眠,促进生根。其中,在同一低温处理下,采收后贮藏1年的芍药种子的首粒种子生根时间最短、生根指数及生根率最高,生根结果优于当年采收和贮藏2年的芍药种子。这可能是由于随着贮藏时间的延长,种子完成了生理后熟,使得生根率大幅度提高,故贮藏1年种子的生根效果优于当年采收的种子。但是如果贮藏时间继续延长,种子中的水分和营养物质逐渐流失,种子的生活力渐渐下降,失活种子增多,导致生根率下降迅速,因此贮藏2年的芍药种子生根结果低于当年采收的芍药种子且远低于贮藏1年的芍药种子。同时,在各种低温处理中,同一贮藏年份下-40 ℃处理后的种子生根效果优于-20 ℃处理,其中又以-40 ℃处理30 d的生根结果最好,其首粒种子生根时间短,生根指数高,生根率高。可见,低温可以加速打破芍药种子下胚轴休眠,促进种子萌发生根,同时更低的温度更有助于打破休眠,在本研究中以-40 ℃低温、处理天数30 d时效果最好。另外,本试验中多因素方差分析发现,尽管不同低温处理可以促进芍药种子的生根效率,但影响种子生根最显著的因素却是芍药种子贮藏年份,即种子采收后的存放时长。
3.3 不同贮藏年份的芍药种子生根过程中的生理生化变化特征
3.3.1芍药种子中相关物质含量的变化首先,在芍药种子贮藏过程中,种子中的水分会不断减少,因此,贮藏时间越长的芍药种子萌前阶段含水量越少;与当年采收的芍药种子萌前含水量(27.81%)相比,贮藏1年(17.20%)和贮藏2年(7.69%)的芍药种子萌前含水量分别减少了10.61%和9.51%。我们发现种子含水量的这种变化趋势与室温条件下不同贮藏年份芍药种子的首粒种子生根时间成正相关,由此我们推测正常条件下种子的含水量一定程度上可能决定芍药种子开始生根的最短时间。
其次,从萌前阶段到露白生根阶段,在适宜的外界条件下,芍药种子的休眠逐渐解除,胚开始萌动,此时可能由于种子中蛋白质、淀粉等不溶的大分子逐渐分解成小分子的可溶性糖,种子可溶性糖含量会逐渐上升;而在露白生根到生根3~5 cm阶段,我们推测因为根系逐渐伸展延长,生理活动消耗了大量可溶性糖,因此种子可溶性糖含量逐渐减少。同样是从萌前到露白生根阶段,芍药种子分解了大量的淀粉用于产生可溶性糖,为种子的萌发生根提供最初的动力和能量,因此该阶段种子淀粉含量应逐渐减少[24];在露白生根到生根3~5 cm阶段,可能由于根系逐渐伸长,植物体需要继续消耗能量,而此时还没有叶片能进行光合作用形成淀粉等物质,因此该阶段种子淀粉含量会减少。我们推测芍药种子中可溶性糖含量在一定程度上决定其生根率,种子的成功生根需要消耗能量,而作为直接能源物质的可溶性糖的含量总体上可能影响芍药种子的生根率。在萌前阶段,贮藏1年的芍药种子中可溶性糖含量远高于当年采收和贮藏2年的芍药种子,这种趋势与各种处理下不同贮藏年份种子的生根率和生根指数的变化趋势基本一致,同时不同贮藏年份种子的可溶性糖含量比例与生根率之间的比例也较为相似。因此,我们猜测萌前阶段芍药种子的可溶性糖含量与其萌发能力可能有密切的关系。
再次,不同贮藏年份芍药种子的可溶性蛋白质含量均在生根阶段都是先下降再上升。从萌前到露白生根阶段,种子可溶性蛋白质含量不断减少,说明在生根阶段可能有大量的蛋白质被分解成营养物质,为生根提供营养和最初的动力。之后,种子可溶性蛋白质含量又不断增加,这可能是由于在这个阶段根系不断伸长且植物体开始形成新的组织,细胞开始不断合成新的蛋白质而导致[25]。萌前阶段各储藏年份间芍药种子的可溶性蛋白质含量的比例与含水量和首粒种子萌发时间相似,推测芍药种子萌前阶段可溶性蛋白质含量与其萌发的速度可能也存在正相关的联系。
3.3.2芍药种子中抗氧化酶活性的变化各贮藏年份芍药种子POD活性在生根阶段均先增加再降低。从萌前到露白生根是种子生根启动阶段,种子POD活性在这一阶段升高,可能影响到了磷酸戊糖途径,促进种子解除休眠,加速萌发生根[26]。而种子萌发后,根系不断伸长,种子POD活性开始逐渐降低。同时,CAT可以清除过氧化氢及其他自由基,是细胞新陈代谢的标志[27]。一般CAT活性越高,细胞中过氧化氢含量越少,生活力越高[28]。各贮藏年份芍药种子CAT活性从萌前到露白生根的过程中逐渐降低,说明细胞新陈代谢逐渐减弱,而CAT活性从露白生根至生根3~5 cm阶段又逐渐升高,说明此阶段细胞新陈代谢逐渐增强,细胞代谢产生的大量过氧化氢被CAT清除,此时细胞的生活力较高。
有趣的是,在我们的结果中发现POD和CAT在芍药种子不同萌发阶段酶活性的变化趋势正好相反,这可能是因为在清除超活性氧自由基的酶系统中存在着生理生化功能的重叠和互补,POD和CAT在同一萌发时期酶活性变化相反的现象可能也是由此引起,而超活性氧自由基还存在其它很多清除剂,在芍药种子萌发过程中超活性氧自由基相关的生理生化变化还需要后期更完整的分析。此外,贮藏1年的芍药种子在整个萌发过程中,POD酶活性均低于另外两个贮藏时间,CAT酶活性均高于另两个贮藏时间,总是处于最大值或最小值的情况,这个特点与其生根率情况相同,推测这个特点可能在某方面决定芍药种子的总体生根情况。
综上所述,芍药种子沙藏前进行低温处理有助于解除种子下胚轴休眠,促进生根。同时,芍药种子在沙藏前进行低温处理可以有效减少首粒种子生根时间,使首粒种子生根时间提前,生根率提高,有助于加快芍药的育种、栽培;其中,-40 ℃低温处理的效果优于-20 ℃处理,并以-40 ℃下冷藏30 d后再沙藏芍药种子的生根结果最好,首粒种子生根时间最短、生根指数和生根率最高。采收后芍药种子的存放时间对生根影响较大,这种影响的效果甚至大于试验中采用的处理温度、处理时间等因素,且采收后存放1年的芍药种子生根效果优于当年采收和贮藏2年的芍药种子。在不同储藏年份芍药种子的生根过程中,种子含水量、萌前阶段可溶性蛋白质含量与首粒种子生根时间变化趋势正相关;可溶性糖含量、CAT酶活性与生根率变化趋势正相关,POD酶活性与生根率变化趋势负相关,推测这些生理生化变化可能分别决定着芍药种子生根的速度和生根率。在生产实践中,可以将采收后的芍药种子贮藏1年,在沙藏前进行-40 ℃处理30 d后进行播种,以获得最佳的生根结果,得到最短的首粒种子生根时间和最高的生根率。

