苦参碱与人血清白蛋白和牛血清白蛋白相互作用的光谱学研究
杨美玲 崔东亚 王丽雪 张杰
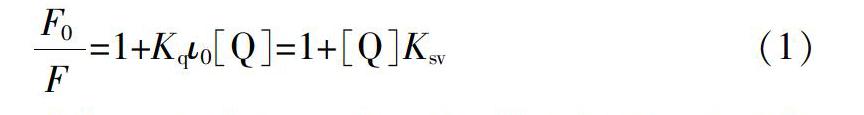


摘要:在模拟生理pH条件下,采用荧光光谱法、紫外-可见吸收光谱法和圆二色谱法研究了苦参碱与人血清白蛋白(Human serum albumin,简称HSA)和牛血清白蛋白(Bovine serum albumin,简称BSA)的相互作用。紫外吸收光谱法和荧光光谱法的试验结果表明,苦参碱对HSA和BSA相互作用在基态时形成复合物,因此对HSA和BSA均具有一定的荧光猝灭作用,其猝灭方式为静态猝灭,在22、27和37 ℃时其猝灭常数分别为HSA 3.07×104、1.71×104、4.60×103 L/mol和BSA 4.48×104、3.91×104和3.17×104 L/mol;结合常数分别为HSA 5.999×105、3.097×106、6.667×107 L/mol和1.007×105、1.163×105、1.582×105 L/mol;结合位点数基本维持不变。而圆二色谱法和热力学参数的计算结果表明苦参碱与HSA及苦参碱与BSA两者之间的作用力为疏水作用且为自发反应。
关键词:苦参碱;人血清白蛋白(HAS);牛血清白蛋白(BSA);荧光光谱;紫外-可见光谱;圆二色谱
中图分类号:S567.1+9;O657.7+3 文献标识码:A 文章编号:0439-8114(2018)11-0096-04
DOI:10.14088/j.cnki.issn0439-8114.2018.11.024
Abstract: The interaction between matrine (MAT) and human serum albumin (HSA) and bovine serum albumin (BSA) were investigated by fluorescence spectroscopy,UV absorption spectroscopy and circular dichroism spectroscopy with the simulated physiological condition. The experiment results of show UV absorption spectroscopy and fluorescence spectroscopy that matrine can react with HSA or BSA and form a kind of new compound at the ground state and prove that the flurescence quenching of HSA or BSA by matrine is dynamic quenching,and at different temperature,quenching constants are respectively HSA:4.60×103,1.71×104,3.07×104 L/mol and BSA:3.17×104、3.91×104 and 4.48×104 L/mol; binding constants are respectively HSA:5.999×105、3.097×106,6.667×107 L/mol and 1.007×105,1.163×105,1.582×105 L/mol, the number of binding sites is approximately equal to 1. The calculation results of thermodynamic parameters display that the reaction is hydrophobic effect and is spontaneous reaction between matrine and HSA or BSA.
Key words: matrine; HSA; BSA; fluorescence spectroscopy; UV absorption spectroscopy; circular dichroism spectroscopy
苦参碱(Matrine,简写MAT,分子结构见图1)是中国较为传统的一种生物碱类中草药,可以通过抑制酶的活性来抑制肿瘤细胞的增加,可以通过控制基因和端粒酶的活性来控制肿瘤细胞[1],在抵抗肿瘤疾病方面具有明显的效果。临床应用中,苦参碱主要用于清热、抵抗HBV病毒、抗肿瘤、破坏结核杆菌的正常生长周期[2],在体外能不同程度抑制导致皮肤病的真菌,具有抗癌、抗炎、抗心律失常及治疗心律不齐等多方面的药理活性,是近年来药学领域研究开发的热门课题之一。近几年对苦参类生物碱在体内体外的作用机理已经取得了很大进展,一些有價值的功能有待深入研究,以更好地发挥其药用价值。药物在血液中通常以游离的形式存在,与血液中的血清白蛋白相结合达到动态平衡,再通过血清白蛋白运输到指定的器官。因此,研究药物与血清白蛋白之间的相互作用,有利于了解药物在分子水平的机制,可以为药物研究提供数据方面的指标和药物需要的参数[3,4],对研究药物的药代动力学具有重要意义[5]。为了更好的了解苦参碱的药理活性和药代动力学,本研究主要采用紫外可见光谱法、荧光光谱法和圆二色谱法研究苦参碱与人血清白蛋白(Human serum albumin,简称HSA)和牛血清白蛋白(Bovine serum albumin,简称BSA)的相互作用。
1 材料与方法
1.1 仪器与试剂
Agilent-8453型紫外分光光度计,美国Agilent公司;LS-55型荧光分光光度计,美国PE公司。
人血清白蛋白和牛血清白蛋白购于国药集团化学试剂有限公司;苦参碱购于郑州永和制药有限公司。
1.2 方法
1.2.1 紫外光谱法 在室温下,取10 mL浓度为3×10-4mol/L的 HSA于25 mL的比色管中,用2.0×10-3 mol/L的苦参碱滴定,以pH 7.24的Tris-HCl缓冲溶液为参比,然后用1 cm的石英比色皿在250~450 nm内扫描其紫外-可见吸收光谱。用同样的方法测定BSA的紫外-可见吸收光谱。
1.2.2 荧光光谱法 在室温下,量取10 mL浓度为3×10-6 mol/L的HSA于25 mL的比色管中,用微量进样器加入定量2.0×10-3 mol/L的苦参碱溶液,以280 nm为激发波长,激发狭缝和发射狭缝均为5 nm,用1 cm的石英比色皿在300~550 nm扫描其发射光谱。
同样的方法扫描MAT-HSA在32 ℃和37 ℃时荧光光谱以及MAT-BSA的荧光光谱。
1.2.3 圆二色谱法 在室温下,以pH 7.24的Tris-HCl缓冲溶液为参比,用2.00×10-3 mol/L的苦参碱溶液滴定10 mL浓度为3.00×10-6 mol/L的HSA溶液,在1 cm石英比色皿中扫描其190~250 nm内的圆二色谱。用同样的方法测定MAT-BSA的圆二色谱。
2 结果与分析
2.1 紫外-可见光谱分析
紫外-可见吸收光谱法是研究药物分子与蛋白质之间相互作用的一种简单可靠的方法。图2为室温27 ℃时不同浓度的苦参碱与HSA以及BSA相互作用的紫外-可见吸收光谱。从图2中可看出,HSA和BSA的最大吸收波长均出现在280 nm处,这是主要由HSA和BSA中所含的色氨酸残基引起的[6],加入苦参碱后HSA和BSA的最大吸收峰的强度都明显增强,而苦参碱在这一范围内没有吸收峰,这就说明苦参碱与HSA或BSA相互作用形成一种新的复合物,并使得蛋白质中的所有肽链伸展[7]。
2.2 荧光光谱
2.2.1 荧光猝灭 荧光猝灭指的是猝灭剂使荧光物质的荧光强度不断减小或熄灭的一种现象。HSA和BSA的内源荧光主要是色氨酸、酪氨酸和苯丙氨酸残基所引起的,其中在335 nm波长附近色氨酸残基的荧光强度最强,304 nm附近的酪氨酸残基居中,284 nm附近的苯丙氨酸残基荧光强度最弱[7]。图3是在室温27 ℃时苦参碱与HSA和BSA相互作用的荧光光谱。从图3中可以看出,HSA在338 nm处有一强的荧光发射峰,当向HSA溶液中不断加入药物苦参碱时,随着药物浓度的不断增大,HSA的荧光强度也随之逐渐减弱,说明苦参碱与HSA相互作用形成了一种无荧光或是荧光较弱的新物种,从而使HSA的荧光不断减弱。同样的,苦参碱与BSA也可以相互作用形成新的复合物,并使得BSA的荧光猝灭。
2.2.2 荧光猝灭机理 引起荧光猝灭的原因一般有三种:动态猝灭、静态猝灭和能量转移[8]。为了进一步阐明苦参碱对HSA和BSA的荧光猝灭机理,分别在22、27和37 ℃时按式(1)[9-12]分别作出了苦参碱对HSA和BSA荧光猝灭的Stern-Volmer图。
式中,F0是未加入猝灭剂时荧光物质的荧光强度,F是加入了猝灭剂后荧光物质溶液的荧光强度,[Q]是猝灭剂的浓度,Ksv是Stern-Volmer猝灭常数,Kq是动态双分子猝灭速率常数,?咨0是荧光物质的荧光寿命,一般蛋白质生物大分子的内源荧光寿命为10-8 s[13]。所以根据方程式(1)以[Q]为横坐标,以F0/F为纵坐标作出苦参碱对HSA和BSA荧光猝灭的Stern-Volmer图(图4),并在表1中列出了Ksv和Kq的计算结果。从图4中可以看出,随着温度的升高,Stern-Volmer曲线的斜率在不断减小,从表1中可以看出苦参碱对HSA和BSA的Stern-Volmer猝灭常数Ksv也随着温度的升高而减小,双分子猝灭速率常数Kq均远大于2.0×1010 L/(mol·s),说明苦参碱对HSA和BSA的荧光猝灭机理为静态猝灭[14]。
2.2.3 结合常数、结合位点计算 在药物小分子与生物大分子相互作用的过程中,其结合常数Ka、结合位点数n以及荧光猝灭剂浓度[Q]符合Lineweaver-Burk方程[10,11]。
式中,F0是未加入猝滅剂苦参碱时荧光物质血清白蛋白的荧光强度,F是加入了猝灭剂苦参碱后荧光物质血清白蛋白溶液荧光强度,[Q]是猝灭剂苦参碱的浓度,lgKa为截距,n为斜率。因此在不同温度下以lg~lg[Q]作图(图5),可以计算出不同温度下的Ka和n值,计算结果见表2。通过表2中的数据可以得出,随着温度的升高,苦参碱与HSA和BSA的结合常数Ka增大,结合位点数n也有所增大,但变化较小,说明苦参碱与HSA和BSA的结合作用力随着温度的升高而增强,但结合位点数基本维持不变,证明苦参碱与HSA和BSA均可形成了1∶1的复合物,从而被血清白蛋白运输并且储存。
2.2.4 作用力类型 药物小分子与生物大分子之间的相互作用力属于分子间弱的相互作用,主要有疏水作用力(ΔH>0、ΔS>0)、范德华力或氢键(ΔS<0、ΔH<0)和静电作用力(ΔH≈0、ΔS>0)[14]。通过公式(3)~(5)即可计算出药物小分子与生物大分子相互作用时的焓变ΔH、熵变ΔS和吉布斯自由能变ΔG,计算结果列于表3。
由表3可看出,苦参碱与HSA和BSA相互作用时均有ΔH>0、ΔS>0和ΔG<0,由此可知苦参碱与HSA和BSA之间的相互作用力类型均为疏水作用,且该反应过程是一个吉布斯自由能降低的自发反应,所以苦参碱与HSA和BSA之间的互相作用是通过熵增加来实现的。
2.3 圆二色谱
圆二色谱法(CD)是一种简单、快速、且准确度、灵敏较高的研究稀溶液中蛋白质二级构象的光谱技术。图6给出了不同浓度的苦参碱对HSA和BSA影响的圆二色谱曲线。图6中a曲线为HSA或BSA空白溶液,分别在208和222 nm处出现了两个负峰,属于α-螺旋的特征吸收峰,b、c和d分别是加入苦参碱后MAT-HSA体系和MAT-BSA体系的圆二色谱曲线。显然,加入苦参碱后,随着苦参碱浓度的增大,吸收峰的振幅相应减弱,说明HSA和BSA分子内的氢键网络部分断裂,氢键作用力减弱,α-螺旋的含量相应减少,疏水性减弱,证明HSA和BSA的二级结构变的疏松[15],而蛋白质二级结构的改变是蛋白质内源荧光发生猝灭的主要原因。
3 结论
利用苦参碱与HSA和BSA相互作用的荧光光谱和紫外可见光谱可发现,苦参碱与HSA和BSA均可形成基态复合物,苦参碱对HSA和BSA的内源荧光均具有猝灭作用,其猝灭机理为静态猝灭。通过圆二色谱分析可知,随着苦参碱浓度的增加,HSA和BSA的振幅减小,说明蛋白质中所含的α-螺旋量减少,输水作用力减弱,证明了苦参碱可使HSA和BSA的二级结构发生改变。热力学参数的计算分析结果表明苦参碱与HSA和BSA之间的相互作用力类型均为输水作用力,且其结合过程均为自发过程。
参考文献:
[1] SUN X,XU X,LIU M,et al.Study on the interaction of matrine with human serum albumin in aqueous solution[J].Macromolecular Research,2010,18(1):86-89.
[2] 陈仲新,罗 敏,易延奎,等,苦参的药学研究评析[J].中医药学刊,2003,21(11):1982-1984.
[3] 贾文志,孙绍发.光谱法研究一种喹唑啉酮衍生物与牛血清白蛋白的相互作用[J].化学世界,2009,50(1):4-8.
[4] 金迎春,敖登高娃.氯诺昔康与牛血清白蛋白相互作用的光谱法研究[J].化学试剂,2011,33(8):680-684.
[5] 郭兴家,李小舟,徐淑坤.荧光猝灭法研究胆红素与牛血清白蛋白的相互作用[J].分析实验室,2007,26(4):11-15.
[6] GE Y S,JIN C,SONG Z,et al.Multi-spectroscopic analysis and molecular modeling on the interaction of curcumin and its derivatives with human serum albumin:A comparative study[J].Spectrochimica Acta Part A,2014,124: 265-276.
[7] JAHANBAN-ESFAHLAN A,PANAHI-AZAR V,SAJEDI S. Interaction of glutathione with bovine serum albumin:Spectroscopy and molecular docking[J].Food Chemistry,2016,202(9):23-28.
[8] DEHGHAN G,SHAGHAGHI M,SATTARI S,et al.Interaction of human serum albumin with Fe(III)-deferasirox studied by multispectroscopic methods[J].Journal of Luminescence,2014, 149(1):251-257.
[9] 银鸿雁,郑学仿,曹洪玉,等, 4-硫胸苷的合成及其与人血清白蛋白的相互作用[J].发光学报,2013,34(1):104-110.
[10] GOWDA J I,NANDIBEWOOR S T.Binding and conformational changes of human serum albumin upon interaction with 4-aminoantipyrine studied by spectroscopic methods and cyclic voltammetry[J].Spectrochimica Acta Part A,2014,124:397-403.
[11] AHRENS I,BODE C.Rivaroxaban for stroke prevention in atrial fibrillation and secondary prevention in patients with a recent acute coronary syndrome[J].Future Cardiology,2012,8(4):533-541.
[12] 曹團武,周 坤,黄文兵,等,光谱法研究哈巴俄苷与人血清白蛋白的结合反应[J].分析化学,2017(5):700-706.
[13] WANG Z Q,GAO J Q,WANG J,et al.Spectroscopic analyses on interaction of Amantadine-Salicylaldehyde, Amantadine-5-Chloro-Salicylaldehyde and Amantadine-o-Vanillin Schiff-Bases with bovine serum albumin(BSA)[J].Spectrochimica Acta Part A,2011,83(1):511-517.
[14] ROSS D P,SUBRAMANIAN S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20:3096-3102.
[15] XIAO D,ZHANG L L,WANG Q,et al.Investigations of the interactions of peimine and peiminine with human serum albumin by spectroscopic methods and docking studies[J].Journal of Luminescence,2014,146:218-225.

