建立肝硬化食管胃底静脉曲张破裂的多因素出血概率风险预测模型*
王群茹 周德江 曾维政 牟东 张勇
(成都军区总医院消化内科,四川 成都 610038)
肝硬化患者年均发生食管静脉曲张的概率为5%,其中10%~20%患者在1年后由小静脉曲张演变为大静脉曲张,同时20%~30%患者在2年中发生出血,25%~50%患者在首次出血后1周内病死[1]。食管胃静脉曲张出血(Gastroesophageal variceal hemorrhage ,GEVB)是肝硬化患者出血的主要原因,其死亡发生主要在于出血引起失血性休克, 诱发肝性脑病、肝功能衰竭而死亡[2]。虽然目前在药物治疗[3-5]、内镜治疗(套扎术、硬化剂治疗及组织胶注射)[6-9]、经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)及外科手术方案[10-13]较为成熟,但鉴于食管胃静脉曲张出血具有较高致死性,危险性极高,严重影响患者的生存[14]。本研究通过对临床肝硬化患者发生食管胃静脉曲张破裂出血进行研究,筛选危险因素指标,同时建立多因素出血概率风险预测模型,以期实现对患者出血的早期预测,早期干预,降低出血风险,提高肝硬化患者管理能力。
1 资料和方法
1.1一般资料按照《肝硬化门静脉高压食管胃静脉曲张出血的防治指南(2016)》的诊断标准,将2014年3月~2016年3月在我院进行治疗的96例肝硬化伴食管胃底静脉曲张破裂患者纳入分析数据库,将发生食管胃底静脉曲张破裂出血的55例患者设为研究组,将未发生出血的41例患者设为对照组。纳入标准:临床确认为肝硬化患者,有病毒性肝炎、长期大量饮酒等有关病史,有肝功能减退和门脉高压症,肝静脉压力检测(HVPG)>5 mmHg的临床表现(包括脾大、脾功能亢进、腹痛、腹水、肝功能障碍、食管胃底静脉曲张引起的呕血黑便等),肝功能检测异常,B超或CT提示肝硬化以及内镜发现食管胃底静脉曲张。排除标准:①排除非食管胃底静脉曲张破裂导致的出血患者(如消化性溃疡、消化道肿瘤、外伤等)。②合并严重的多器官功能障碍患者。③临床资料不完整。本研究获得成都军区总医院伦理委员会批准,所有纳入患者均签署知情同意书。
1.2方法
收集两组患者以下指标:包括基础特征指标(性别、年龄、国际临床Child-Pugh改良分级)、生化指标(胆红素、血清白蛋白、血小板、凝血酶原时间、谷丙转氨酶、谷草转氨酶)、影像指标(门静脉内径、脾静脉主干内径、食管静脉曲张程度、红色征)、并发症(腹水、消化性溃疡),对比研究各项指标对出血发生的影响差异。Child-Pugh改良分级采用1972年Pugh提出的分级评分标准,采用5项指标进行评估,包括白蛋白( 合成功能) 、血清总胆红素( 排泄功能) 、腹水( 门静脉高压) 、肝性脑病( 门体分流) 、PT( 合成功能) ,每项指标评1 ~ 3 分,指标总积分值划分3个等级:A( 5 ~ 6 分) 、B( 7 ~ 9 分) 、C( 10 ~ 15分),总分越多则病情越重。

2 结果
2.1两组患者基线指标对比两组在性别、年龄和Child-Pugh分级等基线指标方面对比差异无统计学意义(P>0.05),具有可比性,见表1。
2.2出血影响因素的单因素分析结果显示,两组间食管静脉曲张程度、消化性溃疡、红色征等定性指标对比,差异有统计学意义(P<0.05),见表2。两组间血清白蛋白、血小板、凝血酶原时间、门静脉内径、脾静脉主干内径等定量指标对比,差异亦有统计学意义(P<0.05)。其中出血组血清白蛋白、血小板低于非出血组,而凝血酶原时间、门静脉内径和脾静脉主干内径高于非出血组,见表3。
2.3出血影响因素的多因素分析多因素Logistic回归分析结果显示,凝血酶原时间越长、门静脉内径越大、食管静脉曲张程度越严重、出现红色征、血清白蛋白及血小板下降的患者发生出血的概率越高,见表4。
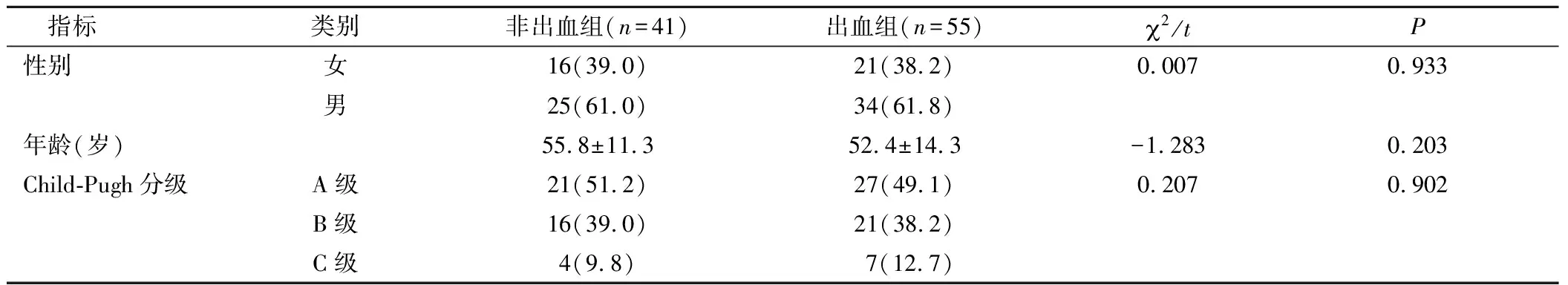
表1 两组患者基线指标对比[n(×10-2)]Table 1 Compared baseline data for the two groups
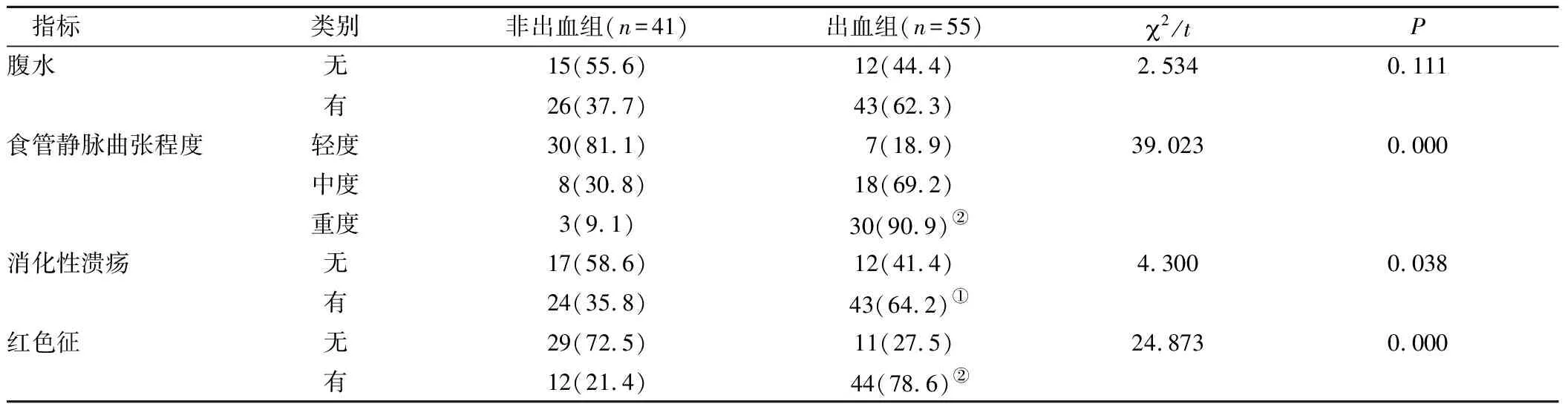
表2 两组患者定性指标对比[n(×10-2)]Table 2 Compared qualitative index difference of the two groups of patients
注:与非出血组对比,①P<0.05,②P<0.01

表3 两组患者定量指标差异对比Table 3 Comparison of quantitative indexes between the two groups
注:与非出血组对比,①P<0.05,②P<0.01
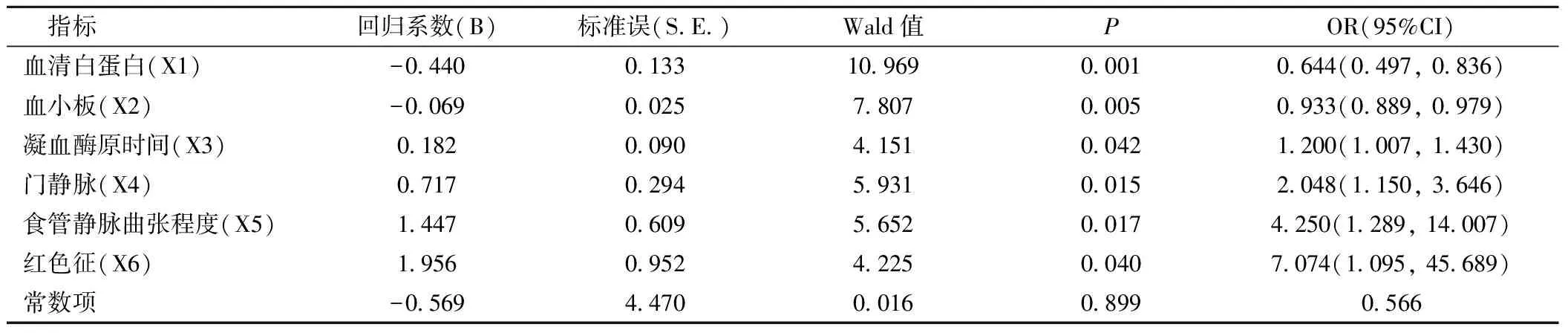
表4 肝硬化食管胃底静脉曲张出血影响因素的多因素Logistic回归分析结果Table 4 Regression analysis results of gastroesophageal varices bleeding in cirrhosis
2.4多因素出血概率风险预测模型建立与验证肝硬化患者食管胃底静脉曲张破裂出血的Logistics回归分析,采用向后条件逐步回归法,通过模型调优拟合型3效果最好,共纳入6项指标,分别为:血清蛋白(X1)、血小板(X2)、凝血酶原时间(X3)、门静脉(X4)、食管静脉曲张程度(X5)和红色征(X6);模型-2log似然值为47.493,Cox & Snell R2为0.581,Nagelkerke R2为0.780;同时模型系数的综合检验P<0.01,模型成立;模型适配度进行Hosmer and Lemeshow检验,Chi-square值为6.144,P=0.631>0.05,认为模型能够很好地拟合数据。根据表4的回归分析结果,建立肝硬化食管胃底静脉曲张的多因素出血概率风险预测模型,见公式。
采用该预测模型对我院2016年4月~12月住院确诊为肝硬化伴食管胃底静脉曲张破裂的32例患者进行验证(其中发生出血13例,非出血19例),验证显示结果一致的27例(阳性11例,阴性16例),总正确率为84.375%;同时将预测概率判定结果进行ROC曲线分析(模型预测出血概率值>0.5的视为出血发生),预测模型曲线下面积AUC为0.844(0.673,0.947),灵敏度(真阳性率)为84.6%(54.6,98.1),特异性(真阴性率)为84.2%(60.4,96.6);综合分析显示,本研究建立的肝硬化食管胃底静脉曲张出血风险预测模型能够较好地预测出血危险发生,见图1。
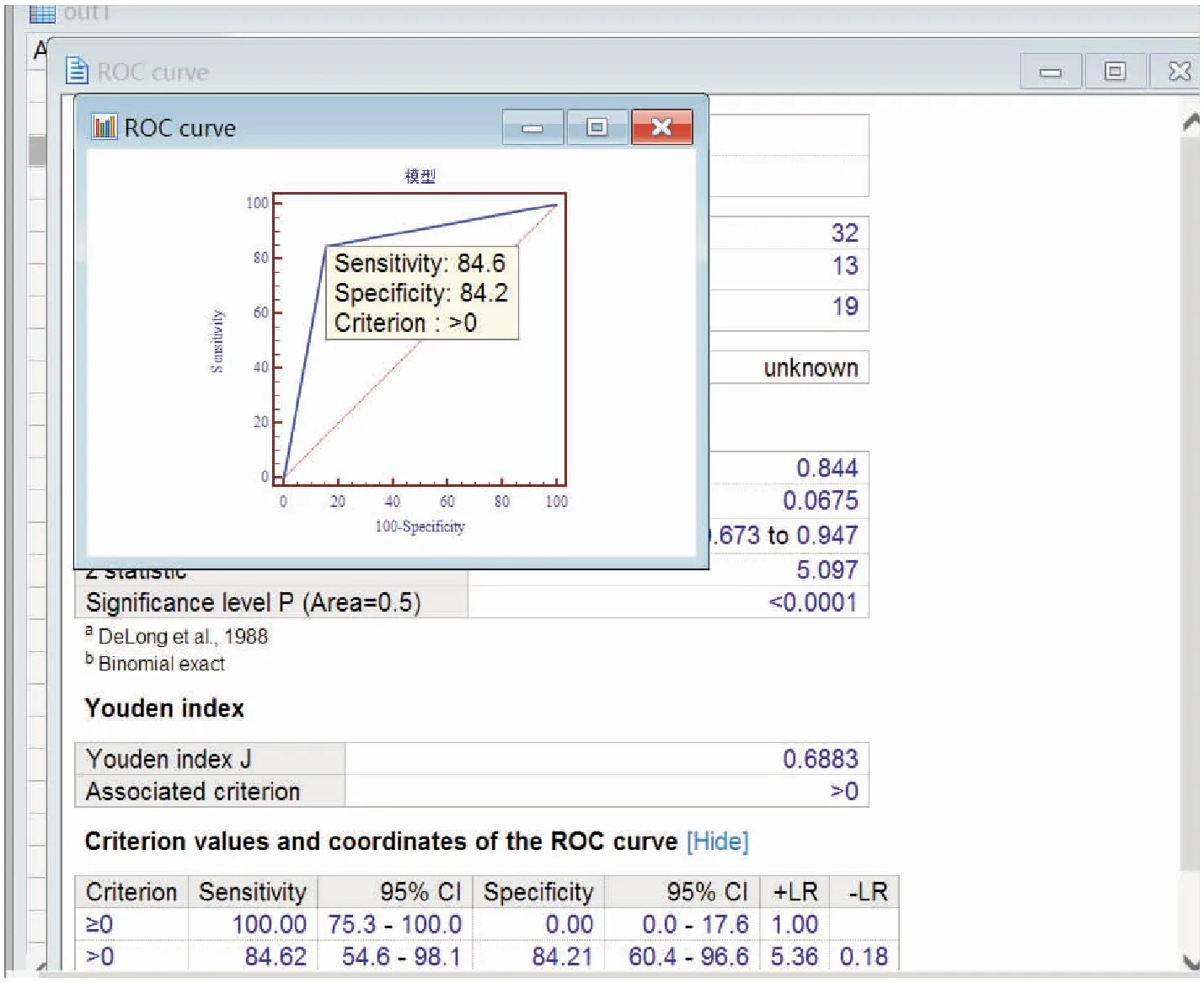
图1 肝硬化食管胃底静脉曲张的多因素出血概率风险预测模型验证结果Figure 1 Validation results of the multivariate factors risk prediction model of gastroesophageal variceal hemorrhage in liver cirrhosis
3 讨论
肝硬化的发生存在多种影响因素,研究表明,主要包括病毒性肝炎后肝硬化、酒精性肝硬化、非酒精性脂肪性肝硬化、肝豆状核变性、原发性胆汁性肝硬化以及隐匿性肝硬化等。食管静脉曲张破裂出血对肝硬化患者生存影响极为严重,如果能够通过研究分析其发生的独立危险因素,早期监测创伤性小的检查,尽早地预测出血可能性,对于降低患者的病死率等具有非常重要的临床意义[15]。目前多种方法均可以预测食管静脉曲张破裂出血风险,如血小板计数、肝病模型、超声检查、瞬时弹性成像技术、影像学检查等。至今国内外对预测食管胃底静脉曲张出血风险尚无统一标准,尤其是有关基于数学模型的疾病预测方法尚未见报道。本文建立肝硬化食管胃底静脉曲张的多因素出血概率风险预测模型做了初步尝试,这对于减少肝硬化患者发生食管胃底静脉曲张出血的风险具有一定的现实意义和潜在的临床应用价值。
本研究通过在肝硬化患者是否发生食管胃底静脉曲张破裂出血的单因素分析显示,有8项指标具有显著影响作用(血清白蛋白、血小板、凝血酶原时间、门静脉内径、脾静脉主干内径、食管静脉曲张程度、消化性溃疡、红色征);同时通过多因素Logistics回归分析显示,最终有6项指标纳入了风险预测模型,根据回归分析各指标OR值降序排列为:红色征(OR=7.074)>食管静脉曲张程度(OR=4.252)>门静脉内径(OR=2.048)>凝血酶原时间(OR=1.200),OR值>1为危险因素,相关指标越高,发生出血的风险越大。红色征是指内镜检查下所见的食管静脉表面呈红色,伴或不伴糜烂,门静脉压力较高时,食管静脉曲张严重,持续的高压力可破坏静脉血管管壁完整性,导致管壁变薄,在镜下表现为红色,管壁越薄,内皮损伤范围越大,所形成的红色征越明显,发生急性出血的风险性越高[16],既往研究红色征OR值达24.916[17],本研究也提示红色征危险程度最高。本研究结果显示,门静脉内径越大,发生出血的风险越高,主要在相同血管内压力下,直径越大,管壁张力越大,越容易破裂[18]。同时有2项指标OR 值<1[血清白蛋白(OR=0.644),血小板(OR=0.933)]为保护性因素,其指标值越高发生出血的风险越低。研究表明,肝硬化患者脾脏增大,单核吞噬细胞活跃,导致血小板破坏、骨髓巨核细胞成熟障碍及肝脏产生血小板生成素不足等均可导致血小板降低,血小板降低反应肝硬化的严重程度越高。
4 结论
鉴于食管胃静脉曲张出血具有较高致死性,危险性极高,如何通过非侵入性方法(non invasive methods)有效预测出血风险,实现对患者出血的早期预测,早期干预,以此降低出血风险,提高肝硬化患者管理能力,是目前临床研究者关注的焦点[19-20]。本研究基于本院96例肝硬化患者的相关临床指标建立了肝硬化食管静脉曲张破裂的多因素出血概率风险预测模型,对纳入研究的32例患者的出血情况的预测准确率达到84.375%,预测效果较好,后期将进一步纳入患者临床指标,对出血风险模型进行验证[21]和模型调优。

