惠州市不同水域鲫、鲮鱼重金属含量比较分析1
马细兰,谭烨聪,林佳泓,黄耀源,梁浩亮
(1.惠州学院 生命科学学院,惠州 516007;2.惠州市海洋局海洋技术中心,惠州 516000)
1 引言
随着人们生活水平的提高,人们对食品安全有更高的要求.当水体、底泥受到重金属污染时会影响到鱼类的生存环境,鱼类在生长过程中通过摄食或呼吸等方式将环境中的重金属元素吸收到体内,吸收进体内的重金属元素难以排出,会在鱼类的体内富集起来[1].当人类食用受重金属污染的鱼类时,富集在鱼类体内的重金属元素将会在人体内进一步富集,累积到一定的程度就会对人体造成伤害.鲫鱼和鲮鱼均含有丰富的蛋白质,营养价值高,且肉质细嫩,味道鲜美,深受垂钓者的喜爱,但野生环境下是否受到污染,是否存在食用安全问题无法获知.
国内对鱼类重金属的污染的研究已有不少报道.邓小蓉[2]等对新疆赛里木湖凹目白鲑铅、镉、铬、汞、砷、镍6种金属元素的含量进行了研究,结果表明重金属元素在鱼体内出蓄积量存在组织特异性,同一组织对不同金属元素的蓄积量不相同,其中Cd、As在凹模白鲑的胰脏含量最高,肌肉含量最少;Pb在凹模白鲑的皮肤含量最高.刘芳芳[3]研究了淡水鱼类中重金属的污染及其与环境的相关性,结果表明不同采样点鱼类的重金属含量存在一定差异,污染严重的采样点特为明显;Zn元素主要富集于鳃部,Cu、Cd、Pb、Cr等元素主要富集于肝脏或肾脏,肌肉中的含量最少;草食性鱼类重金属含量最低,杂食性或肉食性鱼类含量相对较高,存在一定的生物放大作用.张晓文[4]等研究了4种太湖水产品体内重金属的富集特征,结果表明同种重金属在4种水产品体内不同组织中的分布不同;不同水产品同一组织重金属含量由高到低大致趋势为Zn>Cu>Pb>Cd;人工饲养和野生放养太湖水产品肌肉组织的重金属污染程度不同,野生放养水产品的肌肉组织污染程度较高;同种重金属在不同种类水产品肌肉组织中含量存在差异.杨晓云[5]等研究了重金属在北江鱼类和底栖动物体内的富集及污染评价,结果表明北江鱼体肌肉中不同重金属的污染程度由强至弱的顺序为:Cd>Pb>Hg>As;北江鲤鱼体内各器官组织蓄积重金属总量依次为:内脏>鳃>脂肪>肌肉.杨晨驰[6]等对东苕溪下游鲫鱼不同组织重金属含量分析及食用安全性进行研究,结果表明食用该地区鲫鱼对人体健康存在潜在风险;在肌肉、性腺和鳃组织中As、Cd、Cr、Cu、Hg、Zn的含量具有显著性差别(P<0.05);不同组织污染程度为性腺>鳃>肌肉.
从以上的研究报导可以看出,不同地区的鱼类存在一定的重金属污染,野生鱼类与养殖鱼类间存在一定的差异;肌肉为重金属污染最低的组织,肝脏最高.以上研究大多数只是从单一的某方面进行,不够全面,因此还需进行更深入研究,本研究以惠州市内主要河流东江以及其一级支流和二级支流中的鲫、鲮鱼为研究对象,比较铜、锌、铬、铅4种重金属元素在鱼类肌肉、鳃、肝脏组织间的含量差异,并分析鱼类重金属含量与环境的相关性,拟为水域防治和监管提供科学依据.
2 材料与方法
2.1 采样地点及样品采集
2017年12月10日~25日,选取了惠州市东江(E114°24′39.61″N23°5′35.59″)、东江的一级支流(E114°24′7.09″N23°5′22.09″)和东江二级支流(E114°25′26.45″N23°3′55.66″)三个采样点(图1),使用鱼竿垂钓或向采样点垂钓者购买的方式采集所需样品,采样时同种鱼尽可能选取大小相近的个体(表1).采集鱼样后,用已提前清洗干净的聚乙烯瓶(250ml)在采集位取两瓶水,在装水样前使用适量采样点的水润洗聚乙烯瓶.将鱼样置于提前准备好装有采样点河水的水桶,带回实验室做进一步处理.

表1 样品鱼的体重(n=5)
图1 采样地点
2.2 样品解剖
将所采集的鱼置于解剖盘上,用剪刀、镊子取出鳃部,并用剪刀把鳃弓剪去,将鳃丝装入聚乙烯密封袋中;用剪刀从鱼的肛门位置将鱼肚剪开,露出内脏,用镊子剪取少量肝脏装入的聚乙烯密封袋;把鱼的背部肌肉分离,去鱼皮,剪取少量肌肉装入聚乙烯密封袋;最后将样品袋置于-20℃冰箱中保存,待用.
2.3 绘制标准曲线
2.3.1铜、铅、铬标准曲线(原子吸收石墨法)
用千分之一天平准确称取0.1g抗坏血酸粉末,加入到已用去离子水润洗的烧杯中,加入适量去离子水用玻璃杯搅拌溶解.待粉末溶解后溶液全部移入100mL容量瓶中,并少量用去离子水冲洗烧杯,并将溶液一同移入100mL容量瓶中,重复三次.用玻璃棒引流往100mL容量瓶中加入去离子水,液面接近刻度线时改用胶头滴管逐滴加入,直至溶液凹液面与刻度线相切,盖上瓶塞颠倒混匀,所得溶液为浓度为100g/L抗坏血酸溶液.
用微量移液枪准确移取2.0mL铜标准贮备液(1000μg/mL)或1.0mL铅标准贮备液(1000μg/mL)或1.0mL铬标准贮备液(1000μg/mL)至已做好标记100mL容量瓶中,用玻璃棒导流加入稀硝酸(1+99)直至接近标线,改用一次性胶头滴管逐滴滴入,直至凹液面与容量瓶刻度线相切,盖上瓶塞颠倒混匀,得到铜或铅或铬标准中间液.
用微量移液枪准确移取1.00mL铜或铅或铬标准中间液至已做好标记的100mL容量瓶中,用稀硝酸稀释至标线,颠倒混匀,得到铜或铅或铬标准使用液.
用微量移液枪准确移取0mL、0.50mL、1.00mL、1.50mL、2.00mL、2.50mL铜或铅或铬标准使用液,分别加入到6个已做好标记的10mL容量瓶中(其中铬的6个容量瓶中还需加入1mL浓度为100g/L的抗坏血酸),然后用胶头滴管加入稀硝酸,稀释至标线,盖上瓶塞颠倒混匀.
用微量移液枪分别从标有铜或铅或铬的6个容量瓶中移取约500uL溶液加入到样品杯,并将样品杯按顺序从样品架第一个杯号开始放入样品架,用原子吸收石墨法在选定工作条件测量绘制铜或铅或铬的标准曲线标准曲线.
2.3.2锌标准曲线(原子吸收火焰法)
用微量移液枪准确移取2.00mL锌标准贮备液(1000μg/mL)至100mL容量瓶中,用玻璃棒导流加入稀盐酸(1+99)直至接近标线,改用一次性胶头滴管逐滴滴入,直至凹液面与容量瓶刻度线相切,盖上瓶塞颠倒混匀,所得溶液为锌标准使用液.
用微量移液枪分别移取0mL、0.40mL、0.80mL、1.20mL、1.60mL、2.00mL铅标准使用液加入到6个已做好标记的10mL容量瓶中,并用胶头滴管加入稀盐酸,稀释至标线,盖上瓶塞颠倒混匀.
提前设置好原子吸收火焰法测量锌元素条件,将进样器毛细管插入到容量瓶液面以下一定深度,并稳定毛细管的位置,按下start键开始测量,按溶液浓度从低到高顺序逐个测量绘制标准曲线.
2.4 样品预处理
2.4.1生物体
提前一天用稀硝酸(1+99)浸泡消解罐内管过夜,使用前用去离子水冲洗内管,烘干,备用.将做好标记的聚四氟乙烯内管放置在天平上,调零,用洁净的药勺取少量样品加入到消解罐底部,观察天平读数,当天平读数在0.2g~0.3g之间时停止加入样品,并记录读数.往每个消解罐中加入9mL硝酸,静置,待反应稳定后往每个消解罐中再加入3mL30%过氧化氢溶液,待反应平稳后,将聚四氟乙烯内管套入防爆外管,盖上盖子用虎口握住管盖,以达到密封效果.将安装好的消解罐放置于消解转子的凹槽,旋紧,并将已安装好消解罐的消解转子对称安装在消解系统内,并在消解主控罐上安装温度传感器,盖上消解转子固定盖子,打开微波消解系统,测试旋转,观察旋转状况以及温度传感器的状况.在仪器控制面板中设置程序,第一步120℃升温5min~10min,保 持 5min;第 二 步 180℃ 升 温 5min~10min,保持25min.程序设置完毕后,点下开始键,开始样品消解.
温度程序运行完毕后,点下控制面板中的停止按钮,停止消解.待温度降至与室温相仿时,取出消解转子,旋松,将消解罐从消解转子取出,在通风橱内进行消解罐放气.放气完毕后,将聚四氟乙烯内管从防爆管中取出,放入石墨赶酸器孔位,将真空赶酸仪与聚四氟乙烯内管相配套的消解管塞拉出,与聚四氟乙烯内管塞紧,开启真空赶酸仪,真空赶酸仪使用前应更换吸收塔内溶液,最里端的吸收塔应加入稀碱液.在开启真空赶酸仪的同时,开启石墨赶酸器,仪器控制台电源,并点下开始键,120℃真空赶酸,直至聚四氟乙烯内管内的溶液近干.
加入少量稀硝酸(1+99)冲洗聚四氟乙烯内管,倒入已做标记且已提前酸泡过夜烘干的比色管中,重复三次,用稀硝酸(1+99)定容到25mL,待测.
2.4.2水质(总铬)
用5mL移液枪准确移取10mL各样品置于已做标记的25mL比色管中,在加入样品前比色管用量对应的样品进行润洗.往每个比色管中各加入1滴二甲基黄醇,盖上瓶塞摇晃,使溶液充分混匀,显色.用胶头滴管逐滴加入稀氨水或稀盐酸调节溶液PH,边加边摇晃使溶液充分混匀,直至溶液颜色显示为浅橙色为止,静置约2min.用胶头滴管往每个比色管中各加入1滴高锰酸钾溶液,摇晃使溶液混匀,盖上比色管瓶塞65℃~75℃水浴加热10min.水浴10min后,将比色管取出放置在比色管架上,放置在通风橱内冷却.待本色管内溶液与室温相差不大时,用移液枪往每个比色管中各加入1mL总铬缓冲溶液和1mLDDTC溶液,用力摇晃或使用振荡器使溶液充分混匀.枪往每个比色管中各加入1.50mLMIBK溶液,盖上塞子,在振荡器上振荡萃取2min,静置分层.用移液枪分别吸取上层溶液约500μL于样品杯中,按信息录入先后顺序从样品架编号7开始放入,在选定条件下使用已提前绘制标准曲线对样品进行检测,每个样品重复测定三次.
2.4.3水质(铜、铅、锌)
分别往各已做标记的50mL离心管中加入约30mL样品,用一次性胶头滴管取少量样品滴在PH试纸上,将PH试纸上显示的颜色与标准比色卡进行对比.用一次性胶头滴管往离心管中加入几滴稀盐酸或稀氨水,充分摇晃混匀,用一次性胶头滴管取少量样品滴在PH试纸上,将PH试纸显示颜色与标准比色卡进行对比.重复以上步骤,直至PH试纸所显示颜色在标准比色卡上PH3~4颜色之间为止.在选定条件下运行伏安极谱仪,输入相应样品名称,用5mL移液枪准确移取10mL样品溶液,开始检测样品,每个样品重复测定三次.
2.5 仪器与试剂
仪器:
日立Z-2000原子吸收分光光度计(日立高新技术公司)
MELESTONE ETHOS A微波消解系统(意大利迈尔斯通Milestone)
GS-12石墨赶酸器(湖南阿尔特曼科学仪器有限公司)
KZ-06控制器(广州基创仪器有限公司)
阿尔特曼GS-12真空赶酸仪(湖南阿尔特曼科学仪器有限公司)
密理博gardient超纯水器(密理博中国有限公司)
万通797伏安极谱仪(瑞士万通中国有限公司)
消解罐、玻璃棒、PH试纸、25mL比色管、50mL离心管
试剂:
抗坏血酸
硝酸、盐酸(分析纯)
硝酸、盐酸(1+99)
过氧化氢(H2O2):30%
Cu、Pb、Zn、Cr标准储备液(1000μg/mL)
总铬缓冲溶液
高锰酸钾(10g/L)
二甲基黄乙醇(10g/L)
甲基异丁酮(MIBK)
二乙氨基二硫代甲酸钠(DDTC)
2.6 计算公式
Cu、Pb、Cr计算公式如下:
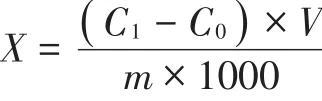
X—试样中Cu、Pb、Cr单位含量,单位微克/克(μg/g)
C1—测定试样中Cu、Pb、Cr含量,单位微克/升(μg/L)
C0—空白中Cu、Pb、Cr含量,单位微克/升(μg/L)
V—定容试样体积,单位毫升(mL)
m—试样质量,单位克(g)
Zn计算公式如下:
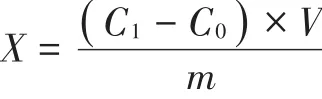
X—试样中Zn单位含量,单位微克/克(μg/g)
C1—测定试样中Zn含量,单位微克/毫升(μg/mL)
C0—空白中Zn含量,单位微克/毫升(μg/mL)
V—定容试样体积,单位毫升(mL)
m—试样质量,单位克(g)
2.7 数据处理
用Excel 2013对数据进行单因素方差分析(Duncan)以判断各组之间的差异性;结果都以平均值±标准差表示,P<0.05认为差异显著.
3 结果与讨论
3.1 不同级别水域中重金属含量比较
由表2可知,东江水域与一级支流水域相比,东江Cu、Cr、Pb三种元素的含量均显著低于一级支流水域(P<0.05),Zn元素含量两者无显著差异(P>0.05),这可能是由于一级支流的水流速度明显低于东江,Cu、Cr、Pb三种重金属元素的沉降率相对较高.二级支流水域未检出含有Cu元素,而Zn元素含量显著高于东江水域和一级支流(P<0.05),Cr元素含量略高于东江水域而显著低于一级支流水域(P<0.05),Pb元素含量明显低于东江水域和一级支流水域(P<0.05).由于二级支流与一级支流之间有大坝相隔,阻碍了两者之间水体的自由交换,导致二级支流重金属的含量不受一级支流的影响,其水域的重金属含量与一级支流无明显相关性,而主要取决于周围环境的影响.
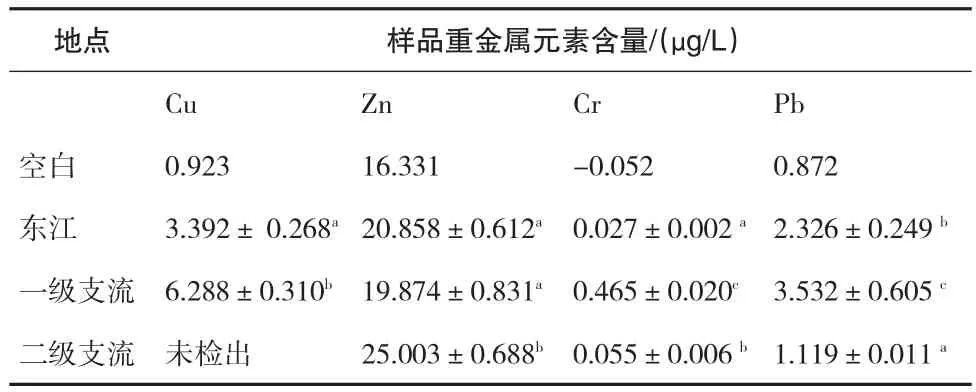
表2 不同级别水域的重金属含量
3.2 重金属元素在鱼类不同组织中的分布规律
从表3可以看出,Cu元素在所有样品中含量顺序为:肝脏>鳃>肌肉(P<0.05);Zn元素除了在二级支流的鲮鱼外,其余样品都是在鳃部含量最高,肝脏次之,肌肉最低(P<0.05);Cr元素不同样品三种组织中的含量无明显规律性;Pb元素除在东江样品的肌肉和肝脏中含量明显高于鳃外(P<0.05),一级支流样品中的含量为:肝脏>鳃>肌肉(P<0.05),以上研究结果与邓小蓉等[2]、张晓文等[4]以及杨晓云等[5]的有关鱼类重金属含量存在组织特异性的研究结果一致.主要食用部位肌肉,除东江样品的Pb元素外,其余重金属的含量都比较低,均低于水产品质量安全标准,可放心食用.
总体而言,Cu、Pb元素主要存在于鱼类的肝脏,Zn元素主要存在于鳃,Cr元素无明显规律.东江样品中Pb元素在肌肉中的含量与肝脏相当,Cr元素在鳃部含量最高,与其他采样点情况不一致,与刘芳芳[3]的研究结果Pb、Cr主要存在于肝脏,肌肉含量最低也不一致,这可能是由于东江水域的水流较快,导致鱼类的新陈代谢速度不同所致.
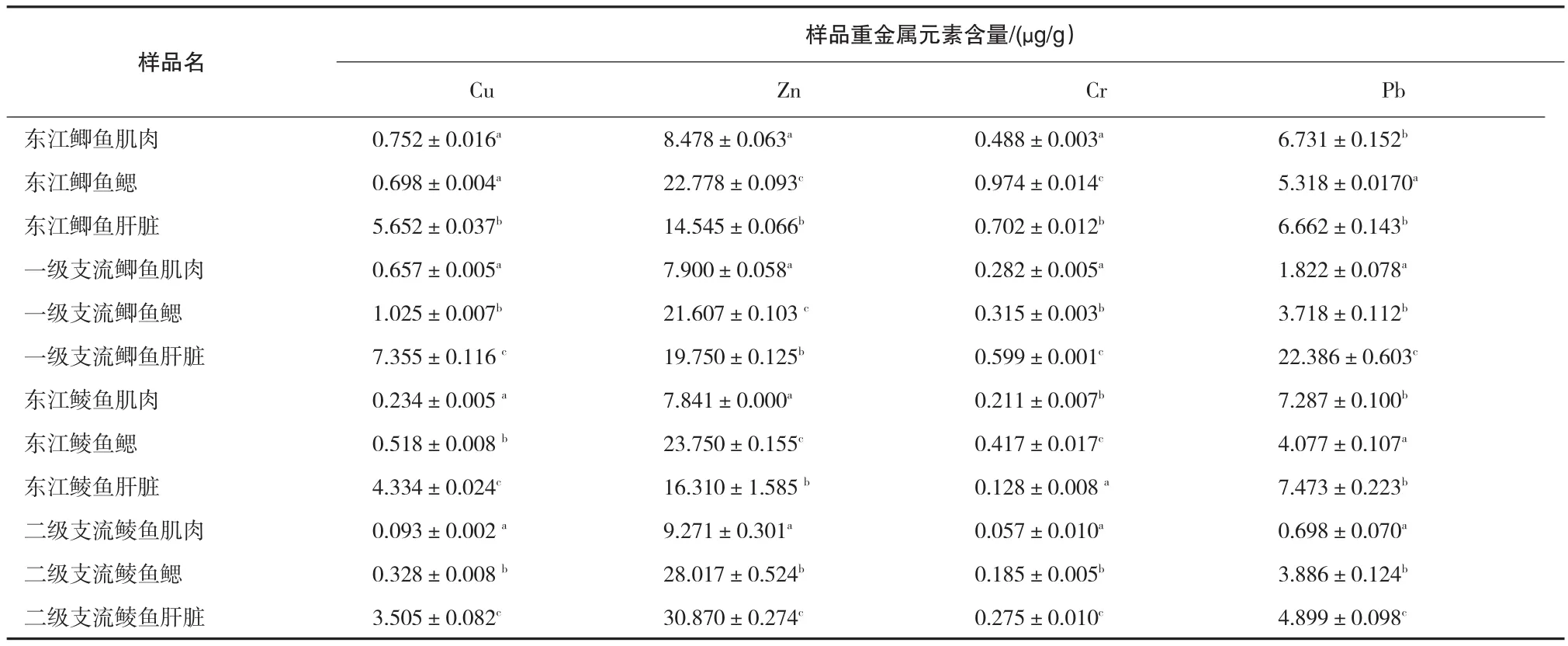
表3 鱼各组织中的重金属含量比较
3.3 不同水域中鱼类重金属含量的比较
3.3.1肌肉中重金含量的对比
由表4可知,东江鲫鱼肌肉中的Cu、Zn、Cr、Pb四种元素的含量均明显高于一级支流(P<0.05);东江鲮鱼肌肉中除Zn元素外,Cu、Cr、Pb三种元素的含量均高于二级支流鲮鱼肌肉(P<0.05).东江水域中,鲫鱼肌肉除Pb元素则稍低于鲮鱼外,其余的Cu、Zn、Cr元素含量均显著高于鲮鱼(P<0.05),说明鲫鱼肌肉比较鲮鱼更易富集Cu、Zn、Cr三种重金属元素,更容易受到污染,食用时需要更加注意.
我国水产品Cu、Zn、Cr、Pb的质量安全标准上限分别为50、40、2、0.5μg/g[7-8],东江及其一级、二级支流鲫鱼和鲮鱼主要食用部位肌肉中的Cu、Zn、Cr含量都比较 低 ,含 量 范 围 分别为 0.093~0.752、7.841~9.271、0.057~0.488μg/g,均低于相应的安全食用标准上限;但肌肉中Pb的含量范围为0.689~7.287μg/g,远高于其安全食用标准上限;说明东江流域的Pb元素严重超标,需引起环保相关部门的重视,加强监督管理.
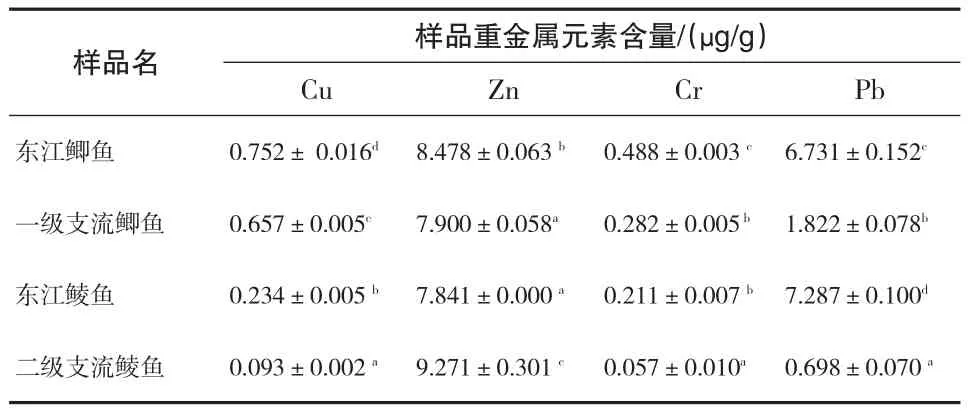
表4 鱼类肌肉中的重金属含量比较(n=3)
3.3.2鳃中重金属含量的对比
由表5可知,东江鲫鱼、鲮鱼鳃部Cr、Pb元素含量均明显高于一级支流鲫鱼鳃部、二级支流鲮鱼鳃部(P<0.05);Cu元素东江低于一级支流,高于二级支流(P<0.05);Zn元素东江高于一级支流,低于二级支流(P<0.05).东江鲫鱼Cu、Zn、Cr、Pb含量均显著高于鲮鱼(P<0.05),说明鲫鱼比较鲮鱼鳃部更易富集以上四种重金属元素.
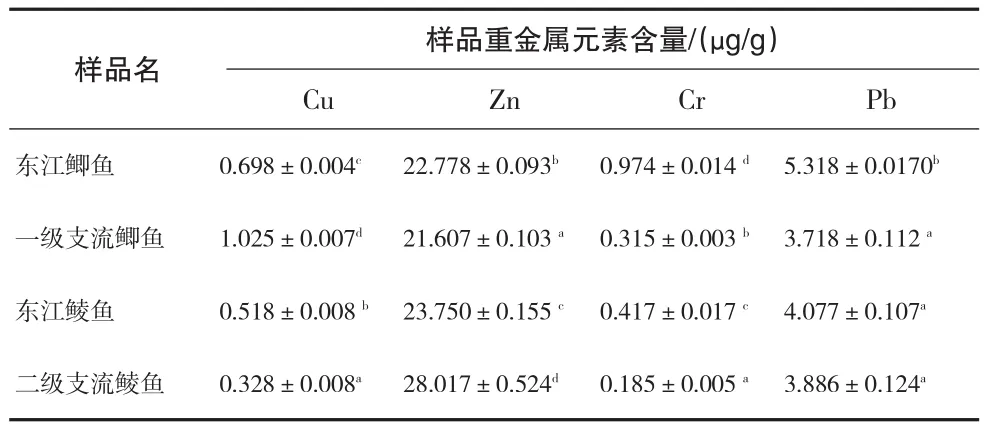
表5 鱼类鳃中的重金属含量比较(n=3)
3.3.3肝脏中重金属含量的对比
从表6可看出,东江鲫鱼肝脏中Cu、Zn、Pb三种元素的含量均低于一级支流,而Cr元素含量则高于一级支流(P<0.05);东江鲮鱼肝脏中Zn、Cr两种元素含量低于二级支流鲮鱼,而Cu、Pb两种元素含量则高于二级支流鲮鱼(P<0.05).东江水域中,鲫鱼肝脏中Cu、Cr元素的含量高于鲮鱼,Zn、Pb元素则低于鲮鱼(P<0.05).
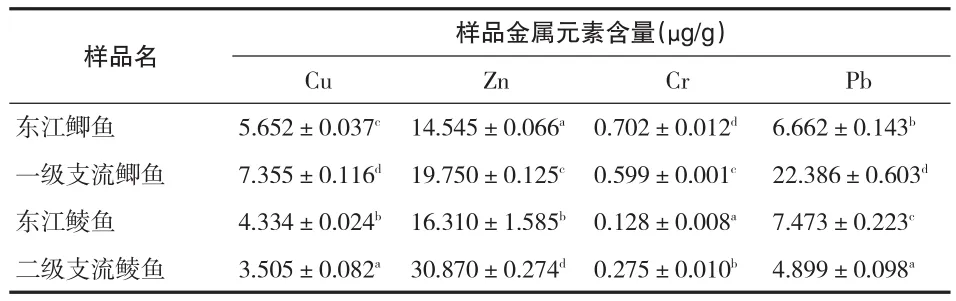
表6 鱼类肝脏中的重金属含量比较(n=3)
3.4 鱼类重金属含量与环境的相关性分析
3.4.1鲫鱼与水质重金属含量的相关性分析
由图2可知,与水质中Cu含量变化趋势一致的是鲫鱼肝脏组织(图2-1);与水质Zn含量变化趋势一致的是鳃和肌肉组织(图2-2);所有组织的Cr含量与水质变化趋势相反,与环境无明显相关性(图2-3);与水质Pb含量变化趋势一致的是肝脏组织(图2-4).综上,肌肉和鳃中的Zn含量、肝脏中的Cu、Pb含量变化趋势与水质一致,说明与环境存在密切相关性,可作为水域重金属污染指标.
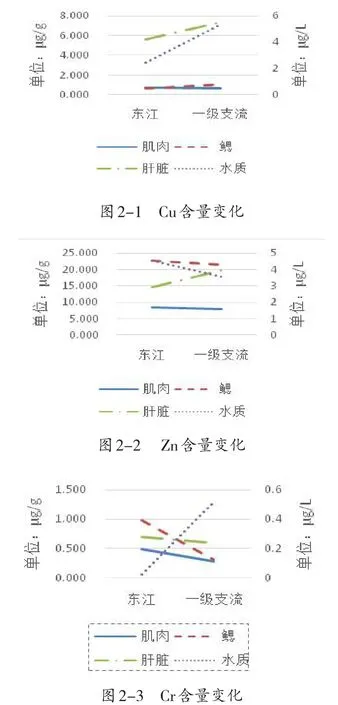
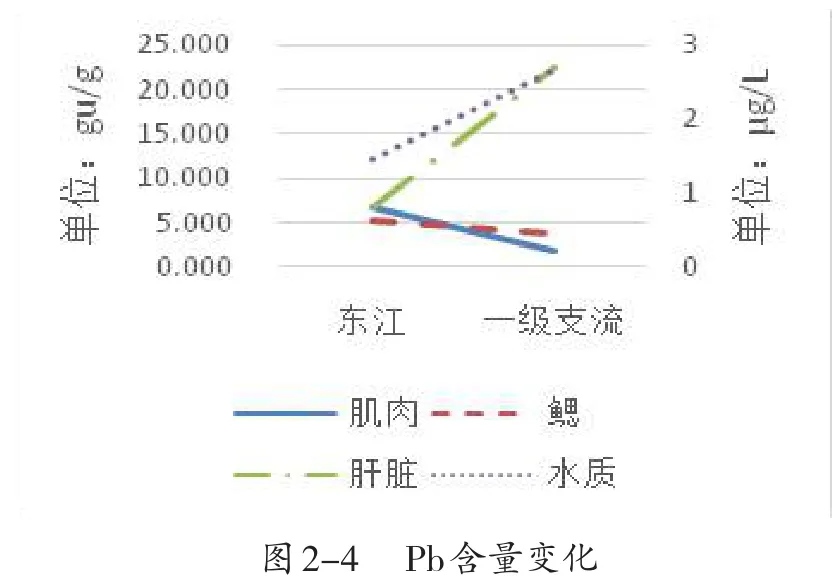
图2 在不同水域鲫鱼各组织重金属含量变化趋势(n=3)
3.4.2鲮鱼与水质重金属含量的分析
由图3可得,鲮鱼各组织Cu、Zn、Pb含量变化趋势都与水质含量变化相同(图3-1,3-2,3-4);但Cr含量变化趋势与水质相同的只有肝脏,而与肌肉和鳃相反(图3-3).综上,鲮鱼各组织的重金属含量与环境存在密切相关性,说明鲮鱼受环境中的重金属含量影响比较大,可以用水域的重金属污染情况作为该水域中鲮鱼的受重金属污染的参考指标.
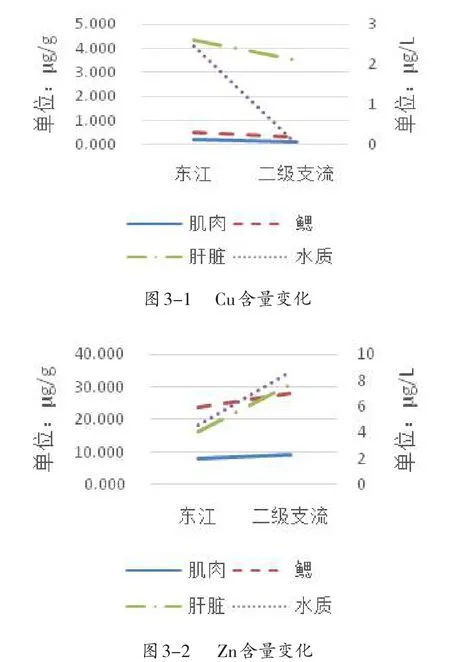
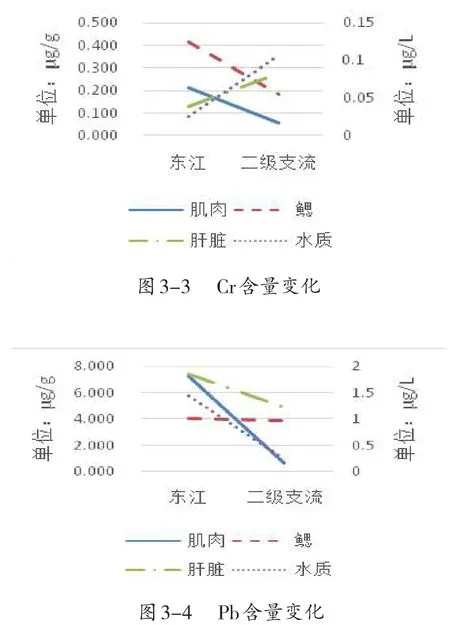
图3 在不同水域鲮鱼各组织重金属含量变化趋势(n=3)
4 结论
惠州市东江水域鲫鱼和鲮鱼中的Cu、Pb元素主要存在于肝脏,Zn元素主要存在于鳃,Cr元素无明显规律.这与刘芳芳等[3-6]的研究结果相一致,其结果表明Zn元素主要富集于淡水鱼的鳃部,Cu、Cd、Pb、Cr等元素主要富集于肝脏或肾脏,肌肉中的含量最少.说明不同地区的鱼类均存在一定的重金属污染,其中鱼类的肌肉为重金属污染最低的组织,而肝脏组织受污染程度最高.
惠州市东江水域鲫鱼和鲮鱼的主要食用部位肌肉中Cu、Zn、Cr含量都较低,均低于水产品质量安全标准的上限;但肌肉中Pb的含量范围为0.689~7.287μg/g,则远高于其安全食用标准上限0.5μg/g[7-8],说明东江流域的Pb元素严重超标,需引起环保相关部门的重视,加强监督管理.
惠州市东江水域鲫鱼和鲮鱼肌肉、鳃组织中的Zn元素、肝脏中的Cu、Pb元素含量变化趋势均与水域中的含量变化趋势一致,说明与环境存在较大的相关性,因此可以作为水域重金属含量的参考指标;亦可用该水域的重金属含量作为鱼类重金属残留的参考指标.
——东江鱼(实业)集团有限公司

