改性磁铁矿/H2O2非均相类Fenton体系催化降解橙黄II的研究
荆王松,王长智,梅荣武,史惠祥,徐峰
(1. 浙江大学 环境与资源学院, 浙江 杭州 310058; 2. 浙江省环境保护科学设计研究院, 浙江 杭州 310007; 3. 嘉兴市绿野环境工程有限公司, 浙江 嘉兴 314000)
高级氧化工艺(AOPs)因操作简单、处理效果高被广泛应用于难降解有毒有害的废水处理中. Fenton氧化技术作为AOPs中应用最广泛的技术之一,由于体系中Fe2+和H2O2能在酸性条件下生成具有强氧化性(氧化还原电位为3.08 eV,仅次于氟[1])的羟基自由基(·OH),在难降解污染物的处理中优势明显. 传统均相Fenton反应体系受限于狭窄的pH反应范围,需要大量双氧水产生羟基自由基(·OH),使生成的大量含铁污泥产生二次污染[2]. 为了克服Fenton反应中形成的大量铁泥对反应的影响,提高催化剂的重复利用率,非均相催化剂成了研究热点[3-4]. 其中,铁基固体在中性pH条件下表现出较高的催化活性[5],研究表明,磁铁矿(Fe3O4)能催化H2O2生成可高效降解污染的·OH[6-8],此研究已引起广泛关注.
Fe3O4具有稳定的八面体间隙结构,可使Fe2+和Fe3+在同一结构中被氧化还原. 但是非纳米尺度的Fe3O4粒子比表面积小,在水中分散性差,制约了Fe3O4粉末在实际水处理中的应用. 为了克服这一缺陷,研究者们采用不同的物化手段对Fe3O4粉末进行表面改性. 贾成科等[9]利用SiO2的表面包覆改性制备的Fe3O4磁性颗粒,借助SiO2的空间位阻限制磁性颗粒的团聚. 林建伟等[10]利用阳离子表面活性剂改性Fe3O4-沸石复合材料,对水中刚果红具有良好的去除效果. 武荣成等[11]利用Fe(OH)3对Fe3O4表面进行包覆改性,在提高其比表面积的同时,吸附性能也得以大大提升,还有利用其他表面活性剂: 如枸橼酸钠[12]、油酸[13]、四甲基氢氧化铵[14]和淀粉[12]对Fe3O4粉末进行表面改性. 此外,浓硫酸作为强酸性和强氧化性物质,因能够活化表面官能团、提高比表面积,也常被用于各种催化剂及吸附材料的改性.官九红[15]利用浓硫酸对活性炭进行改性,通过改变活性炭表面基团提高其吸附性能. 王红艳等[16]利用浓硫酸改性凹凸棒黏土,由于凹凸棒的不连续溶解提高了其对Pb2+的吸附能力. 而且球磨混合能够产生强烈的塑性变形,降低元素扩散的激活能,增强颗粒表面活性[17]. 基于以上研究,在球磨混合状态下,本文利用浓硫酸对磁铁矿粉进行表面改性,以此为非均相类Fenton体系催化剂,并探讨对橙黄II模拟染料废水的降解效果.
1 实验部分
1.1 实验试剂及装置
98%硫酸(H2SO4)、七水合硫酸亚铁(FeSO4·7H2O)、30%过氧化氢(H2O2)、盐酸(HCl)、氢氧化钠(NaOH),以上试剂均购于上海沪试实验室器材股份有限公司;橙黄II(C16H11N2NaO4S)购于上海阿拉丁生化科技股份有限公司;磁铁矿(Fe3O4)取自浙江省某矿山,曝气装置为超静音可调式增氧泵,购置于中山市松宝电器有限公司;pH计型号为SG2,购于梅勒特-托利多仪器(上海)有限公司;实验用水为去离子水.
1.2 实验方法
1.2.1 M-Fe3O4的制备
在球磨仪中,按质量比1: 2混合浓硫酸溶液和磁铁矿粉,通过球磨混合4~5 h对磁铁矿粉进行表面改性,反应后得到改性磁铁矿(M-Fe3O4).
1.2.2 M-Fe3O4的表征
透射电镜(TEM): 采用美国FEI TECNAL G2F20,最高加速电压220 kV,最小束斑尺寸为0.8 nm;比表面积测定: 采用美国麦克仪器公司ASAP2020型BET分析仪;X射线衍射(XRD): 采用的辐射源为Cu靶,扫描角度为10°~80°,测角仪扫描半径为180 mm;傅里叶红外光谱(FT-IR): 美国NICOLET公司AVA TAR370,波数为7 800~3 500 nm.
1.2.3 M-Fe3O4在Fenton体系的催化活性
在室温(23 °C)条件下,取100 mL初始浓度为500 mg·L-1的橙黄II模拟废水,用5%盐酸(HCl)和2 mol·L-1氢氧化钠(NaOH)调节到预定pH值,加入催化剂后超声1 min,在曝气搅拌开始后加入H2O2启动反应. 反应过程中定时取样,处理离心后分别利用紫外分光光度计(哈希)和总有机碳测定仪(岛津)测定橙黄II浓度及TOC浓度,通过计算反应前后浓度之差与初始浓度的比值确定脱色率和TOC去除率. 除了考察磁铁矿、M-Fe3O4和FeSO4·7H2O作为Fenton体系催化剂降解橙黄II情况外,还探究了M-Fe3O4投加量、H2O2投加量、初始反应pH值等因素对污染物去除的影响.
2 结果与讨论
2.1 催化剂的表征
2.1.1 X射线衍射(XRD)分析
利用XRD分别对磁铁矿粉和M-Fe3O4进行晶型分析,XRD谱图如图1所示.
由图1可知,改性后的M-Fe3O4在磁铁矿样品相应的衍射峰位置依然有衍射峰,但峰强明显减弱,其中在11.3°,18.7°,21.9°,25.9°,26.3°,27.1°,28.7°等位置出现新的出峰,表明M-Fe3O4内部保留了Fe3O4晶型结构,改性后新产生Fe3(SO4)3•9H2O、FeSO4•H2O、 FeH(SO4)2•4H2O、 Fe3(SO4)2-(OH)2•3H2O等羟基硫酸铁混盐[18],此混盐可能有利于催化H2O2生产•OH.

图1 磁铁矿和M-Fe3O4的XRD图谱Fig.1 XRD spectra of magnetite and M-Fe3O4
2.1.2 透射电镜(TEM)及比表面积分析
利用TEM技术分别对磁铁矿粉和M-Fe3O4表面微形结构进行观察,其TEM谱图如图2所示.

图2 磁铁矿和M-Fe3O4的TEM图Fig.2 TEM images of magnetite and M-Fe3O4
对比图2中的2个样品可以明显看出,磁铁矿为无规则的晶型结构,粒径尺寸为微米级,晶型较为完整,而M-Fe3O4在硫酸表面改性后粒径明显下降,这与XRD中磁铁矿峰高降低一致. 颗粒表层明显呈疏松结构,内部可能存在未完全反应的Fe3O4核心,表层覆盖硫酸铁混盐结构组分. 磁铁矿粉和M-Fe3O4比表面积分别为1.92 和5.85 m2·g-1. 改性后比表面积提高了3.05倍.
2.1.3 傅里叶红外光谱(FT-IR)分析
利用FT-IR技术分别对磁铁矿粉和M-Fe3O4进行表面官能团分析,其FT-IR谱图如图3所示.
由图3可知,相较磁铁矿粉,M-Fe3O4样品在1 200 cm-1处出现了明显的吸收峰,为SO42-中的S=O吸收振动吸收峰[19],在3 434 和1 638 cm-1处均出现了明显的吸收峰,为缔合O-H的对称伸缩振动峰[20],表明M-Fe3O4在颗粒表面生成了较多的带结晶水的硫酸铁化合物,与XRD分析结果一致.
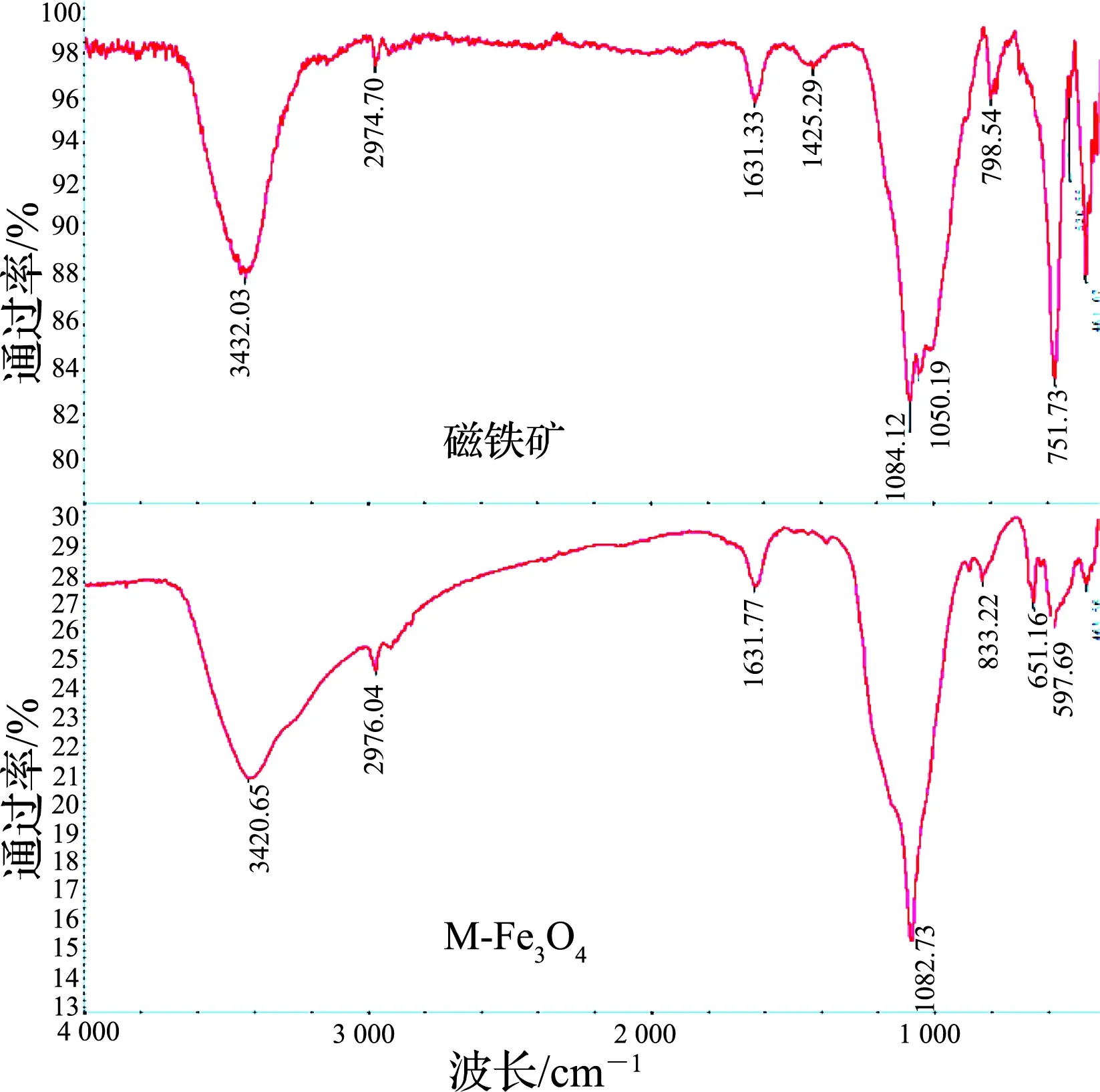
图3 磁铁矿和M-Fe3O4的FT-IR图谱Fig.3 FT-IR spectra of magnetite and M-Fe3O4
2.2 橙黄II降解效果分析
2.2.1 M-Fe3O4的催化活性
以单一的H2O2与M-Fe3O4为对照,考察了FeSO4/H2O2、磁铁矿/H2O2和M-Fe3O4/H2O23种不同体系对模拟废水的降解情况.具体反应条件为: 催化剂投加量均为0.25 g·L-1,H2O2用量为5 mL·L-1,体系初始pH=4. 不同体系对橙黄II的降解情况如图4所示.

图4 不同Fenton体系下橙黄II的降解效果Fig.4 Degradation of Orange II under different Fenton systems
由图4可知,2组对照组中橙黄II浓度基本不发生变化,可能由于H2O2和M-Fe3O4自身氧化能力和吸附能力有限,不足以氧化降解橙黄II. 在上述3种Fenton体系中,磁铁矿/ H2O2体系降解效果最差,磁铁矿粉比表面积小,催化活性点位少,使得H2O2的利用率大大降低,导致降解效果不理想,橙黄II的脱色率仅为5%. FeSO4/ H2O2传统均相Fenton体系降解速率最快,且反应后对橙黄II的脱色率达到91%.均相的反应条件使得Fe(II)能快速地催化H2O2,产生大量强氧化性·OH,迅速降解目标污染物. M-Fe3O4/H2O2体系反应速率略慢于均相Fenton体系,但对橙黄II的脱色率与FeSO4/ H2O2体系相近,最高可达92%. M-Fe3O4保留了磁铁矿的磁响应性,可通过磁铁进行回收. 因此,在催化效果和可回收性上,M-Fe3O4具有一定的优势.
2.2.2 M-Fe3O4投加量对去除效果的影响
考察了M-Fe3O4投加量分别为0.1,0.25 ,0.50 ,1.0 ,1.50,2.0 g·L-1时,M-Fe3O4/H2O2非均相类Fenton体系对于模拟废水的降解情况,具体反应条件为: H2O2用量为3 mL·L-1,体系初始pH=3. 实验结果如图5所示.

图5 M-Fe3O4投加量对橙黄II降解率的影响Fig.5 Effect of different M-Fe3O4dosages on the degradation of Orange II
由图5可知,当催化剂投加量由1.0 g·L-1增加到0.25 g·L-1时,橙黄II的降解率由65%提高到87%,可能是由于催化剂投加量的增加,催化H2O2的位点增多,提高了•OH的生成率,从而提高了体系的降解效率. 当催化剂投加量由0.25 g·L-1增加到2.0 g·L-1时,体系的降解效率由87%降低至65%,这是由于体系中H2O2的投加量有限,随着催化剂投加量的增加,H2O2与催化剂上活性位点碰撞的概率增加,因此在反应启动时,速率较快,对于投加量为0.25 g·L-1的体系,碰撞机会大大减少,反应速率较慢. 但过多的催化剂会促进H2O2的无效分解,对提高降解效率并不有利. 考虑反应体系的实际降解效果和经济性,最终确定M-Fe3O4的投加量为0.25 g·L-1.
2.2.3 H2O2投加量对去除效果的影响
考察了H2O2的投加量分别为1,1.5,2,3,3.5,4,5,5.5 mL·L-1时,M-Fe3O4/H2O2非均相类Fenton体系对于模拟废水的降解情况,具体反应条件为: M-Fe3O4用量为0.25 g·L-1,体系初始pH=3. 实验结果如图6所示.

图6 H2O2投加量对橙黄II降解率的影响Fig.6 Effect of different H2O2 dosages on the degradation of Orange II
由图6可知,当H2O2投加量由1 mL·L-1增加到5 mL·L-1时,橙黄II的降解率不断升高,由28%提高到92%,这是由于H2O2是Fenton体系中·OH的主要来源,H2O2的投加量直接影响橙黄II的降解速率及效率. 当H2O2投加量增加到5.5 mL·L-1时,体系的降解效率降低至80%,可能是过多的H2O2与·OH形成副反应产生氧化能力较弱的·O2H,降低了体系的降解效率. 由图6可知,当H2O2投加量为4 和5 mL·L-1时,橙黄II的降解效率提高不大. 因此,在其他反应条件一定的情况下,H2O2的最佳投加量为4 mL·L-1.
2.2.4 pH值对去除效果的影响
考察了最初pH值分别为3,4,5,6,7时M-Fe3O4/H2O2非均相类体系对模拟废水的降解情况,反应条件: M-Fe3O4用量为0.25 g·L-1,H2O2用量为4 mL·L-1. 实验结果如图7所示.
由图7可知,当pH值为3时,反应速率最快,但对橙黄II的降解效率仅为84%,低于pH值为4,5,6时的体系. 这可能是由于在强酸性条件下,M-Fe3O4表面Fe(III)向Fe(II)的转化受阻,使降解效率下降. 当pH值为4,5,6时,降解速率基本不变,且反应结束后降解效率相近,约为92%. 可能是因为催化剂表面的水合硫酸铁混盐具有一定的亲水性,能够在近中性条件下保持较好的活性. 当pH值为7时,催化剂的亲水能力有限,抑制了其活性,导致反应缓慢,降解效率低,反应后降解效率仅为7%. 为避免消耗更多的酸和碱,反应最佳pH值取为6.
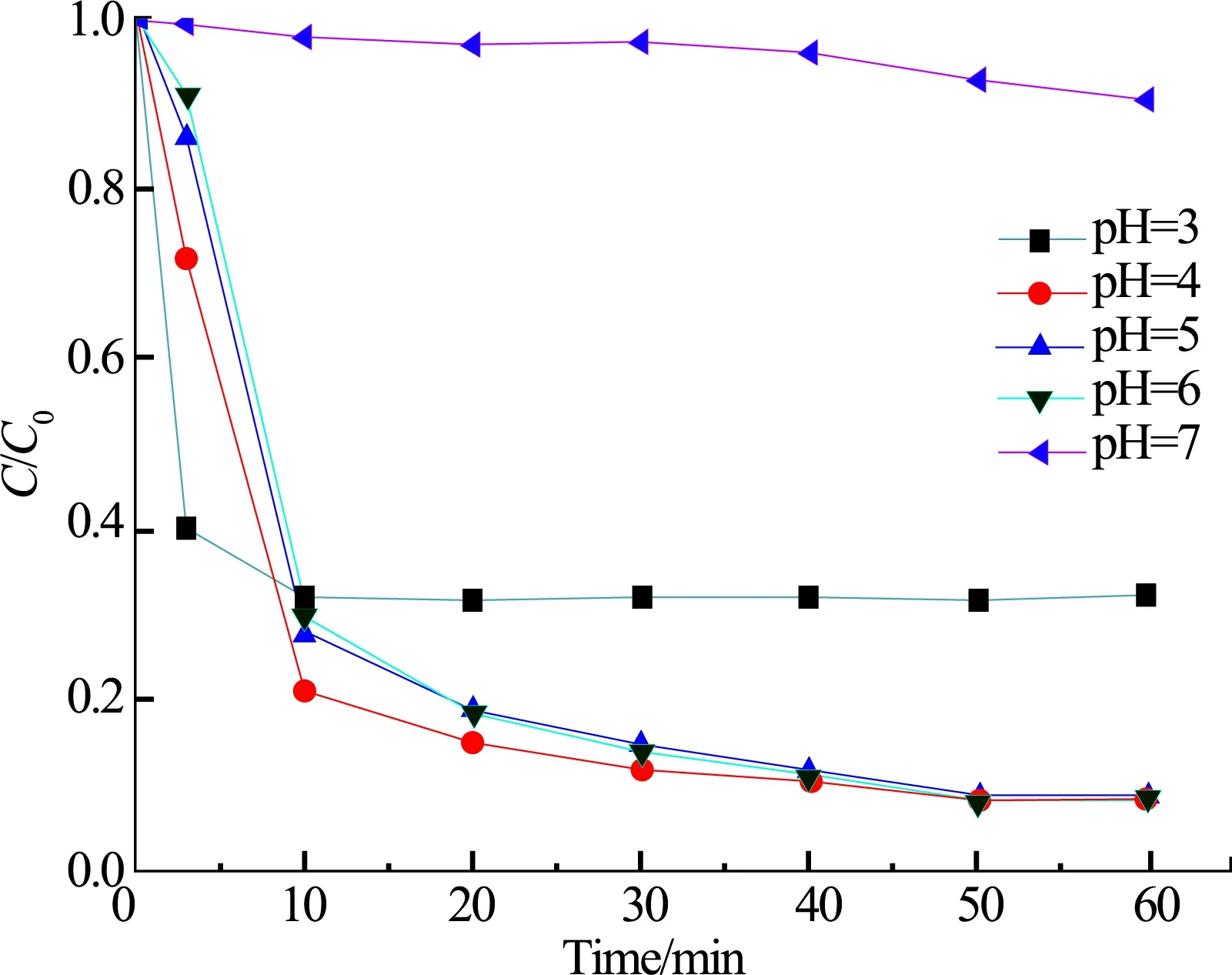
图7 不同初始pH值对橙黄II降解率的影响Fig.7 Effect of different initial pH on the degradation of Orange II
2.2.5 橙黄II的降解率及TOC的去除率
经分析确定了上述实验的最佳反应条件: 初始pH值为6,M-Fe3O4用量为0.25 g·L-1,H2O2用量为4 mL·L-1. 进一步研究了橙黄II及TOC在M-Fe3O4/ H2O2非均相类Fenton体系中的降解去除情况,实验结果如图8所示.

图8 橙黄II降解率及TOC去除率Fig.8 Degradation rate and TOC removal rate of Orange II
由图8可知,随着反应时间的延长,橙黄II降解率和TOC去除率逐渐增大,但相较降解率,TOC的去除率较慢. 当反应进行到60 min时,橙黄II降解率达到92%,而TOC去除率仅为47%,表明仍有部分未被完全矿化的橙黄II染料分子被氧化为其他中间产物.
3 催化降解机理初探
3.1 自由基捕获
为考察体系中主要的活性自由基,采用叔丁醇作为·OH捕获剂,以进一步阐明该反应体系的催化降解机理. 在初始pH值为6,M-Fe3O4投量为0.25 g·L-1,H2O2用量为4 mL·L-1,叔丁醇用量为1 mL·L-1时,分别考察了M-Fe3O4/H2O2和M-Fe3O4/H2O2+叔丁醇对橙黄II的降解情况. 实验结果如图9所示.

图9 叔丁醇对橙黄II降解的影响Fig.9 Effect of tert-butanol on the degradation of Orange II
由图9可知,无叔丁醇的非均相类Fenton体系对橙黄的处理效率为92%. 当体系中投加叔丁醇后,对橙黄的降解效率大幅度降低,仅为14%,说明该体系中对橙黄降解起主要作用的是·OH.
3.2 降解机理分析
为进一步探究M-Fe3O4表面硫酸铁混盐是否为催化活性提高的主要因素,将M-Fe3O4置于N2保护的管式炉内,在温度为500 °C的条件下进行煅烧,以破坏其表面水合硫酸盐结构,煅烧后催化剂为2#M-Fe3O4. 在初始pH值为6,M-Fe3O4和2#M-Fe3O4用量均为0.25 g·L-1,H2O2用量为4 mL·L-1时,分别考察M-Fe3O4/ H2O2和2#M-Fe3O4/H2O2非均相Fenton体系对橙黄II的降解效果. 实验结果如图10所示.
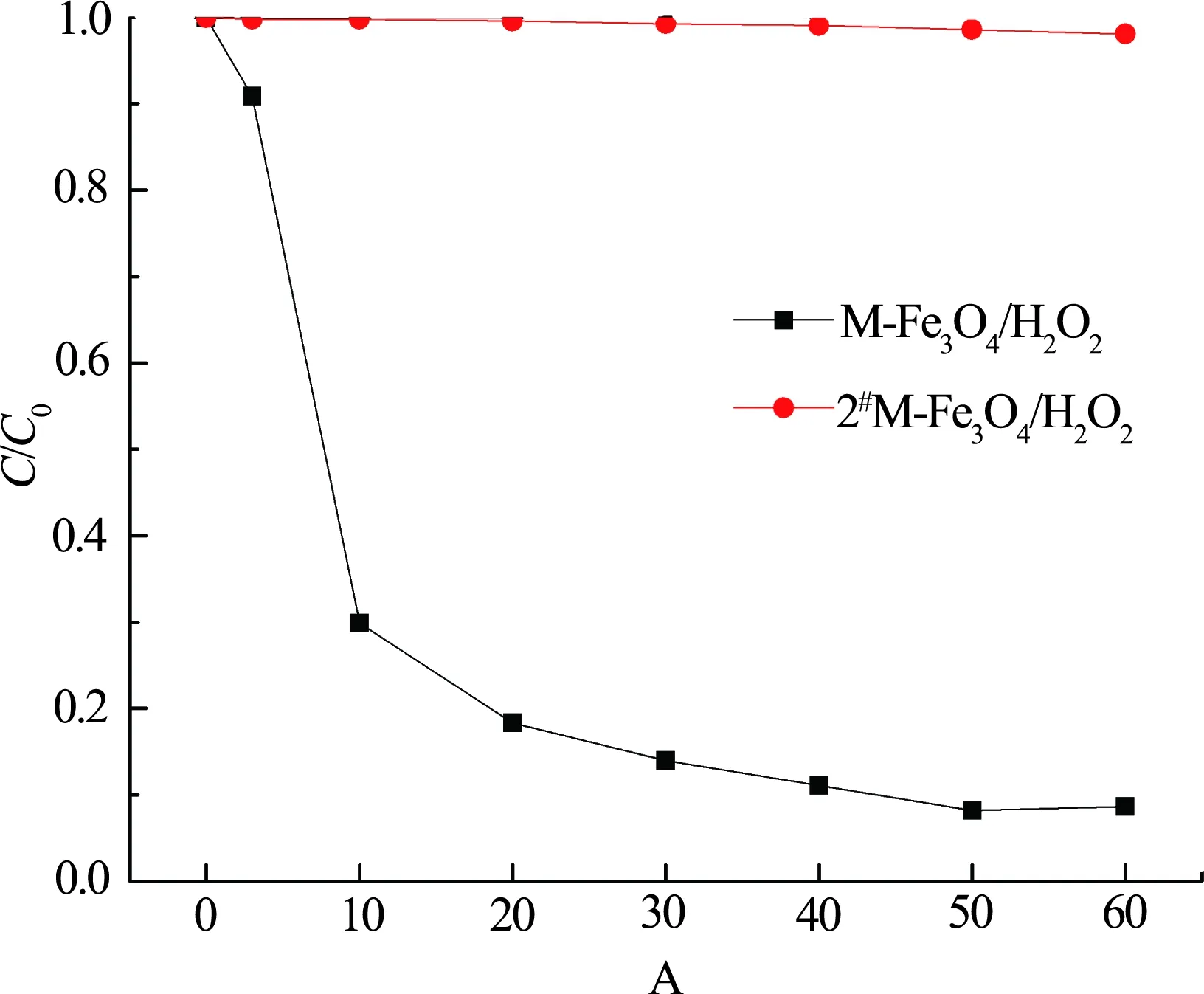
图10 煅烧后M-Fe3O4对橙黄II降解的影响Fig.10 Effect of M-Fe3O4(before and after calcination)on the degradation of Orange II
由图10可知,管式炉煅烧后的2#M-Fe3O4催化剂活性大幅度下降,对于橙黄II的降解效果微乎其微. 推测可能是M-Fe3O4表面的水合硫酸铁混盐在高温条件下转化为铁的氧化物或其他中间产物,结合不够紧密的部分混盐出现脱落等情况,从而导致催化活性降低. 这一结果证实了之前的猜测,Fe3(SO4)3·9H2O、FeSO4·H2O等物质在催化H2O2生成·OH方面起重要作用.
4 结 论
4.1通过在球磨混合状态下,利用浓硫酸对磁铁矿粉进行表面改性,制备了非均相Fenton催化剂M-Fe3O4. 相较于磁铁矿/H2O2和FeSO4/H2O22种Fenton体系,M-Fe3O4/H2O2非均相类Fenton体系表现出较强的降解性能.
4.2对比磁铁矿粉和M-Fe3O4的XRD、TEM和FT-IR图,结果显示M-Fe3O4粒径明显减小,比表面积有所提高. 改性后的颗粒可能仍具有Fe3O4内核,有利于催化剂的回收. 体系中主要活性自由基为·OH. M-Fe3O4表面覆盖硫酸铁混盐等活性组分,可能是其催化活性提高的主要原因,其催化机理有待进一步探讨.
4.3M-Fe3O4/H2O2非均相类Fenton体系能在pH值为6时进行反应,为进一步的工程应用提供了实验支撑. 当M-Fe3O4用量为0.25 g·L-1,H2O2用量为4 mL·L-1,初始反应pH值为6,反应60 min时,对橙黄II模拟染料废水的降解效果最好,橙黄II脱色率达到92%,TOC去除率达到47%.


