中药复方多糖对不同MHC B-LβⅡ基因型蛋鸡育雏育成期免疫功能的影响
刘晓婷,罗 燕,陈 洁,连科讯,刘 钢,马 昭,朱晓庆,谷新利
(石河子大学动物科技学院,新疆石河子 832003)
0 引 言
【研究意义】在畜禽生产中使用免疫增强剂可增强动物机体的免疫应答,辅助疫苗发挥良好防疫效果。中药多糖是从中草药中提取出的具有增强免疫、抗炎、抗病毒、抗应激、调节造血功能等多种生物活性作用的成分之一,它毒副作用小,体内残留量低,具有开发成疗效确定、性质稳定、毒副作用小的免疫增强剂的前景[1]。【前人研究进展】研究表明,中药多糖可以通过提高免疫器官指数、促进淋巴细胞增殖,影响细胞因子的生成与分泌,促进抗体的产生等途径来提高动物机体的免疫力[2,3]。同时,有研究发现,多糖类物质是T细胞依赖性抗原之一,可以通过胞吞途径,被MHC II类分子处理、呈递,最终被TCR识别,参与机体细胞的免疫,诱导特异性抗体产生[4]。【本研究切入点】经合理配伍组成的中药复方,其免疫增强效果在一定程度上优于原有的单味中药[5]。主要组织相容性复合体(MHC)是动物抗病育种的主要候选基因群之一,而具有丰富多态性的鸡MHC B-Lβ II基因的遗传变异与机体免疫性状有着显著的关联性,表现出不同个体间免疫功能存在强弱的差异[6,7]。研究中药复方多糖对不同MHC B-Lβ II基因型蛋鸡育雏育成期免疫功能的影响。【拟解决的关键问题】试验排除因MHC B-Lβ II基因多态性而导致的不同基因型个体免疫能力的差异,研究中药复方多糖对蛋鸡脏器指数、血常规部分指标、GM-CSF和G-CSF质量浓度的影响,筛选出其对各基因型鸡的最佳免疫剂量,为中药复方多糖在临床的应用奠定理论基础。
1 材料与方法
1.1 材 料
1.1.1 药物
中药复方多糖由石河子大学中兽医学研究室提供。复方由当归、党参、川芎、黄芪、熟地、淫羊藿、山楂、茯苓、何首乌、补骨脂与麦冬等11味中药按一定配比组成,复方多糖浓度为77.10%,用等量灭菌超纯水稀释,将中药复方多糖配置成50(高剂量)、25(中剂量)和12.5 mg/mL(低剂量)3个质量浓度,4℃保存备用。
1.1.2 主要试剂
动物血细胞分析仪应用试剂购自深圳普康电子有限公司;鸡GM-CSF、G-CSF ELISA检测试剂盒均购自上海蓝基生物有限公司;血液基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;鸡新城疫、传染性支气管炎二联活疫苗(La Sota 株+H120株)及鸡传染性法氏囊病活疫苗(B87株)均购自哈药集团生物疫苗有限公司;鸡新城疫病毒(La Sota株)、传染性支气管炎病毒(M41株)二联灭活疫苗,购自普莱柯生物工程股份有限公司;禽流感二价灭活疫苗(H5N1 Re-6株+H9N2 Re-2株)购自哈尔滨维科生物技术开发公司。
1.2 方 法
1.2.1 PCR-SSCP基因型检测
1.2.1.1 基因组DNA的提取
翅下静脉采血0.2 mL/羽,置于肝素钠抗凝采血管中摇匀,-20℃冷冻保存。用血液基因组DNA提取试剂盒提取DNA,2% 琼脂糖凝胶电泳检测后,-20℃保存备用。
1.2.1.2 引物设计与合成
根据GenBank中收录的鸡MHC B-LβⅡ基因序列(NO.M29763.1),应用Oligo软件设计引物,引物序列为:上游引物:5‘-AAACCGACCGTCTGGCGTGCTA-3’,下游引物:5‘-TTACCCCACGCCTGGCTGAT-3’,扩增片段238 bp,引物由华大基因科技股份有限公司合成。
1.2.1.3 PCR扩增
PCR扩增体系20 μL:2×PCR Mix 10 μL,模版DNA 2 μL,上、下游引物各0.5 μL,ddH2O 7 μL。PCR反应程序:95℃预变性5 min;94变性40 s,60.5℃退火45 s,72℃延伸35 s,32个循环;72℃延伸10 min;4℃保存。取5 μL PCR 扩增产物由2%琼脂糖凝胶电泳检测,凝胶成像系统观察并拍照。
1.2.1.4 PCR-SSCP分析及序列测定
取3 μL PCR产物加7 μL 变性上样缓冲液,98℃变性10 min,变性结束后迅速置于冰上冰浴10 min。用8%聚丙烯酰胺凝胶(Acr∶Scr=29∶1)电泳检测,300 V电压预电泳10 min,120 V电泳16 h后,固定、银染、显色,判定基因型,拍照保存。各取3个不同基因型个体的PCR产物进行纯化回收,送华大基因科技股份有限公司进行测序,对PCR-SSCP分型结果进一步验证。
1.2.2 分组
500羽1日龄京粉1号蛋鸡,购自新疆昌吉某一孵化场提供,根据MHC B-Lβ II基因第3外显子PCR-SSCP的检测结果分组,再将各组分为高、中、低剂量中药多糖组和空白对照组。分别于8日龄肌肉注射50、25、12.5 mg/mL中药复方多糖和生理盐水,每只0.2 mL,连续注射7 d。
所用试验鸡1日龄马立克疫苗喷雾免疫(于孵化场进行),7日龄新、传二联活疫苗点眼免疫,21日龄新、传二联活疫苗点眼与新、传二联灭活苗肌注免疫,14日龄法氏囊疫苗滴口免疫,28日龄禽流感二联灭活苗免疫。在相同条件下常规饲养,饲养条件、营养水平和饲养管理均一致,饲养期为7周,整个试验期鸡群健康状况良好。
1.2.3 检测项目
1.2.3.1 免疫器官指数
各组鸡分别于21、35、49日龄随机抽取5只,称重后颈静脉放血致死,迅速切开颈部和腹腔,完整分离并摘取胸腺、脾脏和法氏囊,剔除筋膜和脂肪组织,用滤纸吸干血水后准确称重。免疫器官指数计算公式如下:
免疫器官指数=器官重量(g)/活体重(kg)×100%。
1.2.3.2 血常规
每组随机抽取5只试验鸡,21、35、49日龄翅下静脉采集EDTA抗凝血3 mL,用动物血细胞分析仪进行血常规分析,主要分析白细胞总数(WBC)、淋巴细胞(LYM)、中性粒细胞(GRA)、红细胞总数(RBC)、血红蛋白(HGB)、血小板总数(PLT)。
1.2.3.3 血清GM-CSF、G-CSF质量浓度的测定
每组随机抽取5只试验鸡,于21、35、49日龄翅下静脉采集非抗凝血3 mL,37℃静置1 h,分离血清,测血清中GM-CSF、G-CSF的质量浓度(均严格按照试剂盒说明书进行操作)。
1.3 数据处理
采用SPSS 17.0软件对数据进行方差分析和多重比较,数据以“x±SD”表示。
2 结果与分析
2.1 PCR扩增结果
用所设计的引物对基因组DNA进行扩增,取所得PCR产物5 μL于2 %琼脂糖凝胶上进行电泳检测,研究表明,所设计引物的扩增结果较好,片段长度与预期大小一致,条带清晰、无非特异性条带,可直接进行SSCP分析。图1
2.2 SSCP检测
对所有DNA样本的PCR产物进行SSCP多态性检测,发现所扩增片段有3种基因型,分别定义为AA (103羽)、BB(266羽)和BC(131羽)。图2

M,Trans DNA Marker I ;1~7,MHC B-Lβ II PCR扩增产物
M, Trans DNA Marker I; 1-7, PCR products of MHC B-Lβ II
图1 MHC B-LβⅡ的PCR扩增结果
Fig.1 The PCR amplification results of MHC B-Lβ II

1、6、8、10:BC型;2、4、7、9:BB型;3、5:AA型
1、6、8、10:BCgenotype; 2、4、7、9:BBgenotype; 3、5;AAgenotype
图2 部分试验鸡MHC B-LβⅡ基因型的PCR-SSCP检测
Fig.2 PCR-SSCP detection of MHC B-LβⅡ genotype in partial hen
2.3 中药复方多糖对不同MHC B-LβⅡ基因型蛋鸡免疫器官指数的影响
研究表明,与空白对照组相比,21日龄,高剂量中药复方多糖可显著提高AA基因型和BC基因型鸡的脾脏、法氏囊指数(P<0.05);中剂量中药复方多糖可显著提高AA基因型鸡的脾脏指数和BC基因型鸡的法氏囊指数(P<0.05);35日龄,高剂量中药复方多糖可显著提高AA基因型鸡的法氏囊指数与BC基因型鸡的胸腺指数,中剂量多糖可显著提高AA基因型鸡的胸腺、法氏囊指数及BC基因型鸡的胸腺指数(P<0.05);45日龄,中剂量复方多糖可显著提高AA基因型鸡的胸腺指数(P<0.05)。 各日龄高、中、低剂量复方多糖对BB基因型鸡的胸腺、脾脏、法氏囊指数均有提高的作用,但均无显著性差异(P>0.05)。表1
2.4 中药复方多糖对不同基因型蛋鸡血常规指标的影响
2.4.1 中药复方多糖对不同基因型蛋鸡白细胞的影响
研究表明,35日龄,AA基因型鸡低剂量和中剂量中药复方多糖组中白细胞总数与淋巴细胞数显著高于对照组(P<0.05),而中性粒细胞数高于对照组,但无显著性差异(P>0.05),BC基因型鸡中剂量和高剂量中药复方多糖组中白细胞总数与淋巴细胞数显著高于对照组(P<0.05),而中性粒细胞数高于对照组,但无显著性差异(P>0.05);49日龄,AA基因型鸡低剂量多糖组中白细胞总数和中性粒细胞显著高于对照组(P<0.05),中剂量中药复方多糖组中白细胞总数和淋巴细胞显著高于对照组(P<0.05),BC基因型鸡中剂量中药复方多糖组白细胞总数与淋巴细胞数显著高于对照组(P<0.05),高剂量中药复方多糖组淋巴细胞数显著高于对照组(P<0.05)。表2
2.4.2 中药复方多糖对不同基因型蛋鸡红细胞与血小板的影响
研究表明,与对照组相比,各剂量中药复方多糖对不同基因型蛋鸡血常规中红细胞数、血红蛋白有一定程度的提高,但均无显著性差异(P>0.05)。除49日龄,AA基因型鸡高剂量多糖组中血小板总数显著低于对照组外,21日龄、35日龄和49日龄,各基因型不同剂量多糖组与多对照组中血小板总数相比无显著性差异(P>0.05)。表3
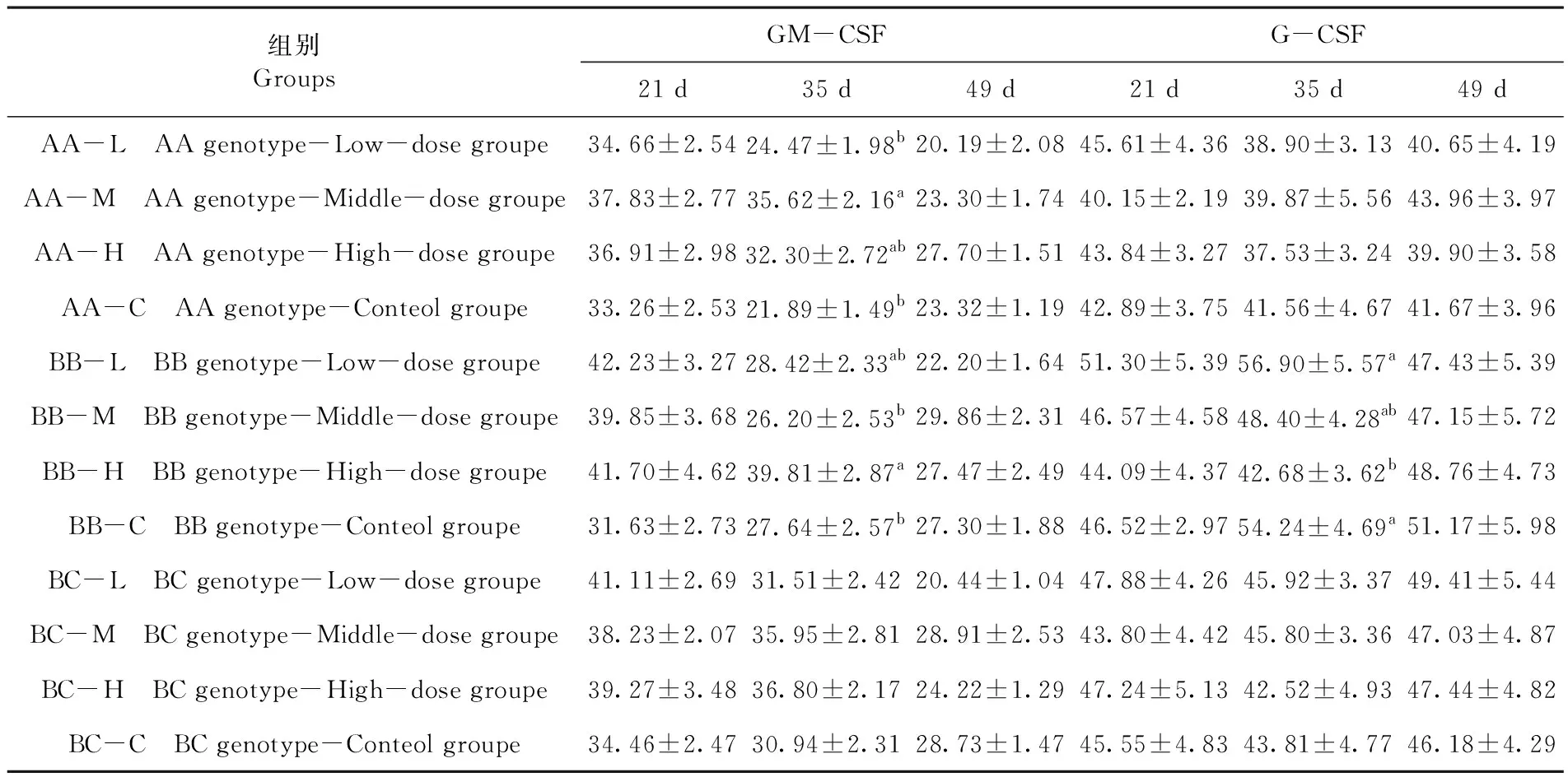
2.5 中药复方多糖对不同基因型蛋鸡血清的GM-CSF和G-CSF质量浓度的影响
研究表明,随着日龄的增加,不同基因型蛋鸡血清中GM-CSF的质量浓度呈递减的趋势,与对照组相比,21日龄时,各剂量中药复方多糖对不同基因型蛋鸡血清中GM-CSF的质量浓度均有一定提高,但无显著性差异(P>0.05);35日龄时,中剂量中药复方多糖可显著提高AA基因型蛋鸡血清中GM-CSF的质量浓度(P<0.05),高剂量中药复方多糖可显著提高BB基因型蛋鸡血清中GM-CSF的质量浓度(P<0.05)。G-CSF的质量浓度,除在35日龄时BB基因型高剂量多糖组蛋鸡血清中G-CSF的质量浓度显著低于BB基因型低剂量多糖组与空白对照组外(P<0.05),其余日龄各组间并无明显差异。表4


表4 不同基因型蛋鸡血清的GM-CSF和G-CSF质量浓度
Table 4 The mass concentrations of GM-CSF and G-CSF in serum of different genotypes of laying hens (pg/mL)
组别GroupsGM-CSFG-CSF21 d35 d49 d21 d35 d49 dAA-L AA genotype-Low-dose groupe34.66±2.5424.47±1.98b20.19±2.0845.61±4.3638.90±3.1340.65±4.19AA-M AA genotype-Middle-dose groupe37.83±2.7735.62±2.16a23.30±1.7440.15±2.1939.87±5.5643.96±3.97AA-H AA genotype-High-dose groupe36.91±2.9832.30±2.72ab27.70±1.5143.84±3.2737.53±3.2439.90±3.58AA-C AA genotype-Conteol groupe33.26±2.5321.89±1.49b23.32±1.1942.89±3.7541.56±4.6741.67±3.96BB-L BB genotype-Low-dose groupe42.23±3.2728.42±2.33ab22.20±1.6451.30±5.3956.90±5.57a47.43±5.39BB-M BB genotype-Middle-dose groupe39.85±3.6826.20±2.53b29.86±2.3146.57±4.5848.40±4.28ab47.15±5.72BB-H BB genotype-High-dose groupe41.70±4.6239.81±2.87a27.47±2.4944.09±4.3742.68±3.62b48.76±4.73BB-C BB genotype-Conteol groupe31.63±2.7327.64±2.57b27.30±1.8846.52±2.9754.24±4.69a51.17±5.98BC-L BC genotype-Low-dose groupe41.11±2.6931.51±2.4220.44±1.0447.88±4.2645.92±3.3749.41±5.44BC-M BC genotype-Middle-dose groupe38.23±2.0735.95±2.8128.91±2.5343.80±4.4245.80±3.3647.03±4.87BC-H BC genotype-High-dose groupe39.27±3.4836.80±2.1724.22±1.2947.24±5.1342.52±4.9347.44±4.82BC-C BC genotype-Conteol groupe34.46±2.4730.94±2.3128.73±1.4745.55±4.8343.81±4.7746.18±4.29
3 讨 论
胸腺是T淋巴细胞分化、发育、成熟的场所,它具有调节机体免疫功能和增强机体抗肿瘤、抗感染的能力。法氏囊为禽类特有的产生B淋巴细胞的中枢免疫器官,其功能与体液免疫相关。脾脏是机体最大的免疫器官,含有大量的T淋巴细胞、B淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心。免疫器官发育的水平直接影响机体的免疫调节功能和对疾病的抵抗力,免疫器官指数在一定程度上能反映免疫器官的发育水平,从而反映机体的免疫状态。有试验表明,中药多糖可以促进免疫器官的发育,提高动物的免疫器官指数。罗李媛[8]在给鸡饲喂川牛膝多糖后,发现胸腺、脾脏以及法氏囊脏器指数均有所提高,且以早期阶段使用川牛膝多糖提高鸡体的免疫功能的效果最为显著。石念进等[9]通过对黄芪多糖、复方多糖的比较发现,提取的复方中药多糖有促进雏鸡免疫器官发育的作用,且效果良好。研究结果显示,给予试验鸡中药复方多糖后的不同时间,高、中、低剂量中药复方多糖均能显著提高鸡胸腺、脾脏和法氏囊指数,并且中剂量和高剂量中药复方多糖组的免疫器官脏器指数均高于低剂量中药复方多糖组,中、高剂量多糖能够更有效促进免疫器官的生长发育与成熟,增强蛋鸡的细胞免疫与体液免疫,抵抗各种病原微生物感染的能力提高。
血常规检查是动物疾病诊断的重要辅助方法,同时也反映动物机体造血与免疫机能的状况。血细胞常分为白细胞、红细胞和血小板三大类,其分类计数结果可以反映动物机体的生理状态。白细胞是机体抵御病原微生物等异物入侵的主要防线,具有吞噬、产生抗体、传递免疫信息等功能,在正常生理状态下,白细胞总数反映机体的综合的免疫反应能力,其变化可以反映机体的抵抗力[10]。红细胞的主要功能是运输O2和CO2,且对酸、碱物质有缓冲作用,且主要依赖于红细胞内的血红蛋白来实现这些功能。血小板是由骨髓成熟的巨噬细胞胞浆裂解脱落下来的具有生物活性的小块胞质,在止血、伤口愈合、炎症反应等生理和病理过程中有重要保护作用[11]。聂健等[12]对免疫抑制小鼠给予当归补血汤处理后,可明显提高造模小鼠的白细胞、红细胞生成,提高血红蛋白含量,且对脾脏萎缩有明显的拮抗作用。王宏军等[13]研究表明,南五味子多糖粗品可提高雏鸡的胸腺、法氏囊、脾脏免疫器官指数,增加雏鸡外周血红细胞总数、白细胞总数及淋巴细胞、单核细胞含量,对机体发挥非特异性免疫起到积极的作用。试验结果显示,各基因型高、中、低剂量的中药复方多糖组的白细胞总数和淋巴细胞数均高于对照组,这进一步显示了该中药复方多糖能够提高机体的免疫能力。
GM-CSF是一种多潜能性细胞因子,在对骨髓造血细胞的调控和机体免疫调节中均发挥着重要作用[14]。G-CSF是粒细胞的重要调节因子,作用于骨髓粒系祖细胞,刺激造血干细胞的增殖、分化与成熟,增加外周血中性粒细胞的吞噬活性及趋化性,从而促进机体免疫力[15]。部分中药多糖能够调节GM-CSF、G-CSF的产生和分泌,从而具有增强造血机能、升高白细胞的作用[16]。田维毅等[17]研究发现黄芪、枸杞、地黄等3味中药多糖组分一定浓度组小鼠血清 GM-CSF较空白对照组显著升高,且具有浓度差异性。李兴玉等[18]用巴西蘑菇多糖诱导人脐血单核细胞,发现其可促进造血干、祖细胞生成和人脐血单核细胞 GM-CFS 基因的表达。严善福等[19]增加牛膝多糖浓度可提高对粒系造血干细胞的动员作用,其与G-CSF具有协同加强作用,共同促进粒系造血干细胞增殖分化。试验结果显示,各剂量中药复方多糖有提高不同基因型蛋鸡血清中GM-CSF质量浓度的影响,与田维毅等研究相似。
MHC是一个与机体的免疫应答和抗病性密切相关的多基因家族,不同个体间由于MHC基因的多样性而导致免疫功能存在个体或品种上的差异。李福传等[20]通过对3个地方品种的不同类型免疫滴度等免疫性状的测定及与基因变异的关联分析,表明不同免疫能力存在个体甚至品种水平上的遗传差异,且不同免疫性状存在显著的优势基因型。吴春梅等[21]研究发现北京油鸡MHC B-F区基因的Exon 2 多态性高于来航蛋鸡,且其异嗜性粒细胞数、H/L 显著低于来航蛋鸡,而白细胞总数、淋巴细胞数显著高于来航蛋鸡,产生免疫反应比来航蛋鸡快。在试验的空白组中,AA基因型和BB基因型蛋鸡的胸腺指数、白细胞总数、淋巴细胞数及血小板总数明显高于BC基因型,表明AA基因型和BB基因型蛋鸡的细胞免疫优于BC基因型,但具体情况还需要进一步验证。目前已有多种多糖被证实可作为T细胞依赖性抗原,由MHC II类分子处理与呈递而被TCR分子识别。Cobb B. A等研究发现多糖能够以糖蛋白、糖连接或通过胞吞途径被NO系统降解为小分子量碳水化合物的方式,被MHC classⅡ类分子处理与呈递而被TCR分子识别,进而活化T细胞诱导一定的免疫反应[4,22]。在试验的中药复方多糖组中,高、中、低剂量多糖对不同基因型蛋鸡免疫器官、血常规部分指标及GM-CSF质量浓度均有一定影响,但各剂量多糖对各基因型同一指标的影响并不相同,这可能与不同MHC B-Lβ II基因型鸡机体的免疫系统对中药多糖类外来抗原的敏感度及递呈能力不同有关。MHC II基因多态性的存在可能会影响细胞上MHC II类分子的抗原结合槽结构发生改变,使得MHC 等位基因编码分子和多糖的糖蛋白、糖连接及小分子量碳水化合物的结合产生一定的选择性,而这一选择性可能导致不同MHC B-Lβ II基因型个体对同一抗原的免疫应答有所差异,进而导致各剂量多糖对各基因型同一指标影响的差异[23]。
4 结 论
MHC B-Lβ II基因的多态性使蛋鸡的免疫能力存有个体差异,通过高、中、低三个剂量中药复方多糖对不同MHC B-Lβ II基因型京红1号蛋鸡免疫器官指数及血常规部分指标影响的比较分析,初步说明连续肌注7 d不同剂量的中药复方多糖可以不同程度提高各基因型组蛋鸡免疫器官指数、部分血常规指数及GM-CSF质量浓度,且整体上以高、中剂量中药复方多糖免疫效果更好。
参考文献(References)
[1] 徐小芳, 罗燕, 赵民, 等.中药复方多糖对鸡抗氧化功能的影响[J].中国农业科学, 2009, 42(3):706-713.
XU Xiao-fang, LUO Yan, ZHAO Min, et al. (2009). Effects of traditional Chinese medicine compound polysaccharides on anti-oxidation function of chicks [J].ScientiaAgriculturaSinica, 42(3):706-713. (in Chinese)
[2] 刘师旗, 陈家磊, 冯君, 等. 车前草多糖对雏鸡血液生理生化指标和免疫器官发育的影响[J]. 四川畜牧兽医, 2014, 41(5): 23-25.
LIU Shi-qi, CHEN Jia-lei, FENG Jun, et al. (2014). The effect of plantain polysaccharide on blood physiological index, seroenzyme activity and immune organ in chicken [J].SichuanAnimal&VeterinarySciences, 41(5): 23-25. (in Chinese)
[3] 章世元, 徐春燕, 董晓芳, 等. 苜蓿多糖和黄芪多糖对肉仔鸡淋巴细胞增殖的影响[J]. 动物营养学报, 2010, 22(3): 670-674.
ZHANG Shi-yuan, XU Chun-yan, DONG Xiao-fang, et al. (2010). Effects of water soluble alfalfa and astragalus polysaccharide on proliferation of lymphocyte in broilers [J].ChineseJournalofAnimalNutrition, 22(3): 670-674. (in Chinese)
[4] Cobb, B. A., Wang, Q., Tzianabos, A. O., & Kasper, D. L. (2004). Polysaccharide processing and presentation by the mhcii pathway.Cell,117(5): 677-687.
[5] 罗 燕, 谷新利, 赵宗胜, 等.中药复方多糖及其各单味中药多糖对小鼠淋巴细胞增殖的影响[J]. 黑龙江畜牧兽医, 2008, (2):89-90.
LUO Yan, GU Xin-li, ZHAO Zong-sheng, et al. (2008). Effect of polysaccharide of compound Chinese medicine and its single flavored Chinese medicine polysaccharides on lymphocyte proliferation in mice [J].HeilongjiangAnimalScienceandVeterinaryMedicine, (2):89-90. (in Chinese)
[6] Shanaz, S. S., Joshi, C. G., Jhala, M. K., Rank, D. N., Khanna, K., & Barot, V. N., et al. (2005). Molecular characterization of b-lβ ii family (class ii mhc) alleles in three strains of poultry and its association with immune response.IndianJournalofPoultryScience, 40(1):1-8.
[7] 朱晓庆, 谷新利, 乔海博.主要组织相容性复合体(MHC)B-L βII基因Hin II 位点多态性对鸡免疫功能的影响[J].农业生物技术学报, 2013,21(5):570-578.
ZHU Xiao-qing, GU Xin-li, QIAO Hai-bo. (2013). The effects of chicken major histocompatibility complex (MHC) B-LβⅡgene hin1Ⅰlocus polymorphism on immune function [J].JournalofAgriculturalBiotechnology, 21(5): 570-578. (in Chinese)
[8] 罗李媛. 川牛膝多糖的提取工艺及其对肉鸡免疫调节作用的研究[D]. 成都: 四川农业大学硕士学位论文, 2008.
LUO Li-yuan. (2008).Studiesontheteehnologyofextraetionandtheimmunomodulationeffeetoftheachyranthesbidentatapolysaccharidesinchicken[D]. Master Dissertation. Sichuan Agricultural University, Chengdou. (in Chinese)
[9] 石念进, 王希春, 吴金节, 等. 中药复方多糖对雏鸡生长性能及免疫功能的影响[J].中国家禽, 2013, 35(1):20-24.
SHI Nian-jin, WANG Xi-chun, WU Jin-jie, et al. (2013). Effects of Chinese herbal medicine compound polysaccharide on growth performance and immune function in chicken [J].ChinaPoultry, 35(1):20-24. (in Chinese)
[10] Broxmeyer, H. E. (2001). Regulation of hematopoiesis by chemokine family members.InternationalJournalofHematology, 74(1):9-17.
[11] Huang, Y., Jiang, C., Hu, Y., Zhao, X., Shi, C., & Yu, Y., et al. (2013). Immunoenhancement effect of rehmannia glutinosa polysaccharide on lymphocyte proliferation and dendritic cell.CarbohydrPolym, 96(2): 516-521.
[12] 聂 健, 詹素琼, 梁歌, 等. 当归补血汤对小鼠造血功能和生长性能的影响[J].四川畜牧兽医, 2013, (1):30-31, 34.
NIE Jian, ZHAN Su-qiong, LIANG Ge, et al. (2013). Effect of dangguibuxuetang on the hematopoiesis and growth performance in mice [J].SichuanAnimal&VeterinaryMedicine, (1):30-31,34. (in Chinese)
[13] 王宏军.南五味子多糖提取及其对雏鸡免疫活性的研究[D].长春:吉林大学硕士学位论文, 2011.
WANG Hong-jun. (2011).ExtractionofpolysaccharidesfromKadsuramarmorataanditsimmunomodulatoryeffectsonchicken[D]. Master Dissertation. Jilin University, Changchun. (in Chinese)
[14] 孜比尔尼萨·哈迪尔, 张富春. GM-CSF增强免疫调节作用的研究进展[J]. 疾病预防控制通报, 2016, 26(6):76-78.
Zibiernisa Hadier. ZHANG Fu-chun. (2016). Research progress on enhanced immunomodulatory effect of GM-CSF [J].EndemicDiseasesBulletin(China) , 26(6):76-78. (in Chinese)
[15] Akbarzadeh, S., & Layton, J. (2001). Granulocyte colony-stimulating factor receptor: structure and function.Vitamins&Hormones, 63(1):159-194.
[16] 郭乃丽, 苗明三. 大枣多糖对气血双虚模型小鼠全血细胞和血清粒-巨噬细胞集落刺激因子水平的影响[J]. 中国临床康复, 2006, 10(15):146-147,150.
GUO Nai-li, MIAO Ming-shan. (2006). Effect of jujube polusaccharide on levels of colony stimulating factor in global blood cells and serum macrophage of model mice with bothqiand blood deficiency[J].ChinesejournalofClinicalRehabilitation, 10(15):146-147,150. (in Chinese)
[17] 田维毅, 葛金文, 陈育,等. 九种中药多糖组分对小鼠血清集落刺激因子水平的影响[J]. 时珍国医国药, 2015, 26(2):328-329.
TIAN Wei-yi, GE Jin-wen, CHEN Yu, et al. (2015). Effect of nine traditional Chinese medicine polysaccharides on the level of serum colony stimulating factor in mice [J].LishizhenMedicineandMateriaMedicalResearch, 26(2):328-329. (in Chinese)
[18] 李兴玉, 袁丽铭, 吴镔, 等.国产巴西蘑菇多糖诱导细胞刺激因子基因表达的研究[J]. 食用菌学报, 2005, 12(2):1-8.
LI Xing-yu, YUAN Li-ming, WU Bin, et al. (2005).Studies on the expression of cytokine genes induced by agaricus blazei polysaccharide [J].ActaEdulisFungi, 12(2):1-8. (in Chinese)
[19] 严善福, 陶 箭, 叶裕春. 牛膝多糖促进骨髓细胞粒细胞集落形成[J]. 上海第二医科大学学报, 2003, (23):38-39.
YAN Shan-fu, TAO Jian, YE Yu-chun. (2003). Achyranthes-piaentata polysaccharides promotes the clone formation of granulocytes from bone marrow cells [J].ActaUniversitatisMedicinalisSecondaeShanghai, (23): 38-39. (in Chinese)
[20] 李福伟, 李淑青, 逯岩, 等. 三个地方鸡种 MHC B-L BII 基因遗传变异与免疫性状的关联分析[J]. 生物工程学报, 2013, 29(7): 904-913.
LI Fu-wei, LI Shu-qing, LU Yan, et al. (2013). Relations among immune traits and MHC B-LBII gene in three local chicken breeds [J].ChineseJournalofBiotechnology, 29(7): 904-913. (in Chinese)
[21] 吴春梅. 鸡 MHC B-F 区基因 SNPs 分子标记与免疫性状关系的研究[D]. 扬州: 扬州大学硕士学位论文, 2007.
WU Chun-mei. (2007).StudyontheRelationshipbetweenSNPsmolecularmarkerandimmunetraitsinchickenMHCB-Fregion[D]. Master Dissertation. Yangzhou University, Yangzhou. (in Chinese)
[22] Cobb, B. A., & Kasper, D. L. (2005). Coming of age: carbohydrates and immunity.EuropeanJournalofImmunology, 35(2): 352-356.
[23] 朱晓庆, 李效振, 乔海博, 等.11味中药多糖提取物对不同MHC B-LβII基因型鸡新城疫抗体水平和IFN-γ、IL-4含量的影响[J]. 畜牧兽医学报, 2013, 44(10):1 685-1 692.
ZHU Xiao-qing, LI Xiao-zhen, QIAO Hai-bo, et al. (2013). Effects of polysaccharide extracted from 11 kinds of traditional Chinese medicines on ND antibody level and IFN-γ, IL-4 contents in different MHC B-LβⅡgenotype chickens [J].ChineseJournalofAnimalandVeterinarySciences, 44(10):1,685-1,692. (in Chinese)

