67例慢性肾功能不全患者行经腹全子宫切除术的临床分析
褚达明,欧阳玲
(中国医科大学附属盛京医院妇产科,沈阳 110004)
慢性肾功能不全 (chronic renal insufficiency,CRI) 是由各种慢性肾脏疾病引起的一种综合征,表现为肾小球滤过率下降、代谢产物潴留,水、电解质及酸碱代谢失衡及其他相应临床症状[1]。CRI严重威胁人类健康,10年生存率约为35%~55%,占人类死亡主要原因中的第5~9位。据统计,近30多年来患有慢性肾脏疾病的人数处于上升态势,故罹患CRI的人数也在逐年增加。目前我国CRI的患病率约为568/100万[2]。在妇科住院行手术治疗的女性患者中,常可见到合并CRI者。因为此病常累及全身多个系统,导致相应的临床症状,故理论上手术风险较大。本研究通过对比分析同期行经腹全子宫切除术的CRI患者与肾功正常患者的临床资料,探讨CRI患者行手术治疗的安全性及可行性。
1 材料与方法
1.1 研究对象
选择2003年5月至2016年12月于中国医科大学附属盛京医院妇科住院行经腹全子宫切除术同时合并CRI的患者67例,其内生肌酐清除率 (creatinine clearance rate,Ccr) 均<50 mL/min。依据美国肾脏基金会 2003 年制定的慢性肾脏病 (chronic kidney disease,CKD) 临床实践指南[3](kidney disease outcome quality initiative,K/DOQI) 分期分为CKD3期组 (Ccr在20~<50 mL/min) 28例,CKD4期组 (Ccr在10~<20 mL/min) 23例,CKD5期组 (Ccr<10 mL/min) 16例。以同期患相同或相似妇科疾病行经腹全子宫切除术肾功正常30例患者作为对照组。
纳入标准: (1) 子宫肌瘤或腺肌病致子宫增大,如孕8~12周大小; (2) 有慢性肾脏疾病或累及肾脏的系统疾病病史,Ccr<50 mL/min; (3) 无生育要求,要求切除子宫; (4) 术前行宫颈细胞学检查及超声等,排除宫颈及宫体恶性肿瘤。
排除标准: (1) 怀疑恶性肿瘤患者; (2) 急性肾功能不全者; (3) 未行经腹全子宫切除者; (4) 非CKD3~5期者; (5) 严重内、外科疾病不能耐受经腹手术者。
1.2 研究内容
收集资料包括手术相关指标:手术时间、术中出血量;术后住院恢复期间相关指标:术后发热天数(术后日内连续2次间隔6 h以上的体温≥37.5 ℃) 、术后48 h引流量、引流管拔除时间、手术前后肾功变化情况 (Δ血肌酐、Δ尿素、ΔCcr,即术后2 d与术前1 d的差值) 、手术前后血红蛋白变化情况 (Δ血红蛋白,术前血红蛋白与术后2 d血红蛋白的差值) 、术后住院时间、术后并发症,对4组患者的各项指标进行对比分析。
1.3 治疗经过
CKD组患者围术期接受常规基础治疗,低脂、低盐、低蛋白饮食,保持血压平稳,纠正贫血,防治高钾血症。CKD5期患者围术期常规血液透析治疗,病情控制稳定后给予手术。
术前与患者及家属充分沟通,做到知情选择。术前30 min给予抗生素预防感染,选择全身麻醉,取下腹正中脐耻间纵切口,2把大弯钳钳夹双侧宫角,上提子宫,钳夹、切断、缝扎双侧子宫圆韧带、输卵管峡部及卵巢固有韧带,打开阔韧带前后叶及子宫膀胱返折腹膜,下推膀胱,钳夹、切断、缝扎双侧子宫血管及主韧带,电刀环切穹隆部阴道壁,切除子宫。可吸收线连续锁边缝合阴道断端。包埋盆底腹膜。术毕留置腹腔引流管1枚。
术后4组患者均给予抗生素5 d预防感染。CKD组患者术后严格限制液体输入量,选用无肾毒性或肾毒性较低的抗菌药物预防感染。密切观察患者生命体征,观察腹腔引流量,术后48 h如24 h引流量<20 mL,且无发热,则予拔除腹腔引流管。
1.4 统计学分析
应用SPSS 23.0软件进行统计分析,计量资料符合正态分布的连续型变量,以±s表示,单因素方差分析检验各组间差异性,多组均数间两两比较采用SNK检验;计数资料以例数(%) 表示,各组间比较采用χ2检验,如不满足条件,则选用Fisher确切概率法。P> 0.05为差异有统计学意义。
2 结果
2.1 一般情况
CKD组和对照组患者在平均年龄、体质量指数 (body mass index,BMI) 、妊娠和分娩次数、子宫体积、合并症、既往其他腹部手术史等方面比较均无统计学差异 (P> 0.05) ,见表1。其中既往腹部手术史主要为剖宫产手术。合并症主要包括贫血、高血压、糖尿病、心肌缺血等疾病,术前请相关科室会诊,积极治疗。
2.2 手术原因
4组患者行子宫切除术的病因构成无统计学差异 (χ2=1.451,P = 0.967) ,见表2。
2.3 术中情况
在手术时间方面,CKD5期组>其他3组,差异有统计学意义 (P = 0.001) ,其他3组比较无统计学差异 (P> 0.05) ;在术中出血量方面,CKD5期组>其他3组,差异有统计学意义 (P> 0.001) ,其他3组比较无统计学差异 (P> 0.05) 。4组患者均顺利地进行了手术,术中均未发生副损伤,见表3。
2.4 术后情况
在术后48 h引流量、引流管拔除时间、手术前后血红蛋白变化情况、术后住院时间方面,CKD5期组均>其他3组,差异有统计学意义 (P> 0.05) ,其他3组比较无统计学差异 (P> 0.05) ;在术后发热天数,手术前后肾功变化情况方面,4组之间比较无统计学差异 (P> 0.05) ,见表4。
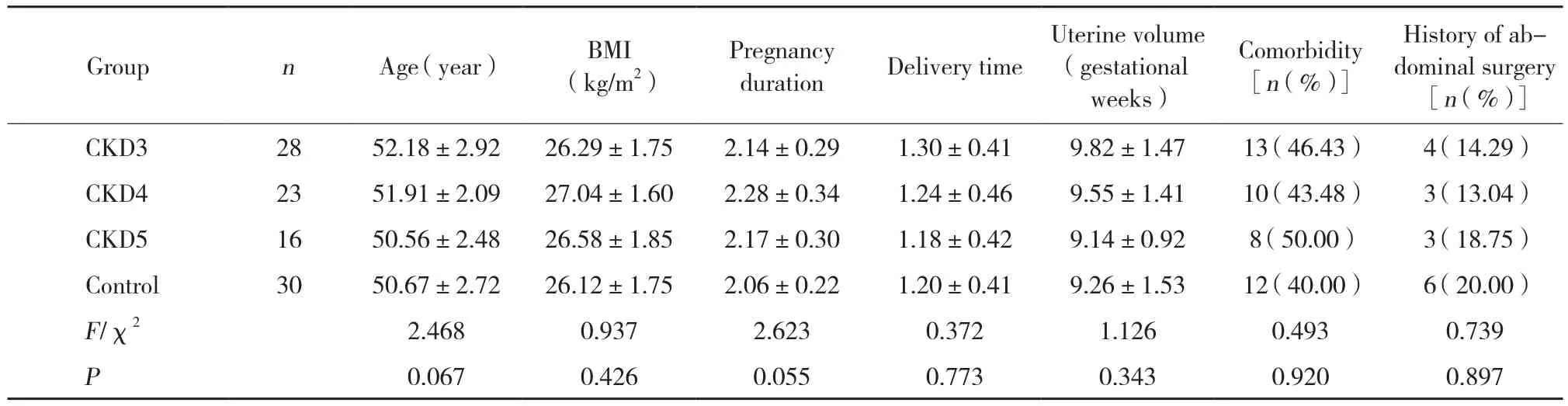
表1 4组患者一般情况比较Tab.1 General characteristics of the patients in four groups
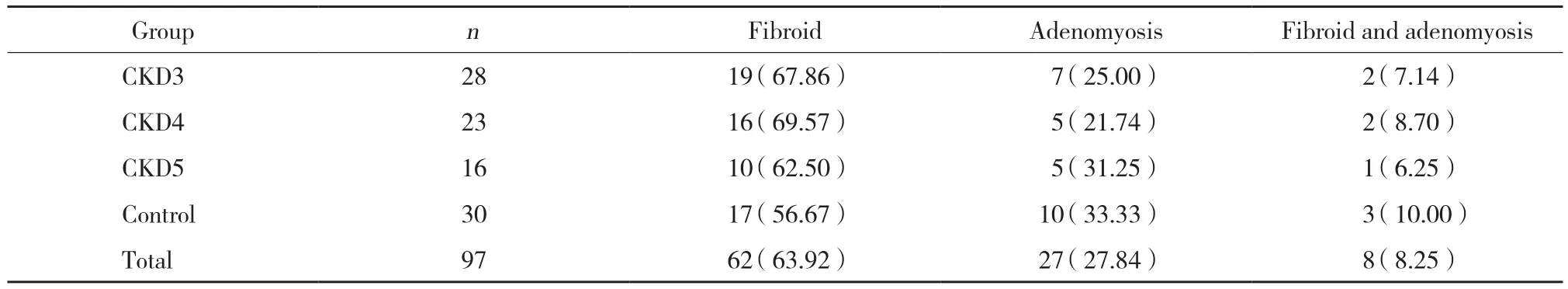
表2 4组患者手术原因比较 [n (%) ]Tab.2 Operative indications in the four groups [ n (%) ]
表3 4组患者术中情况比较 (±s)Tab.3 Intraoperative results in the four groups (±s)
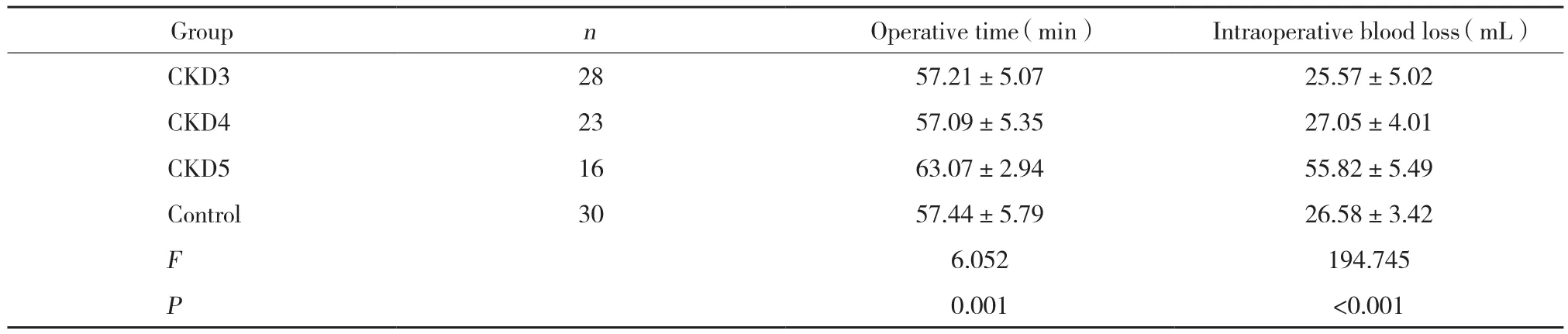
表3 4组患者术中情况比较 (±s)Tab.3 Intraoperative results in the four groups (±s)
GroupnOperative time (min)Intraoperative blood loss (mL)CKD3 28 57.21±5.07 25.57±5.02 CKD4 23 57.09±5.35 27.05±4.01 CKD5 16 63.07±2.94 55.82±5.49 Control 30 57.44±5.79 26.58±3.42 F 6.052 194.745 P 0.001 <0.001
表4 4组患者术后情况比较 (±s)Tab.4 Postoperative data in the four groups (±s)
Scr,serum creatinine;Ccr,creatinine clearance rate;HB,hemoglobin.
Postoperative data CKD3 group(n = 28)CKD4 group(n = 23)CKD5 group(n = 16)Control group(n = 30) F P Postoperative fever (d) 0.22±0.38 0.23±0.36 0.26±0.42 0.25±0.271.6160.191 Amount of postoperative total peritoneal drainage at 48 h after operation (mL)126.73±28.81131.26±25.86259.91±28.06123.80±19.71121.924<0.001 Time to drainage tube removal (h)72.84±4.5771.69±4.3497.44±4.4770.55±4.35150.703<0.001 ΔScr (μmol/L) 1.96±8.26 1.34±7.51 6.03±6.52 1.46±6.641.6650.180 ΔUrea (mmol/L) 0.20±6.04 1.94±5.26 4.01±4.88 1.40±3.251.8950.136 ΔCcr (mL/min) 0.48±1.25 0.76±1.30 1.19±1.68 0.55±1.101.1770.323 ΔHB (g/L)15.08±6.6118.39±5.0024.15±7.6715.78±5.308.837<0.001 Postoperative hospital stay (d) 5.11±0.26 5.14±0.24 7.18±0.25 5.14±0.25189.796<0.001 Postoperative complications [n (%)]0(0.0)2(8.6)7(43.8)0(0.0)20.064<0.001
在术后并发症方面,CKD5期组有5例发生切口脂肪液化 (31.25%) ,有2例发生术后出血 (24 h引流量>300 mL,12.50%) ,CKD4期组有2例发生切口脂肪液化 (8.70%) 。CKD5期组并发症发生率高于对照组和CKD3期组,差异有统计学意义 (P> 0.001) ,与CKD4期组比较无统计学差异 (P = 0.019) ,其他3组并发症发生率比较无统计学差异 (P> 0.1) 。所有患者经治疗后均康复。
2.5 出院随访
出院后全部随访,随访至2017年4月,所有患者预后良好,无任何术后并发症发生。
3 讨论
肾脏是人体重要的排泄器官和内分泌器官,一旦出现异常,常累及全身多个系统,严重影响患者的生活质量。中国最新CKD流行病学调查显示,我国CKD患病率已高达10.8%,这意味着患病人口达1.195亿之众[4]。在妇科住院的女性患者中不乏合并CRI者。这类患者多合并子宫肌瘤或腺肌病导致异常子宫出血。因多于40%的CRI患者合并肾性贫血[5],对失血的耐受力差,且CRI可加重子宫出血,患者常因中重度贫血而反复输血,药物治疗效果差,最终不得不手术切除子宫以解决出血。因CRI患者多合并高血压、贫血、心肌缺血等,对失血耐受力差,容易发生心血管事件,故手术风险较大,常将其列为妇科手术的相对禁忌,但临床上缺乏相关研究证实。随着妇科患者中合并CRI的人数逐渐增多,对此类患者实施手术治疗成为妇科医生不得不面临的一个问题。
本研究将CRI患者按照Ccr分为3组,在同等条件下对CRI患者和肾功正常患者实施经腹全子宫切除术,对比分析4组围术期各项指标,以探讨CRI患者行经腹全子宫切除术的安全性及可行性。结果显示,在手术时间、术中出血量、术后48 h引流量、引流管拔除时间、手术前后血红蛋白变化情况、术后住院时间方面,除CKD5期组均高于其他各组外,其他3组间比较无统计学差异。所有患者均成功地实施了手术,术中均无并发症发生;在术后发热天数,手术前后肾功变化方面,各组间比较无统计学差异。在术后并发症方面,CRI患者的主要并发症是术后出血和切口脂肪液化,CKD4期组和CKD5期组并发症发生率无统计学差异,CKD5期组发生率高于CKD3期组和对照组,差异有统计学意义,其他3组发生率比较无统计学差异。这说明对于未进展到CKD5期即尿毒症期的CRI患者,围术期在积极治疗原发病、纠正贫血等对症治疗的基础上,实施经腹全子宫切除术是安全可行的,且对于各期CRI患者,在围术期积极治疗原发病、控制好现有并发症的基础上,与肾功能正常的患者相比,手术本身可能并不增加感染及肾功能异常的风险;但对于已进展到尿毒症期的患者,开腹手术切除子宫风险相对较大,此类患者因组织水肿糟脆,术后出血、切口愈合不良等并发症发生的风险增加,而失血导致的贫血加重又可加速肾脏疾病的进展,同时也增加了心血管事件等并发症的发生风险[6]。故对于尿毒症期患者实施手术,术前应充分评估患者病情,向患者及家属充分交待手术风险,权衡利弊,如确有手术必要,围术期除做好防治相关并发症的准备外,应该常规透析,待病情稳定,现有并发症控制良好后,再行手术,以确保患者围术期安全。
[1]葛均波,徐永健. 内科学[M]. 北京:人民卫生出版社,2013:524.
[2]叶任高,李幼姬,刘冠贤. 临床肾脏病学[M]. 北京:人民卫生出版社,2007:589.
[3]LEVEY AS,CORESH J,BALK E,et al. National kidney foundation practice guidelines for chronic kidney disease:evaluation,classification,and stratification [J]. Ann Intern Med,2003,139 (2) :137-147.
[4]ZHANG L,WANG F,WANG L,et al. Prevalence of chronic kidney disease in China:a cross-sectional survey [J]. Lancet,2012,379(9818) :815-822. DOI:10.1016/S0140-6736 (12) 60033-6.
[5]AGARWAL AK. Practical approach to the diagnosis and treatment of anemia associated with CKD in elderly [J]. J Am Med Dir Assoc,2006,7 (9 Suppl) :S7-S12,S17-21.
[6]PORTOLES J,GORRIZ JL,RUBIO E,et al. The development of anemia is associated to poor prognosis in NKF/KDOQI stage 3 chronic kidney disease [J]. BMC Nephrol,2013,14 (1) :2. DOI:10.1186/1471-2369-14-2.

