长链非编码RNA SNHG6在结肠癌中的表达及其生物学意义
黎丰华,古国财,庄雄标,吴印爱,刘献棠,王志伟
(广州军区广州总医院157分院普通外科,广州 510515)
结肠癌是人类主要恶性肿瘤之一,其发病率和病死率分别位于第3位和第4位。每年约有120万新确诊的结肠癌患者,并且有超过60万例患者死于结肠癌[1]。肿瘤转移与肿瘤患者的预后直接相关,当结肠癌确诊时,已经有20%~40%患者发生远处转移,目前结肠癌外科手术治疗的5年生存率在50%左右[2-3]。因此,分析结肠癌的生物学特性,探索其复发转移机制是临床研究关注的问题。核仁小分子RNA宿主基因(SNHG)是一类对恶性肿瘤具有重要生物学调控作用的长链非编码RNA(lncRNAs)[4-7]。既往研究报道SNHG6在肝细胞癌中表达明显上调,并提示肿瘤患者的高复发可能性[8]。然而,目前尚缺少SNHG6对结肠癌生物学作用影响的报道,本文将探究SNHG6在结肠癌组织中的表达特点,及其对结肠癌细胞增殖、迁移及侵袭能力的影响。
1 资料与方法
1.1细胞与组织来源 试验所用结肠癌组织和相应癌旁组织(距癌灶边缘至少2 cm)均为离体30 min内转移至-80 ℃冰箱保存的新鲜标本,取自2014年1月至2015年10月在本院行根治性手术治疗的25例结肠癌患者,所有患者术后均经病理学检查确诊,术前未行放化疗等抗肿瘤治疗。LoVo结肠癌细胞购自中国科学院上海细胞库。
1.2仪器与试剂 RNA提取试剂盒、反转录试剂盒和荧光定量PCR试剂盒(日本Takara公司),荧光定量PCR引物序列(上海生工公司),DMEM高糖培养基、胎牛血清、胰蛋白酶(美国HyClone公司),Lipofectamine 2000转染试剂(美国Invitrogen公司),SNHG6-siRNA干扰序列(广州锐博公司),CCK-8(cell counting kit 8)细胞增殖检测试剂盒(上海碧云天公司),Matrigel基质胶和Transwell培养板(美国Conirng公司),上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Snail和β-actin兔抗人多克隆抗体(美国Abclonal公司)。CO2培养箱(美国Thermo Fisher公司),倒置显微镜(日本Nikon公司),实时荧光定量PCR检测系统(美国ABI公司),蛋白质印迹法(Western blot)检测系统(美国Bio-rad公司)。
1.3方法
1.3.1LoVo细胞培养、转染和分组 LoVo细胞使用含10%胎牛血清的DMEM培养基,置于37 ℃ 5%CO2培养箱中培养。为探讨敲低SNHG6表达对LoVo细胞增殖、迁移及侵袭能力的影响,取对数生长期细胞按照Lipofectamine 2000说明书进行细胞转染处理,分为4组:空白组(Blank组,不加任何处理),阴性对照组(NC组;5 μL Lipofectamine 2000+50 pmol NC-siRNA),第1干扰组(siRNA-1组,5 μL Lipofectamine 2000+50 pmol SHNG6-siRNA-1)及第2干扰组(siRNA-2组,5 μL Lipofectamine 2000+50 pmol SHNG6-siRNA-2)。4组分别处理48或72 h后进行下一步实验。
1.3.2结肠癌组织和LoVo细胞SNHG6及细胞上皮-间质转化(EMT)标志物mRNA表达水平的检测 Trizol法提取组织或者细胞总RNA,按照反转录试剂盒说明书将总RNA反转录成cDNA,再以cDNA为模板按照SYBR Green Ⅰ法进行目的基因的荧光定量PCR反应。SNHG6引物:上游5′-ATA CTT CTG CTT CGT TAC CT-3′,下游5′-CTC ATT TTC ATC ATT TGC T-3′;EMT标志物能够反映细胞的EMT进程,主要包括上皮细胞标志物E-cadherin、间质细胞标志物N-cadherin和Vimentin,以及抑制上皮细胞特性的转录因子Snail。各目的基因引物序列见表1,采用2-ΔΔCT法表示目的基因的相对表达水平,以β-actin作为内参。

表1 EMT标志物的引物序列
1.3.3LoVo细胞增殖能力的检测 采用CCK-8法,收集处理24 h后的细胞接种于96孔板,接种密度为1 000个/孔,培养体系为100 μL,继续常规培养,分别取0、24、48、72 h等培养时间点,加入10 μL CCK-8试剂,培养箱孵育2 h后,450 nm波长下测定光密度值(OD值),绘制细胞生长曲线。
1.3.4LoVo细胞迁移和侵袭能力的检测 采用Tranwell法检测,收集处理48 h后的细胞,将不含胎牛血清的DMEM培养基重悬细胞接种于Transwell培养板上室,接种密度为5×104个/孔,培养体系为200 μL,下室加入500 μL含10%胎牛血清的DMEM培养基,常规培养24 h后取出上室,以4%多聚甲醛固定细胞20 min,0.5%结晶紫染色25 min,以棉签擦去上室内侧细胞,充分洗涤,干燥后倒置显微镜下随机选择5个高倍视野进行观察,统计穿膜细胞数。迁移实验和侵袭实验方法基本一样,后者所使用小室经10% Matrigel基质胶包被处理。
1.3.5LoVo细胞EMT标志物表达水平的检测 采用Western blot检测,收集处理72 h后的细胞,提取细胞总蛋白,采用二喹啉甲酸(BCA)法进行蛋白定量,取30 μg样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后转移到聚偏氟乙烯(PVDF)膜,5%脱脂奶粉室温封闭1 h,E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、Snail(1∶1 000)及β-actin(1∶2 000)等一抗4 ℃孵育过夜,PBST漂洗3次,辣根过氧化物酶(HRP)标记兔二抗(1∶15 000)室温孵育1 h,PBST漂洗3次,电化学发光法(ECL)显色并采集图像。
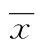
2 结 果
2.1结肠癌组织和癌旁组织中SNHG6 mRNA表达水平比较 荧光定量PCR结果显示,结肠癌组织SNHG6 mRNA相对表达水平2.37(0.93,3.66)高于癌旁组织1.5(1.00,2.00),差异有统计学意义(U=138.0,P=0.000 7),见图1。

注:**P<0.01,与癌旁组织比较
图1结肠癌组织和癌旁组织SNHG6水平比较
2.2SNHG6-siRNA对LoVo细胞SNHG6 mRNA表达水平的影响 LoVo细胞转染siRNA后,Blank组SNHG6 mRNA相对表达水平为(0.94±0.05),NC组为(1.03±0.07),siRNA-1组为(0.24±0.07),siRNA-2组为(0.34±0.14),组间比较差异有统计学意义(F=63.04,P=0.000);进一步两两比较,siRNA-1组、siRNA-2组SNHG6 mRNA相对表达水平较Blank组明显下调,差异有统计学意义(P<0.05),SNHG6低表达细胞模型构建成功,满足下一步功能实验需要,见图2。
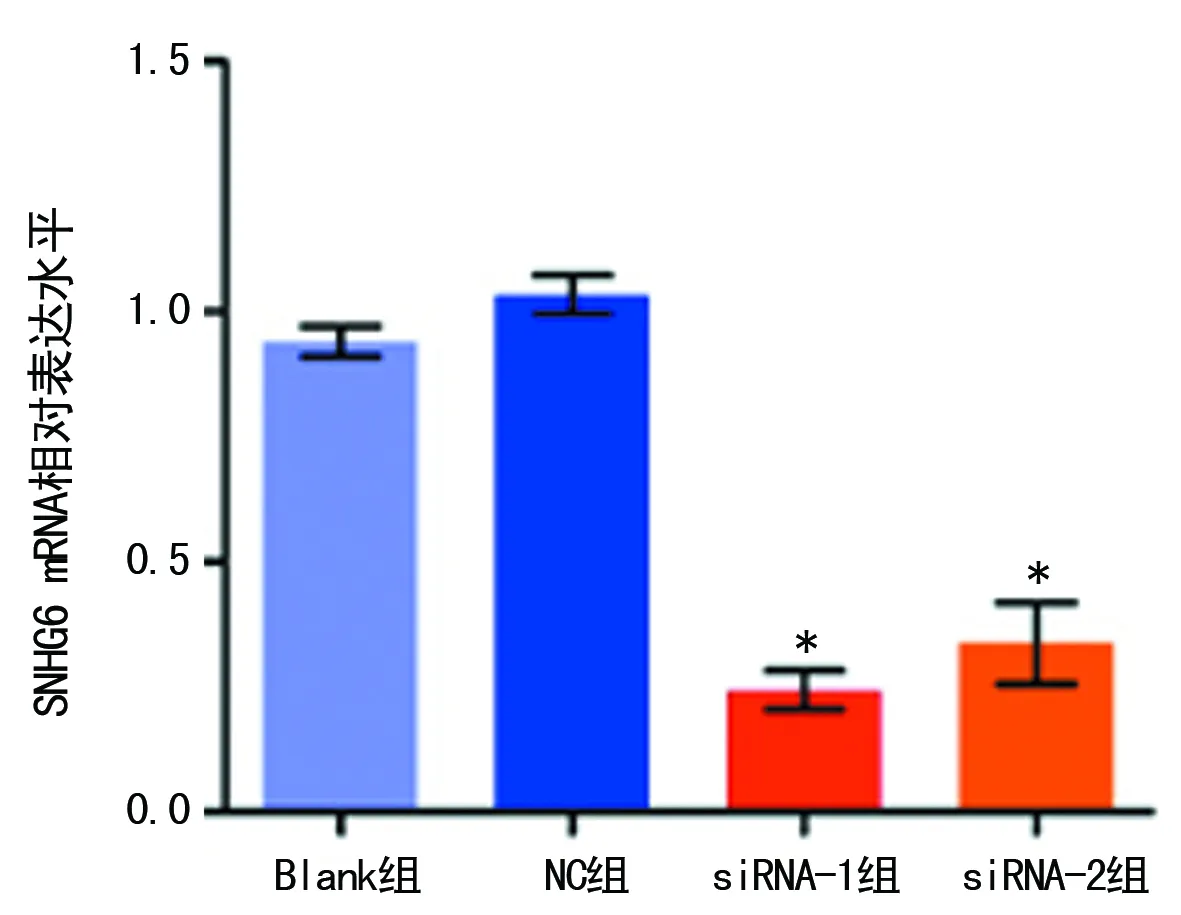
注:**P<0.05,与Blank组比较
图2 4组LoVo细胞SNHG6相对表达水平比较
2.3敲低SNHG6表达对LoVo细胞增殖能力的影响 LoVo细胞转染siRNA 后,4组细胞培养24、48、72 h后的增殖活性比较,差异有统计学意义(F=18.6、160.3、32.7,P=0.000),见表2;进一步两两比较,siRNA-1组、siRNA-2组细胞的增殖活性较Blank组明显下降,差异有统计学意义(P<0.05)。
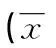
表2 4组细胞的增殖活性比较±s)
注:**P<0.05,与Blank组比较
2.4敲低SNHG6表达对LoVo细胞的迁移和侵袭能力的影响 LoVo细胞转染siRNA 后,Transwell迁移实验显示,Blank组穿膜细胞数为(148.6±10.9)个,NC组为(150.2±11.9)个,siRNA-1组为(53.0±14.1)个,siRNA-2组为(35.4±20.5)个,组间比较差异有统计学意义(F=85.38,P=0.000);进一步两两比较,siRNA-1组、siRNA-2组细胞发生迁移的数量较Blank组明显减少,差异有统计学意义(P<0.05)。Tranwell侵袭实验显示,Blank组穿膜细胞数为(126.8±6.9)个,NC组为(139.6±4.2)个,siRNA-1组为(40.2±7.5)个,siRNA-2组为(42.8±8.6)个,组间比较差异有统计学意义(F=289.8,P=0.000);进一步两两比较,siRNA-1组、siRNA-2组细胞发生侵袭的数量较Blank组明显减少,差异有统计学意义(P<0.05),见图3。
2.5敲低SNHG6表达对LoVo细胞EMT进程的影响 LoVo细胞转染siRNA后,荧光定量PCR结果显示,4组细胞EMT标志物mRNA相对表达水平比较,差异有统计学意义(P<0.05);进一步两两比较,siRNA-1组、siRNA-2组E-cadherin相对表达水平高于Blank组,N-cadherin、Vimentin、Snail表达水平低于Blank组,差异有统计学意义(P<0.05),见表3。 Western blot结果显示,LoVo细胞转染siRNA后,siRNA-1组、siRNA-2组E-cadherin蛋白表达上调,N-Cadherin、Vimentin、Snail蛋白表达下调,见图4。
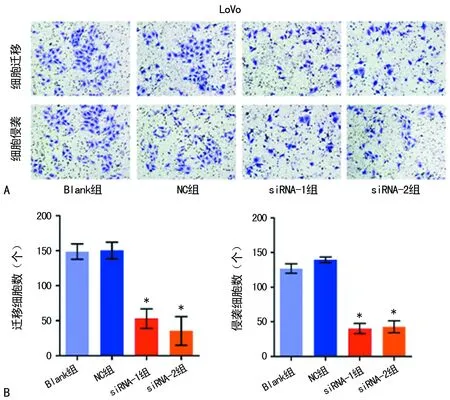
A:4组细胞迁移和侵袭情况(结晶紫染色,×200);B:4组细胞的迁移和侵袭数量比较;*:P<0.05,与Blank组比较
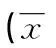
图3 4组LoVo细胞的迁移和侵袭细胞数比较
注:**:P<0.05,与Blank组比较

图4 4组LoVo细胞EMT标志物蛋白表达水平比较
3 讨 论
非编码RNAs(ncRNAs)是不具有蛋白质编码功能的RNAs,其中长度超过200个核苷酸的ncRNAs称为lncRNAs。通过高通量测序和组织芯片技术,研究者发现了成千上万的lncRNAs。越来越多的研究表明,lncRNAs参与了各种生理或病理过程的调节,其异常表达与多种人类疾病有关,如癌症[9]、阿尔茨海默症[10]及心脏病[11]。目前只发现少数lncRNAs与人类癌症的发生、发展有关,lncRNAs在癌症中的生物学功能尚不明确[12-13]。近期研究显示,SNHGs在恶性肿瘤的病理过程中存在差异表达。ZHAO等[7]发现SNHG5具有抑制胃癌发生的作用,其在胃癌组织的表达水平较癌旁组织下调;而陈宝珍等[14]报道,SNHG8在胃癌发生、发展中可能扮演原癌基因角色。本研究发现,SNHG6 mRNA高表达于结肠癌组织,与既往对肝细胞癌的研究报道一致[15]。该研究也指出,SNHG6可参与调节肝癌细胞的增殖和凋亡等过程;进一步研究发现,SNHG6通过与ZEB1、miR-101-3p等分子相互作用,调节肝癌细胞周期、凋亡等多种通路,从而引起肿瘤细胞的增殖、迁移等多种生物行为的改变[15]。本研究也发现,下调SNHG6的表达能够明显抑制结肠癌细胞的增殖、迁移及侵袭能力,提示SNHG6通过调控结肠癌的增殖和迁移影响肿瘤的发生、发展。
EMT是指上皮细胞失去其上皮特性,而向间质细胞转化的过程,该转变有助于肿瘤获得更强的迁移和侵袭能力,是肿瘤发生转移和复发的关键环节[16-17]。细胞发生EMT时,往往表现为E-cadherin等上皮表型表达下调,而N-cadherin、Vimentin等间质表型表达上调[18],该过程可以受许多因素调控,其中EMT相关转录因子Snail可以通过抑制E-cadherin的表达而促进EMT[19]。本研究发现,下调SNHG6表达后,LoVo细胞内E-cadherin表达上调,而N-cadherin、Vimentin及Snail均表达下调,说明敲低SNHG6的表达可以抑制结肠癌细胞的EMT过程,该抑制作用可能导致细胞迁移和侵袭等恶性生物学特性下降。
综上所述,本研究发现SNHG6在结肠癌中高表达,并可能通过调节结肠癌的增殖、迁移及侵袭能力而发挥促癌作用;SNHG6参与调节肿瘤的EMT过程,这是其促进结肠癌增殖和转移的可能机制之一。但本研究也存在诸多不足,如研究样本量还不够大、缺少FISH实验证实SNHG6基因的高表达、细胞实验深度不够等;SNHG6通过何种机制调控结肠癌进展,也需要继续深入研究。
[1]SEKIGUCHI M,MATSUDA T,SAITO Y.What is the optimal colorectal cancer screening program for an average-risk population?[J].Transl Gastroenterol Hepatol,2017,2(3):17.
[2]GRAY R T,CANTWELL M M,COLEMAN H G,et al.Evaluation of PTGS2 expression,PIK3CA mutation,aspirin use and colon cancer survival in a population-based cohort study[J].Clin Transl Gastroenterol,2017,8(4):e91.
[3]LI T,LIU X,JIANG Q,et al.High expression of partitioning defective 3-like protein is associated with malignancy in colorectal cancer[J].Tumour Biol,2017,39(4):1010428317698393.
[4]仝伟兵,刘志苏.长链非编码RNA核仁小分子RNA宿主基因12在肝细胞癌的表达及作用机制[J].中华实验外科杂志,2017,34(3):87-92.
[5]WANG Q,LI Q,ZHOU P,et al.Upregulation of the long non-coding RNA SNHG1 predicts poor prognosis,promotes cell proliferation and invasion,and reduces apoptosis in glioma[J].Biomed Pharmacother,2017,91:906-911.
[6]LIU J,LU C,XIAO M,et al.Long non-coding RNA SNHG20 predicts a poor prognosis for HCC and promotes cell invasion by regulating the epithelial-to-mesenchymal transition[J].Biomed Pharmacother,2017,89:857-863.
[7]ZHAO L,GUO H,ZHOU B,et al.Long non-coding RNA SNHG5 suppresses gastric cancer progression by trapping MTA2 in the cytosol[J].Oncogene,2016,35(44):5770-5780.
[8]BIRGANI M T,HAJJARI M,SHAHRISA A,et al.Long Non-Coding RNA SNHG6 as a potential biomarker for hepatocellular carcinoma[J].Pathol Oncol Res,2018,24(2):329-337.
[9]LIU Y,PAN S,LIU L,et al.A genetic variant in long non-coding RNA HULC contributes to risk of HBV-related hepatocellular carcinoma in a Chinese population[J].PLoS One,2012,7(4):e35145.
[10]TAN L,YU J T,HU N,et al.Non-coding RNAs in Alzheimer′s Disease[J].Mol Neurobiol,2013,47(1):382-393.
[11]SCHONROCK N,HARVEY R P,MATTICK J S.Long noncoding RNAs in cardiac development and pathophysiology[J].Circ Res,2012,111(10):1349-1362.
[12]HE Y,MENG X M,HUANG C,et al.Long noncoding RNAs:novel insights into hepatocelluar carcinoma[J].Cancer Lett,2014,344(1):20-27.
[13]FANG X Y,PAN H F,LENG R X,et al.Long noncoding RNAs:novel insights into gastric cancer[J].Cancer Lett,2015,356(2 Pt B):357-366.
[14]陈宝珍,林贤东,陈刚,等.长链非编码 RNA SNHG8在 EB 病毒相关胃癌中的表达及其临床意义[J].中华病理学杂志,2017,46(2):89-92.
[15]CHANG L,YUAN Y,LI C,et al.Upregulation of SNHG6 regulates ZEB1 expression by competitively binding miR-101-3p and interacting with UPF1 in hepatocellular carcinoma[J].Cancer Lett,2016,383(2):183-194.
[16]MARCHESI V.Breast cancer:epithelial-mesenchymal transitions in human breast cancer samples[J].Nat Rev Clin Oncol,2013,10(4):184.
[17]WAY T D,HUANG J T,CHOU C H,et al.Emodin represses TWIST1-induced epithelial-mesenchymal transitions in head and neck squamous cell carcinoma cells by inhibiting the β-catenin and Akt pathways[J].Eur J Cancer,2014,50(2):366-378.
[18]MOODY S E,PEREZ D,PAN T C,et al.The transcriptional repressor Snail promotes mammary tumor recurrence[J].Cancer Cell,2005,8(3):197-209.
[19]代剑波,王继见,郝亚琴.探讨Snail调控上皮间质转化在结直肠癌侵袭、转移方面的作用及意义[J].重庆医科大学学报,2011,36(6):645-649.

