慢性阻塞性肺疾病急性加重期患者T细胞免疫机制变化初探*
曾 文,秦 雯,胡大春,李梅华,唐树荣
(云南省昆明市第一人民医院:1.检验科;2.输血科;3.呼吸科 650011)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种吸入有害气体或颗粒产生异常慢性炎性反应导致气道受阻继而发展为慢性气管炎或伴随肺气肿的慢性疾病[1]。我国40岁以上人群的患病率高达8.2%[2]。预计到2020年,该病将成为世界第3位致死原因[3],将位居世界疾病经济负担第5位,是严重影响公共健康水平的重要疾病之一。COPD的发病机制复杂,至今尚未明了。已有的研究提示多种免疫机制失衡参与其中,尤其是Th1细胞、Th17细胞、调节性T细胞(regulatory T lymphocytes,Treg)等细胞免疫调节改变突出[4-7]。COPD动物模型研究显示Th17细胞及Treg细胞水平变化显著[8]。T淋巴细胞是一群异质性细胞的总称,均表达CD3分子,包括CD4+、CD8+、CD3+CD4-CD8-双阴性T细胞(double negative T cell,DNT)等。依据其功能分为辅助性T细胞(Th1细胞、Th2细胞、Th17细胞),具有抑制性功能的Treg、细胞毒T细胞等。它们通过细胞因子及其信号通路相互协助与相互制约,维持机体免疫动态平衡。先前的临床研究文献报道中对COPD疾病状态下,有关这些免疫细胞间及其与细胞因子间相互作用机制变化的阐述并不多见。为更深入理解COPD患者免疫机制的变化,以便临床更好地实施COPD免疫辅助治疗,预防急性加重期COPD(AECOPD)的发生、延缓病程进展,本研究选择COPD急性加重期患者48例和健康对照者30例,对外周血各类T淋巴细胞和相关的细胞因子的变化进行检测与多因素分析,初步探讨了COPD细胞免疫机制的变化,现报道如下。
1 资料与方法
1.1一般资料 选取2015年1月至2016年12月本院收治的48例AECOPD患者作为研究组。入选标准:(1)均符合美国呼吸病学会2009年修订的COPD诊断标准[1],并符合AECOPD的定义,即稳定期COPD患者急性起病、呼吸系统症状恶化,表现为呼吸困难、咳嗽、痰量最多或/和痰液呈脓性,临床或/和实验室检查没有发现其他可以解释的特异病因,导致需要改变药物治疗。(2)近3个月未患其他部位的感染性疾病。排除自身免疫病、糖尿病、肿瘤、各种慢性消耗性疾病及肝肾功能严重受损者、免疫抑制剂治疗者。其中男27例,女21例,年龄51~82岁,平均66.5岁。同时抽取30例健康体检者作为对照组。入选标准:(1)既往健康,无慢性呼吸系统疾病史;(2)近3个月未患感染性疾病;(3)血、尿、便常规及X线片检查正常。其中男13例,女17例,年龄20~50岁,平均35.0岁。本研究获得了本院伦理委员会批准;研究病例和对照者选取中,已告知研究对象本研究目的、内容,可能造成的明显和潜在不利影响,经知情同意后入选。
1.2仪器与试剂 仪器:细胞免疫项目采用贝克曼库尔特FC-500流式细胞仪检测。细胞因子项目采用Thermo酶标仪检测。试剂:细胞免疫项目试剂(荧光抗体CD4-FITC,CD127-PE,CD25-PC5,CD3-PC5,CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5)、标准荧光微球(flowcheck)及室内质控品由贝克曼库尔特公司生产。荧光抗体anti-IL-17-PE由eBiosciences公司生产。流式细胞荧光分选技术(FACS)溶血剂由BD公司生产。细胞因子项目试剂由Dldevelop公司生产。
1.3方法
1.3.1样本采集与处理 用BD公司生产真空采集管,空腹采集静脉血1管(肝素锂抗凝管),采集量2 mL、无抗凝血3 mL,前者24 h内进行处理和上机检测,后者2 h内离心分离血清,-80 ℃保存。样本处理过程中,排除严重溶血,黄疸和脂血样本。
1.3.2CD3+T细胞、CD4+T细胞、CD8+T细胞、DNT细胞检测 先将10 μL荧光抗体CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5加入到标准流式管底,再将100 μL抗凝血加入流式管中,轻轻混匀,室温避光孵育30 min,然后加入FACS溶血剂工作液1 mL,避光溶血15 min后,2 000 r/min离心5 min,弃上清液,加入1 mL磷酸盐缓冲液(PBS)重悬细胞,混匀后上流式细胞仪进行检测,采用4色分析,CD45-SS设门。
1.3.3Treg检测 先将10 μL荧光抗体CD4-FITC,CD127-PE,CD25-PC5加入到标准流式管底,再将100 μL抗凝血加入流式管中,轻轻混匀,室温避光孵育30 min,然后加入FACS溶血剂工作液1 mL,避光溶血15 min后,2 000 r/min离心5 min,弃上清液,加入1 mL PBS重悬细胞,混匀后上流式细胞仪进行检测,采用3色分析,CD4-SS设门。CD4+CD25+CD127low细胞群为Treg。
1.3.4Th17细胞检测 分离收集外周血单个核细胞,置入标准流式管中并调整细胞浓度至1×106个/mL,加入细胞刺激液,5%浓度CO2,37 ℃培养箱中放置8 h后,用PBS清洗细胞,PBS重悬。加入10 μL荧光抗体CD4-FITC、CD3-PC5、anti-IL-17-PE后避光4 ℃孵育30 min,上流式细胞仪检测。采用3色分析,CD3-SS设门。
1.3.5细胞因子的检测 IL-12、IL-22、IL-23R、IL-23、TNF-α均采用酶联免疫吸附试验(ELISA)双抗体夹心法进行检测。按照试剂说明书配制好酶标抗体、标准品、清洗液;将标准品逐倍稀释成7个浓度(1∶2~1∶64)后和样本一起逐个加入相应酶标孔。封板37 ℃孵育1 h后,加入酶标抗体,37 ℃孵育1 h后显色15 min,终止反应后使用酶标仪读取各酶标孔吸光度(OD)值,并用软件进行标准曲线拟合计算。
1.3.6肺功能检查 由本院呼吸科肺功能检查室完成,设备为德国耶格APS-PRO肺功能检查仪。选用用力肺活量(FVC)、第1秒用力呼出量(FEV1.0)、FEV1.0/ FVC比值为肺功能分析指标。

2 结 果
2.1各类T细胞水平的变化 研究组与对照组人群外周血CD3+T细胞、CD4+T细胞、CD8+T细胞、CD4+/CD8+T细胞、DNT、Treg、Th17细胞百分比检测结果见表1。研究组外周血CD8+T细胞水平较对照组低,差异有统计学意义(P<0.05);Treg、Th17细胞水平较对照组高,差异有统计学意义(P<0.01);CD3+T细胞、CD4+T细胞、CD4+T细胞/CD8+T细胞比值和DNT水平与对照组比较差异无统计学意义(P>0.05)。
2.2外周血细胞因子水平的变化 研究组与对照组人群外周血细胞因子IL-12、IL-22、IL-23、IL-23R、和TNF-α水平检测结果见表2。所检测的5种细胞因子在研究组患者外周血中水平较对照组高,差异有统计学意义(P<0.05)。
2.3T细胞及细胞因子间的相关性变化 研究组与对照组人群外周血T细胞及细胞因子间的相关性分析中,两组间存在相关性改变的结果见表3、4、5。其中:(1)研究组CD4+T细胞与CD8+T细胞、Th17与CD3+T细胞、Th17与CD8+T细胞无明显相关性(P>0.05),但对照组为负相关关系,差异有统计学意义(P<0.05);(2)研究组Th17与Treg为负相关关系,差异有统计学意义(P<0.01),但对照组为正相关关系,差异有统计学意义(P<0.05);(3)研究组IL-23与CD4+T细胞、TNF-α与DNT无明显相关性,差异无统计学意义(P>0.05),但对照组为正相关关系,差异有统计学意义(P<0.05);(4)研究组IL-22与IL-23为正相关关系,差异有统计学意义(P<0.05),但对照组无明显相关关系,差异无统计学意义(P>0.05);其余相关性在同向存在相关程度的差异。

表2 2组人群细胞因子水平分布[M(Q25,Q75)]
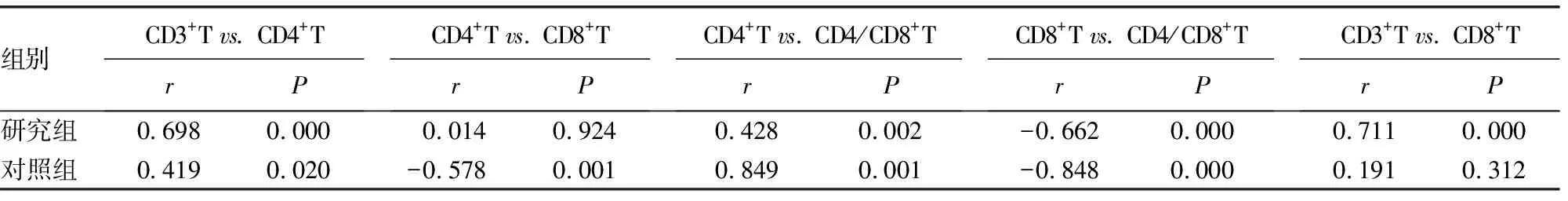
表3 两组患者T细胞间相关性变化

表4 两组患者Th17与其他T细胞相关性的变化
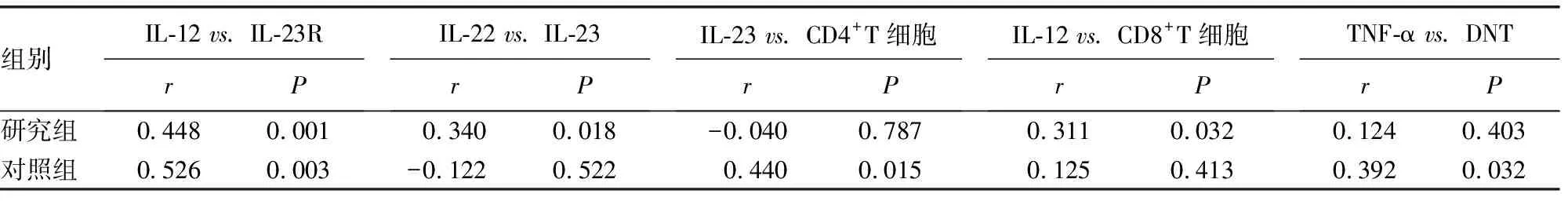
表5 两组患者细胞因子间及与T细胞相关性的变化
2.4AECOPD患者T细胞及细胞因子潜在联系分析 用因子分析方法对研究组和对照组13项观察指标进行潜在联系的分析,研究组和对照组分别存在5个公因子(即主成分),其总方差解释度分别为75.74%和77.89%。研究组和对照组5个主成分的特征值见表6。进入5个主成分的观察指标(负荷变量)及其系数与得分见表7、8。研究组与对照组比较,进入5个主成分的负荷变量发生了变化。

表6 2组主成分特征值

表7 研究组慢性阻塞性肺病急性加重期患者T细胞及细胞因子主成分变化
CD4:CD4+T细胞;CD8:CD8+T细胞;CD4/CD8:CD4+T细胞/CD8+T细胞
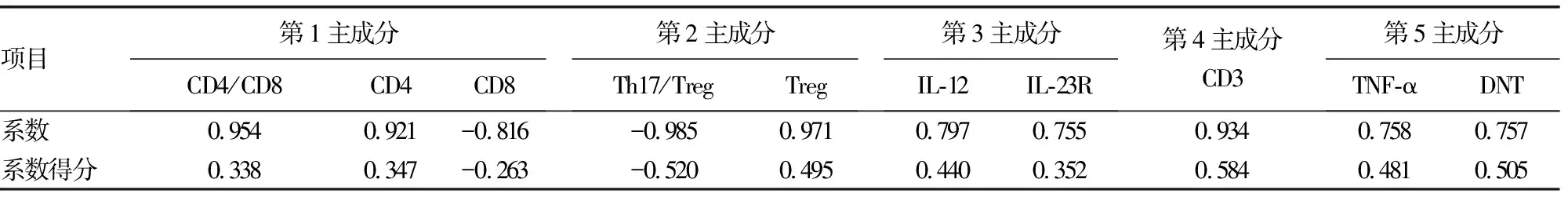
表8 慢性阻塞性肺病急性加重期患者T细胞及细胞因子主成分变化
CD4:CD4+T细胞;CD8:CD8+T细胞;CD4/CD8:CD4+T细胞/CD8+T细胞
2.5AECOPD患者T细胞及细胞因子与FVC、FEV1.0、FEV1.0/FVC的相关性 AECOPD患者的FVC、FEV1.0平均水平分别为(2.82±0.62)L、(2.11±0.43)L。Spearman相关性分析结果中,FEV1.0与第一主成分主要变量Th17/Treg、Th17、Treg存在相关性,相关系数r分别为-0.446(P=0.043)、-0.496(P=0.032)、0.467(P=0.033);FEV1.0/ FVC与TNF-α和IL-22存在相关性,相关系数r分别为-0.507(P=0.019)、-0.439(P=0.046);其余相关性差异无统计学意义(P>0.05)。
3 讨 论
COPD的主要病理改变为有害气体或颗粒导致气道黏膜的慢性炎症并持续发展,患者持续出现以咳嗽、咳痰、喘憋等为主要临床表现的慢性气管炎或合并伴随肺气肿。AECOPD即在稳定期COPD患者短期内出现上述等症状加重、咔脓痰或黏液痰,并伴发热等症状出现,其发病原因常可分为感染和非感染因素。COPD或AECOPD其病理生理分子机制仍不清楚。在遗传易感的基础上,气道受到吸烟等释放的有害物质刺激,引发局部固有免疫防御,进而适应性免疫应答参与其中,在修复有害物质对气道黏膜伤害的同时,产生炎症反应并反复持续发生,甚至停止吸烟后仍持续发展。大量的研究显示许多免疫细胞参与其中,主要有中性粒细胞、单核巨噬细胞、T淋巴细胞及多种细胞因子。免疫失衡是导致该病持续发展的重要病理生理机制,有学者提出其中还有自身免疫机制[9-10]。广泛的临床和动物模型研究均显示COPD病程中存在T淋巴细胞各亚群功能平衡紊乱,普遍观察到Th17、Treg细胞平衡紊乱,但存在不一致结果。有研究显示COPD病程中Th17细胞和IL-17表达增强,Treg降低;也有研究显示Treg细胞是升高而非降低,只是升高的幅度不及Th17细胞;也有学者认为在COPD不同阶段,Th17、Treg细胞平衡变化存在差异[11]。这些结果提示,COPD与AECOPD发生发展中,免疫失衡机制复杂,观察单方面或少数免疫细胞的增加或降低,难以找到其内在的免疫失衡机制。为此,本研究从多角度观察了AECOPD外周血不同功能分类的T淋巴细胞百分比变化,相关的细胞因子变化及它们相互关系的变化,并通过因子分析的统计学处理,寻找COPD疾病状态下主要免疫失衡机制。结果显示:(1)AECOPD患者外周血中各类T淋巴细胞水平的变化中,CD8+T细胞水平较健康对照人群降低;Treg、Th17细胞水平较健康对照人群升高,但Treg升高的幅度不及Th17。(2)细胞因子层面观察到AECOPD患者外周血IL-12、IL-22、IL-23、IL-23R和TNF-α水平较健康对照人群均升高。(3)通过对各类T细胞及细胞因子间的相关性分析发现,AECOPD疾病状态下,CD4+T细胞与CD8+T细胞、CD3+T细胞与Th17、Th17与CD8+T细胞由负相关变为无相关;Th17与Treg由正相关(r=0.403)变为高度负相关(r=-0.883);IL-23与CD4+T细胞、TNF-α与DNT由正相关变为无明显相关性;IL-22与IL-23由无相关性变为正相关;其余指标之间的相关性存在相同方向相关程度的变化。(4)因子分析的结果显示,在AECOPD状态下,主成分中负荷变量发生了诸多变化:健康状态时处于第2主成分的Th17、Treg平衡机制上升为第1主成分,成为主要的免疫平衡机制;而健康状态时以CD4+T细胞、CD8+T细胞平衡为首的机制退居第2,以IL-12、IL-23R为主要变量的第3主成分退居第4,出现CD4+T细胞、CD3+T细胞为主要变量的第3主成分。以TNF和DNT为主要变量的第5主成分退出主成分,但出现了以IL-23和IL-22为主要变量的第5主成分。(5)T细胞及细胞因子与FVC、FEV1.0、FEV1.0/FVC的相关性显示,AECOPD患者FEV1.0与Th17呈负相关,与Treg呈正相关;FEV1.0/ FVC与TNF和IL-22呈负相关。
以上这些结果提示:(1)通过患者外周血中免疫细胞和细胞因子的监测,可以观察到AECOPD状态下机体免疫功能的变化,有助于指导其免疫辅助治疗,因此,可以作为COPD的实验室监测指标。(2)AECOPD状态下,原有的机体免疫平衡机制受到破坏,产生了以Th17、Treg变化为主的平衡紊乱:更多的CD4细胞向Th17极化,促进Th17细胞增多,而具有免疫抑制功能的Treg细胞增多不到位,并出现负相关性改变;IL-12、IL-22、IL-23、IL-23R和TNF-α等细胞因子均参与其中,但以IL-22与IL-23为主,且IL-23主要促进T淋巴细胞向Th17分化与增殖,并分泌IL-22,后者进一步诱导中性粒细胞集落刺激因子的分泌并促进中性粒细胞的趋化到气道,加重炎性反应和气道受阻的程度;CD8的细胞毒作用、DNT的调节作用受到弱化。由此可以推测,COPD病理生理机制中的主要矛盾可能是:外因引发的Th17细胞功能增强超过抵御外因所致的损伤,进而导致过度免疫甚至自身免疫。
由于到本院住院救治的COPD患者均为AECOPD患者,本研究中研究对象主要从住院患者中募集,因此,未能募集到稳定期COPD患者,未对稳定期患者进行分组对比分析,上述观察到的免疫平衡紊乱是否也存在于COPD稳定期患者,有待进一步观察。
[1]RABE K F,HURD S,ANZUETO A,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:Gold executive summary[J].Am J Respir Crit Care Med,2007,176(6):532-555.
[2]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J/CD].中国医学前沿杂志(电子版),2014,36(2):67-79,80.
[3]Raherison C.Epidemiology of chronic obstructive pulmonary disease[J].Nihon Rinsho,2009,38(3):400.
[4]ZHANG J,CHU S,ZHONG X,et al.Increased expression of CD4+IL-17+cells in the lung tissue of patients with stable chronic obstructive pulmonary disease (COPD) and smokers[J].Int Immunopharmacol,2013,15(1):58-66.
[5]SMYTH L J,STARKEY C,VESTBO J,et al.CD4-regulatory cells in COPD patients[J].Chest,2007,132(1):156-163.
[6]ISAJEVS S,TAIVANS I,STRAZDA G,et al.Decreased FOXP3 expression in small airways of smokers with COPD[J].Eur Respir J,2009,33(1):61-67.
[7]PLUMB J,SMYTH L J,ADAMS H R,et al.Increased T-regulatory cells within lymphocyte follicles in moderate COPD[J].Eur Respir J,2009,34(1):89-94.
[8]WANG H,PENG W,WENG Y,et al.Imbalance of Th17/Treg cells in mice with chronic cigarette smoke exposure[J].Int Immunopharmacol,2012,14(4):504-512.
[9]HONG S C,LEE S H.Role of th17 cell and autoimmunity in chronic obstructive pulmonary disease[J].Immune Netw,2010,10(4):109-114.
[10]ROVINA N,KOUTSOUKOU A,KOULOURIS N G.Inflammation and immune response in COPD:where do we stand[J].Mediators Inflamm,2013,2013(5):1-9.
[11]张兰英,陈杰,欧阳瑶.DCs、Th17及Treg在COPD发病机制中作用的研究进展[J].医学研究杂志,2016,45(7):18-20.

