儿童过敏性哮喘患者中Th17/Treg比值与IDO相关性的研究*
胡 影,陈志强,金 玲,王 梅,廖 伟
(陆军军医大学附属西南医院儿科,重庆 400038)
过敏性哮喘(哮喘)是一种以气道高反应性为特征的变态反应性炎症性疾病,近年来发现Th17细胞及调节性T细胞(Treg)在哮喘发病中占有重要地位。吲哚胺-2,3-双加氧酶(indoleamine 2,3 dioxygenase,IDO)是一种色氨酸分解代谢的限速酶,在外周免疫耐受中有重要作用,近年发现在过敏性疾病中有重要的作用[1-2]。有研究显示气道内类浆细胞样DC(plasmacytoid DC,pDC)可诱导CD4+T细胞分化成Treg诱导免疫耐受[3],有趣的是Treg致耐受性是通过其表达IDO来抑制T细胞分化实现的[4]。因此笔者推测在儿童过敏性哮喘患者中Th17/Treg失衡与IDO具有关联性。而目前IDO、Th17/Treg失衡与儿童过敏性哮喘关系的临床研究尚未见报道,本研究探讨儿童过敏性哮喘患者中IDO水平与Th17/Treg失衡的关联性及其可能的分子机制。
1 资料与方法

表1 观察组与对照组临床及实验室特征
1.1一般资料 从本院儿科门诊患儿中产生,总计入组5岁以上过敏性哮喘患儿(根据病情严重程度进行回顾性分级)33例(该例数为通过预期差异显著性推算出,观察组),并收入33例同期体检的年龄、性别匹配的健康儿童作为对照组。选取患儿及对照组时已考虑患者年龄、性别等的代表性和普遍性,减少偏移,分布尽量呈正态,两组临床资料具有可比性。该实验已在中国临床试验注册中心注册通过,注册号为ChiCTR-COC-15006080;并在本医院伦理委员会会议审查通过;所有入组对象均在患儿家属处签署知情同意书。观察组患者纳入标准:(1)年龄5~12岁;(2)初次诊断和既往虽然被诊断但尚未按哮喘规范治疗;(3)2周内未接受吸入性糖皮质激素、白三烯受体拮抗剂等治疗。哮喘诊断标准:(1)反复发作喘息、咳嗽、气促、胸闷,多与接触变应原、冷空气、物理或化学性刺激、呼吸道感染及运动等有关,常在夜间和(或)清晨发作或加剧;(2)发作时在双肺可闻及散在或弥漫性,以呼气相为主的哮鸣音,呼气相延长;(3)上述症状和体征经抗哮喘治疗有效或自行缓解;(4)除外其他疾病所引起的喘息、咳嗽、气促和胸闷;(5)临床表现不典型者(如无明显喘息或哮鸣音),应至少具备以下1项:①支气管激发试验或运动激发试验阳性;②证实存在可逆性气流受限,即支气管舒张试验阳性:吸入速效β2受体激动剂硫酸沙丁胺醇后15 min第一秒用力呼气量(FEV1)增加大于12%;③最大呼气流量(PEF)每日变异率(连续监测1~2周)20%。符合第1~4条或第4,5条者,可以诊断为哮喘。对照组入选标准:同期募集儿科门诊体检的健康儿童33例(未罹患哮喘,近期无感染性疾病、免疫性疾病、无心肺疾病,近2周未使用糖皮质激素及免疫调节剂),年龄和性别等均有较好的分布和代表性。排除标准:(1)近2周内口服或静脉使用过糖皮质激素或免疫调节剂;(2)合并其他免疫性疾病如结核病、系统性红斑狼疮、幼年性特发性关节炎等;(3)发病4周内曾患感染性疾病,如上呼吸道感染、肺炎等;(4)心肺功能衰竭者。
1.2方法 对受试对象进行完整的病史采集、体格检查、肺功能检查、皮肤点刺过敏原检测、嗜酸性粒细胞计数(EC);外周静脉血检测,确定纳入为试验对象后立即对观察组及对照组儿童进行血液采集1次,处理步骤如下,(1)标本采集:采集受试者静脉血4 mL(肝素抗凝)。全血离心后收集血浆于-80 ℃冻存。Ficoll密度梯度离心法分离外周血单个核细胞(PBMC);(2)指标检测:流式细胞术(FACS)检测Th17细胞[CD4+RORγt+白细胞介素(IL)-17+T细胞]及调节性T细胞(CD4+CD25+Foxp3+T细胞);聚合酶链反应(ELISA)检测血浆及PBMC中的IL-10、IL-17、IL-6、转化生长因子-β(TGF-β)细胞因子水平;高效色谱液相法(HPLC)检测色氨酸及犬尿氨酸浓度。用犬尿氨酸浓度 (μmol/L)/ 色氨酸浓度(μmol/L)来反映IDO活性水平。诱导痰检测:确定纳入为试验对象后立即对观察组及对照组儿童进行诱导痰液采集1次,3%高渗盐水(1.5 mL 10% NaCl+2.5 mL 0.9% NaCl)雾化后吸痰;诱导痰上清液保存于-70 ℃,用HPLC检测色氨酸及犬尿氨酸浓度。
1.3统计学处理 采用SPSS18.0软件对所有数据进行统计学分析,多组比较前先进行正态分布检验(Kolmogorov-Smirnov和Shapiro-Wilk检验)和方差齐性检验(Levene检验),对于满足正态分布和方差齐性的组间计量资料采用独立样本t检验,实验结果用均值(95%CI)表示;对于不满足正态分布的资料采用非参数统计分析中的 Mann-WhitneyU检验,实验结果用中位数(四分位数间距)[M(Q25,Q25)]表示;对于分析多组间的相关性采用多元线性回归分析;以P<0.05为差异有统计学意义。
2 结 果
2.1观察组与对照组临床及实验室检查特征 两组对象临床特征见表1,与预期的一致,两组患儿年龄、性别相匹配,差异无统计学意义(P>0.05);与对照组比较,观察组儿童皮肤点刺试验阳性率显著升高(P<0.01),EC显著升高(P<0.01);观察组肺功能指标FEV1.0/FVC%显著下降(P<0.01)。
2.2过敏性哮喘组及对照组诱导痰及血中IDO活性表达 观察组诱导痰液中IDO活性水平较对照组显著降低(P<0.01),外周血中IDO活性水平较对照组相比亦显著降低(P<0.01),见表1、图1。

A:诱导痰;B:外周血;a:P<0.01,b:P<0.01
图1观察组及对照组诱导痰及外周血IDO活性水平
2.3观察组及对照组外周血中Th17细胞、Treg的表达 采用流式细胞术检测Th17细胞(CD4+ROR-γt+IL-17+)及Treg细胞(CD4+CD25+Foxp3+)(图2A、C)。观察组Th17细胞较对照组明显升高(图2B),P<0.05;而Treg较对照组明显降低(图2D),P<0.05。与对照组对比,观察组中Th17/Treg比例明显升高(图2E),P<0.05。
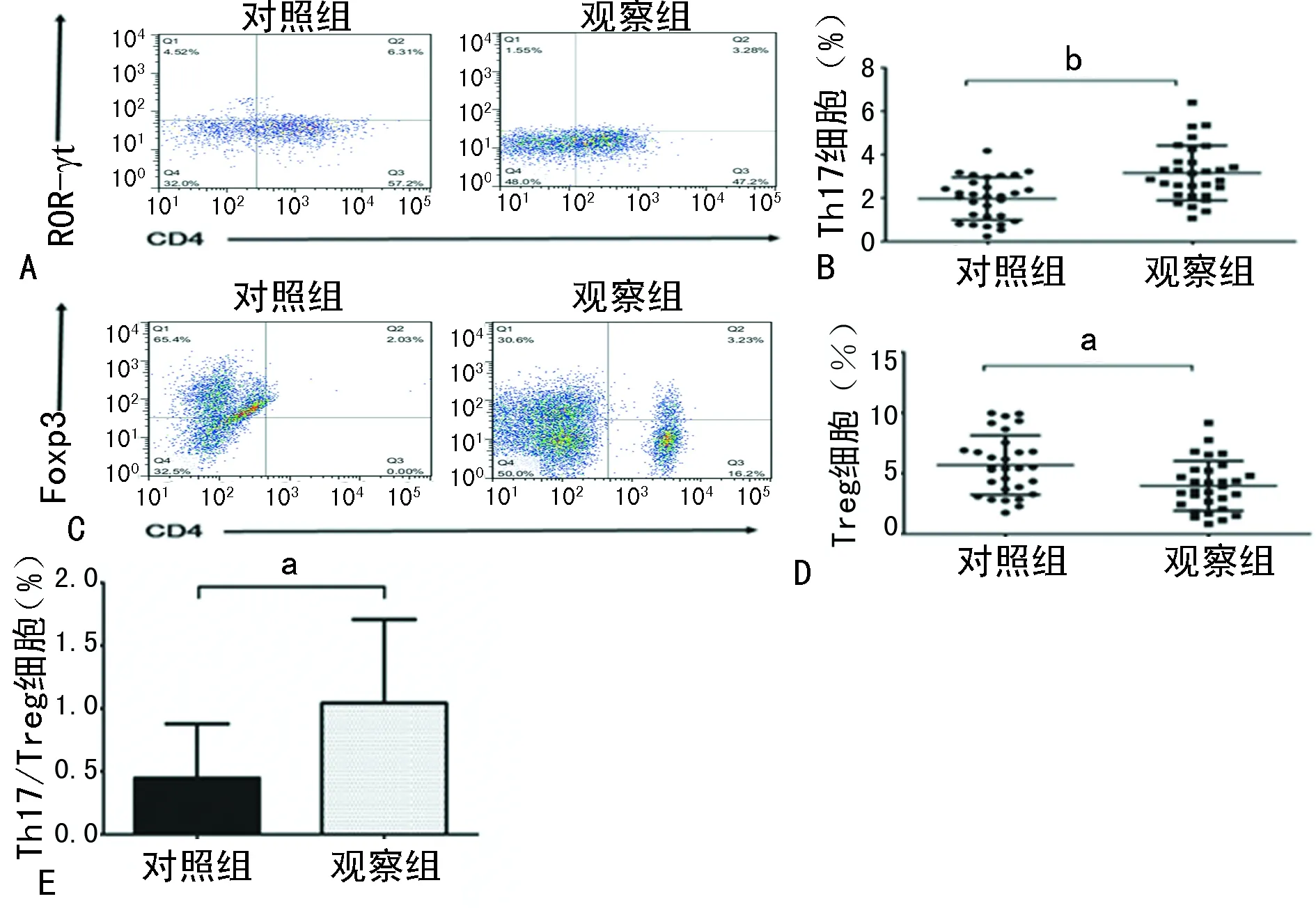
A:外周血Th17细胞流式图像;B:外周血中Th17细胞表达散点图;C:外周血Treg流式图像;D:外周血中Treg表达散点图;E:外周血中Th17/Treg比例分析图;a:P<0.05,b:P<0.01
图2流式细胞术检测对照组及观察组外周血中Th17细胞、Treg、Th17/Treg比例
2.4外周血中Th17细胞和Treg相关细胞效应因子的表达水平 观察组外周血PBMC中IL-17、IL-6表达水平较对照组明显升高(P<0.01、P<0.01);TGF-β、IL-10表达水平较对照组明显降低(P<0.01),见表2。

表2 对照组及哮喘组外周血中Th17和Treg细胞相关细胞效应因子的表达水平
2.5儿童过敏性哮喘患者诱导痰液及外周血中IDO活性与Th17/Treg失衡间相关性分析 在儿童过敏性哮喘患者中,诱导痰液中IDO活性均与外周血Treg细胞浓度呈正相关性,与Th17细胞浓度无明显相关性,与Th17/Treg比例呈负相关性,见表3、图3。外周血中IDO活性与Th17、Treg、Th17/Treg之间的关系亦呈现相同规律,见表4、图4。

A:IOD与Th17相关性;B:IDO与Treg相关性;C:IDO与Th17/Treg比例相关性
图3观察组诱导痰中IDO活性与Th17细胞、Treg、Th17/Treg比例间的相关性

图4 观察组外周血中IDO活性与Th17细胞、Treg、Th17/Treg比例间的相关性

IDO(诱导痰)Th17TregTh17/TregPearson 相关性-0.1760.524-0.418P(双侧)0.3520.0030.007

表4 哮喘组外周血中IDO水平与Th17细胞、Treg、Th17/Treg比例间的相关性
3 讨 论
Th1/Th2失衡是过敏性哮喘发病机制中的关键环节。然而近年来发现Th17细胞及Treg细胞在哮喘发病中也占有重要地位。Treg细胞不同于Th1和Th2细胞,它具有免疫抑制功能, Treg细胞的形成在气道对过敏原的免疫耐受中占有重要地位[5]。气道Treg细胞诱导的免疫耐受可能与其表达细胞毒性T淋巴细胞相关抗原-4(CTLA-4),分泌IL-10、TGF-β等细胞因子有关[6]。本研究亦发现在儿童过敏性哮喘患者中Treg表达受抑制,IL-10、TGF-β等细胞因子表达亦明显减少。Th17细胞是2005年新发现的CD4+T 细胞亚群,以分泌IL-17为特征,ROR-γt是其重要转录因子,IL-17不仅介导中性粒细胞性气道炎症,也调节嗜酸性粒细胞和巨噬细胞性炎症等,与哮喘发病密切相关[7]。Th17细胞和Treg细胞来源于共同的初始T细胞,在不同的细胞因子环境下分化而成,在分化功能上相互抑制对维持体内免疫稳态起重要作用。因此哮喘发生时CD4+T细胞除了向Th2细胞偏移外,还在某些因子影响下向Th17细胞偏移,而抑制了Treg细胞的生成。本研究证实大于5岁的过敏性哮喘儿童患者中仍然存在Th17/Treg的失衡;且与正常儿童比较,IL-17、IL-6水平显著升高,TGF-β、IL-10水平显著降低。
IDO是一种色氨酸分解代谢的限速酶,其在感染、妊娠、自身免疫及瘤样病变中的免疫调节及免疫诱导作用已经得到广泛认可;IDO在嗜酸性粒细胞、内皮细胞及肺上皮细胞中也被检测到,显示出其在过敏反应中的作用[8-9]。但国内外在儿童过敏性哮喘患者气道诱导痰液中IDO的活性情况尚无相关研究报道。本试验研究发现IDO在过敏性哮喘儿童患者外周血及诱导痰液中的表达均较健康儿童显著降低。提示IDO活性可抑制气道过敏反应,在儿童过敏性哮喘发病机制中可能起到保护性作用。
有研究证实IDO活性在过敏症患者中低于正常健康个体[10];没有临床症状的过敏患者血浆IDO活性及IL-10水平均比有症状的过敏患者及健康个体高[11]。MANEECHOTESUWAN等[12-13]研究发现轻中度持续成年哮喘患者诱导痰中IDO的低活性可通过吸入糖皮质激素后增强,其可能是通过刺激IL-10的产生来介导的;且辛伐他汀增强糖皮质激素对Th17/Treg失衡的调节作用也是通过上调IDO及IL-10,下调IL-6、IL-23的表达来实现的。因此本研究推测IDO在Th17/Treg分化失衡机制中可能扮演了非常重要的角色,且可能与IL-6、IL-10等细胞效应因子有关。另外,BETTELLI等[14]研究发现,小鼠体内Th17和iTreg产生于同一前体细胞CD4+Foxp3-T细胞,当加入TGF-β时,此细胞转化为Foxp3+Treg细胞;但当加人TGF-β和IL-6时,此CD4+Foxp3-的T细胞转化为Th17细胞[14],表明IL-6做为关键细胞因子决定CD4 Foxp3-T细胞是转化为Treg还是Th17细胞。有趣的是BABAN等[15]报道在IL-6基因敲出的大鼠静脉注射IDO诱导剂ISS-ODN后,在脾脏发现Treg增多,而皮下注射IDO抑制剂1-MT后可使脾脏pDC表达IL-6,从而使Treg向Th17细胞转化[15]。因此更加证实了IDO在Th17/Treg分化失衡中的作用:即在一定条件下IDO可作为Th17细胞向Treg转换的分子“开关”。 与这些试验研究结果一致,本临床研究显示正常健康儿童IDO水平及Treg表达均较过敏性哮喘儿童高,且两者呈显著的正相关关系,而IDO水平与Th17/Treg比例呈负相关关系,且IL-6水平明显降低,而IL-10水平显著升高。因此本研究推测IDO参与了Th17/Treg分化过程,根据实验结果结合国外文献分析,笔者推测IDO可能是通过抑制IL-6表达、促进IL-10产生而使Th17细胞向Treg转化来发挥其保护作用的。当然,这仍需进一步体外实验给予论证。
[1]GOSTNER J M,BECKER K,KOFLER H,et al.Tryptophan metabolism in allergic disorders[J].Int Arch Allergy Immunol,2016,169(4):203-215.
[2]VON BUBNOFF D,BIEBER T.The indoleamine 2,3-dioxygenase (IDO) pathway controls allergy[J].Allergy,2012,67(6):718-725.
[3]BURCHELL J T,STRICKLAND D H,STUMBLES P A.the role of dendritic cells and regulatory T cells in the regulation of allergic asthma[J].Pharmacol Ther,2010,125(1):1-10.
[4]HAYASHI T,BECK L,ROSSETTO C,et al.Inhibition of experimental asthma by indoleamine 2,3-dioxygenase[J].J Clin Invest,2004,114:270-279.
[5]SAKAGUCHI S,YAMAGUCHI T,NOMURA T,et al.Regulatory T cells and immune tolerance[J].Cell,2008,133(5):775-787.
[6]PALOMARES O,YAMAN G,AZKUR AK,et al.Role of Treg in immune regulation of allergic diseases[J].Eur J Immunol,2010,40(5):1232-1240.
[7]DURRANT D M,METZGER D W.Emerging roles of T helper subsets in the pathogenesis of asthma[J].Immunol Invest,2010,39(4/5):526-549.
[8]JALILI R B,FOROUZANDEH F,BAHAR M A,et al.The immunoregulatory function of indoleamine 2,3-dioxygenase and its application in allotransplantation[J].Iran J Allergy Asthma Immuno,2007,6(4):167-79.
[9]CURTI A,TRABANELLI S,SALVESTRINI V,et al.The role of indoleamine 2,3-dioxygenase in the induction of immune tolerance:focus on hematology.[J].Blood,2009,113(11):2394-2401.
[10]RAITALA A,KARJALAINEN J,OJA S S,et al.Indoleamine 2,3-dioxygenase (IDO) activity is lower in atopic than in non-atopic individuals and is enhanced by environmental factors protecting from atopy.[J].Mol Immunol,2006,43(7):1054-1056.
[11]VON BUBNOFF D,FIMMERS R,BOGDANOW M,et al.Asymptomatic atopy is associated with increased indoleamine 2,3-dioxygenase activity and interleukin-10 production during seasonal allergen exposure[J].Clin Exp Allergy,2004,34(7):1056-1063.
[12]MANEECHOTESUWAN K,SUPAWITA S,KASETSINSOMBAT K,et al.Sputum indoleamine-2,3-dioxygenase activity is increased in asthmatic airways by using inhaled corticosteroids.[J]J Allergy Clin Immunol,2008,121(1):43-50.
[13]MANEECHOTESUWAN K,KASETSINSOMBAT K,WAMANUTTAJINDA V,et al.Statins enhance the effects of corticosteroids on the balance between regulatory T cells and Th17 cells[J].Clin Exp Allergy,2013,43(2):212-222.
[14]BETTELLI E,CARRIER Y,GAO W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[15]BABAN B,CHANDLER P R,SHARMA M D,et al.IDO activates regulatory T cells and blocks their conversion into Th17-like T cells[J].J Immunol,2009,183(4):2475-2483.

